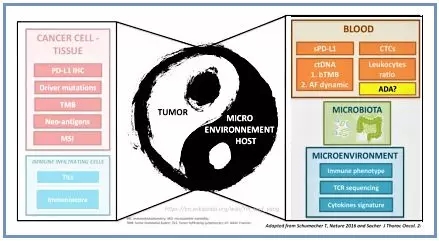
免疫治疗已被证明在多种癌症中发挥重要的抗肿瘤效应,尽管CTLA4和PD-L1/PD-1抗体已在
临床试验中取得成功,但仅有小部分患者表现持久性的
临床应答,表明现阶段对于癌症
免疫仍然需要更为广泛的认识。
一、直系亲属
对于免疫治疗来讲,PD-L1、MSI、TMB应该是最主流的生物标记物,有大量的临床试验已经证实,与免疫治疗临床获益评价最为密切,相较其他陆续出现但尚未获得大规模临床验证的分子标记物,这三个应该属于传统意义上的“直系亲属”。首先,简单回顾下三个“直系亲属”的作用机制及临床指导价值。
1.PD-L1表达
PD-L1(程序性死亡配体1)是最重要的免疫检查点蛋白之一,可在多种细胞表面表达,包括肿瘤细胞。PD-L1是PD-1的配体,PD-1与PD-L1结合后可提供抑制性信号,诱导T细胞凋亡,抑制T细胞的活化和增殖。肿瘤细胞通过表达PD-L1连接到T细胞的PD-1蛋白上,启动免疫逃逸机制。当肿瘤细胞表面的PD-L1与PD-1连接以后,T细胞就不能发现肿瘤并向免疫系统发出攻击肿瘤的信号。PD-1/PD-L1抗体的作用机制即是通过阻止配体受体之间的结合,保证T细胞正常发挥抗肿瘤作用。
目前,临床上主要是通过IHC方法进行PD-L1表达检测,PD-L1高表达患者使用PD-1/PD-L1抗体类药物响应率更高。对于PD-L1的表达水平对临床获益的指导在不同癌种中有不同的评价标准,但尚未达成完全一致,如在
肺癌中:
◆ 基于KEYNOTE-024研究结果,
FDA批准对于PD-L1表达≥50%,且无明确驱动基因突变的初诊的晚期
NSCLC患者可以一线选择pembrolizumab;
◆ CheckMate 057研究的非鳞NSCLC患者中,nivolumab治疗组优于多西他赛治疗组的OS获益几乎全部都由肿瘤细胞PD-L1>10%患者所贡献。
目前PD-L1检测仍然存在一些问题:
◆检测技术方面,如不同的检测抗体以及不同的阈值问题;
◆生物学方面,如肿瘤内和肿瘤间异质性;
◆组织来源方面,如存档标本与新鲜标本,原发灶与转移灶等等。
2.MSI
微卫星 (Microsatellite) 是遍布于人类基因组中的短串联重复序列, 有单核苷酸、双核苷酸或高位核苷酸的重复,重复次数 10-50 次。MSI,是指由于在DNA复制时插入或缺失突变引起的DNA重复序列长度改变的现象,常由错配修复(MMR)功能缺陷引起。
2017 年,FDA 批准 Keytuda 用于治疗 MSI-H 或 dMMR 的实体瘤患者。这是首款不依照肿瘤来源,而是依照分子标记物进行区分的抗肿瘤疗法,具有里程碑式的意义。临床试验中 86 例具有 MSI-H 特征的实体瘤患者,客观缓解率高达 54%,疾病控制率达 72%。
目前对于MSI的检测多数是采用金标准多重荧光PCR-毛细管电泳法进行检测,检测位点基本均包含NIH建议的单核苷酸位点,不过该类方法依然存在以下几个方面的不足:
◆需要耗费一定的时间和人力;
◆试验中所选微卫星位点数量有限,存在组织特异性,无法准确在多种肿瘤中检测MSI状态。
基于NGS的大规模应用,现在已有基于NGS对MSI检测的方法和软件。该类检测方法利用测序数据,从MSI的表型特征及产生机制层面,对样本的MSI状态作出全面评估。
3.TMB
肿瘤突变负荷(Tumor Mutation Burden,TMB),是一种可定量的生物标志物,用来反映肿瘤细胞中所含有的突变数目,通常用肿瘤细胞基因组编码区的每百万碱基突变数来衡量,表示为:X mut/MB。
目前市面上,几乎每家基因检测公司都有相应的检测panel产品可提供TMB检测,但实际上TMB对panel本身的设计是有一定要求,并不是所有大panel都适合做TMB。Panel中选择的基因与肿瘤的关联性,基因的数量,覆盖的基因区域等都对TMB有着重要的影响。一般建议panel的编码区域要≥1.0Mb。
2017年, 新英格兰医学杂志上的一篇文章绘制了27种肿瘤的中位TMB与免疫检查点抑制剂治疗的客观缓解率(ORR)之间的线性图,发现TMB与ORR存在显着的相关性(P<0.001),相关系数为0.74,表明:TMB越高的肿瘤从PD-1/PD-L1抗体治疗中的获益越显着。而基于大量的循证医学证据,今年刚刚推出的非小细胞
肺癌NCCN
指南中,TMB赫然在列,成为非小细胞
肺癌患者接受免疫治疗的推荐检测指标。

当前,TMB的检测主要是用组织样本,文献报道也多数为FFPE样本。随着技术的发展,尤其是临床组织难以获取的情况下,用外周血的ctDNA样本也是可以的,但是二者之间的TMB-H cutoff 值不太一样。目前还是组织为主,
血液为辅,数据报道显示,组织TMB-H一般≥20,
血液TMB-H一般≥16。
二、旁系亲属
针对免疫治疗,除了目前在临床上得到认可的上述3种分子标记物外,不断有新的分子标记物逐渐涌现,但多数是针对特定癌种的报道,尚未得到大规模临床试验的验证,接下来,了解下这些新近出现的“旁系亲属”。
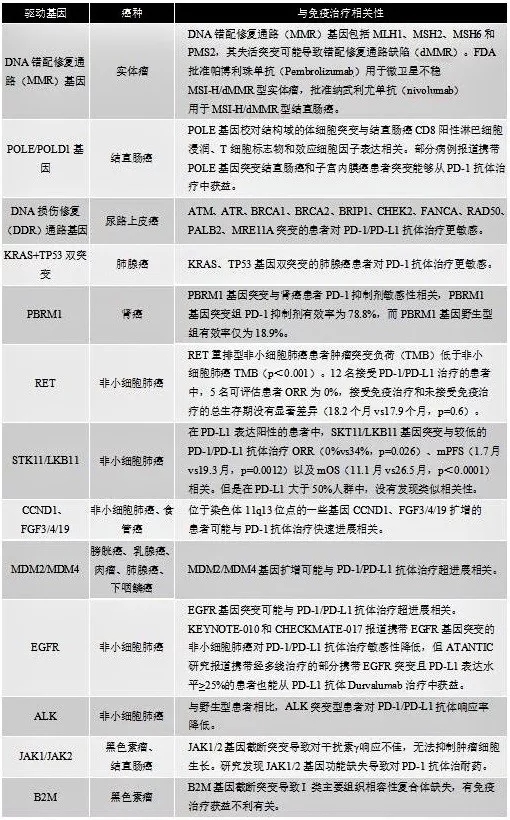
1.Driver mutation
基因层面研究显示,某些基因的突变可能与免疫治疗的应答有关。
2.TILS(肿瘤浸润淋巴细胞)
已有相关报道,免疫治疗的效果和肿瘤是否被免疫细胞浸润有关,若是肿瘤中无肿瘤浸润T细胞,PD-1药物将毫无用武之地。所以,肿瘤组织中有丰富的T细胞,那它对免疫疗法的响应较高。
Neo-antigens(肿瘤新生抗原)
新生抗原是肿瘤细胞内因突变而产生的肿瘤特异性抗原,只在肿瘤细胞中表达,是T细胞识别癌细胞的的理想靶点,可激发强烈的抗肿瘤免疫反应。
肿瘤携带的突变到新生抗原在细胞内部会经过很复杂的过程(从DNA→RNA→蛋白翻译→蛋白降解→TAP转运→抗原呈递→膜上表达→MHC识别等),而肽段与MHC的识别仅仅是其中一个步骤。因此需要综合考虑表达、克隆、MHC的亲和力、TCR的亲和力等信息。
随着免疫疗法的发展,科学家们还在不断进行有关生物标记物的研究。对于癌症患者来说,寻找适合自己的免疫疗法显得尤为重要。只有这样,才能一定程度上降低了他们治疗方案选择不合理的可能性,节约金钱的同时,也让患者得到了及时、合理的治疗,达到“精准医疗”的效果。
来源:莲和医疗
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言