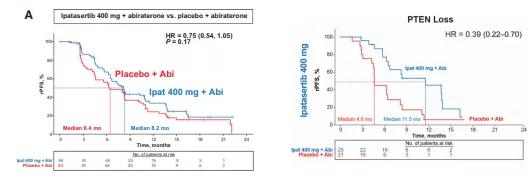
Nat Med:全基因组种系与前列腺癌表观遗传背景相关
![]() 0
2019-10-07
点击查看
0
2019-10-07
点击查看
Sci Rep:前列腺癌细胞中AR无差异抗雄激素抗性驱使因子分析
![]() 0
2019-10-08
点击查看
0
2019-10-08
点击查看
Sci Rep:亚洲前列腺癌患者中周围血栓栓塞性血管疾病与雄激素阻断治疗相关性分析
![]() 0
2019-10-12
点击查看
0
2019-10-12
点击查看
Cell Death & Disease:前列腺癌中PAX5能够诱导IDH1-AS1上调来促进肿瘤的生长
![]() 0
2019-10-13
点击查看
0
2019-10-13
点击查看
Cell Death & Disease:前列腺癌中靶向Wnt/EZH2/microRNA-708信号途径能够抑制神经纤维瘤分化
![]() 0
2019-10-14
点击查看
0
2019-10-14
点击查看
Nat Commun:日本人群全基因组关联分析鉴定了12个新的前列腺癌易感位点
![]() 0
2019-10-17
点击查看
0
2019-10-17
点击查看