
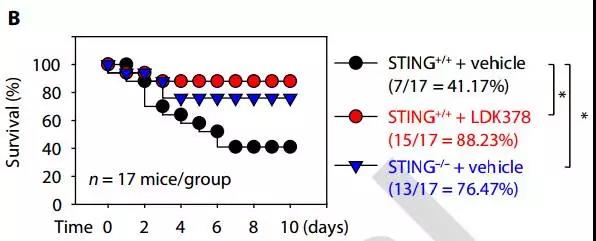

Crit Care Med:退热治疗能否降低脓毒血症成年患者的28日死亡率
![]() 0
2017-05-24
点击查看
0
2017-05-24
点击查看
Crit Care Med:降钙素原水平可预测脓毒血症患者28日全因死亡率
![]() 0
2017-05-24
点击查看
0
2017-05-24
点击查看
Crit Care Med:肥胖的危重脓毒血症患者常规哌拉西林剂量有无不足或过量?
![]() 0
2017-05-24
点击查看
0
2017-05-24
点击查看

Crit Care Med:ICU脓毒血症患者住院前口服糖皮质激素与ARDS风险降低相关
![]() 0
2017-05-24
点击查看
0
2017-05-24
点击查看
重复:N Engl J Med:脓毒血症快速治疗能否赢得更多的生存机会?
![]() 0
2017-07-19
点击查看
0
2017-07-19
点击查看
Lancet:怎样缓解对疑似早发性脓毒症新生儿的抗菌药物过度治疗?
![]() 0
2017-08-11
点击查看
0
2017-08-11
点击查看
