Tako-tusbo综合征(Tako-tusbo syndrome,TTS),又名应激性心肌病,由日本学者于1990年首次报道,其特征表现为短暂性可逆性心室局部收缩功能障碍,且不能用冠状动脉粥样硬化性疾病来解释所观察的一过性心室功能障碍。已知多种中枢神经系统疾病可能会引起一系列心功能异常,其中包括TTS。本文描述了1例罕见的颅内肿瘤患者围术期突发恶性心律失常,其最终
诊断为TTS。
1.患者资料
患者,男,61岁,身高157 cm,体质量51kg,主因头晕头胀1月入院。既往体健,否认冠心病、心肌炎病史,ASA分级Ⅱ级。入院查体:肝肾功能、电解质、血常规未见异常;心电图示窦性心动过缓,45次/min;心脏超声未见异常,左心室射血分数(LVEF)67%。颅脑MRI示左侧后颅窝3.1 cm×2.6 cm×2.9 cm占位,符合脑膜瘤表现,内侧邻近小脑半球受压;脑内多发缺血梗死软化灶。患者无明显手术禁忌证,完善术前准备,择期行全麻下左侧乙状窦后入路小脑肿瘤切除术。
患者入室后开放外周静脉输注复方电解质,常规连接心电监护,心率(HR)45次/min,血压(BP)165/90mmHg,脉搏血氧饱和度(SpO2)95%,阿托品0.4mg静推,HR升至70次/min。给予盐酸戊乙奎醚0.6mg,咪达唑仑2mg,BP降至为130/70mmHg。全麻快速诱导方案为顺式阿曲库铵18mg,依托咪酯14mg,艾司洛尔10mg,舒芬太尼25μg,面罩加压通气3min后行气管内插管。诱导后行桡动脉穿刺置管连续测压,手术开始前追加舒芬太尼25μg,术中维持静脉泵入丙泊酚6~8mg/(kg·h),间断追加顺式阿曲库铵0.1mg/kg,需控制性降压时,间断吸入七氟醚。
术中维持动脉血压(ABP)120~100mmHg/60~70mmHg,HR60~70次/min,SpO2100%。手术进行约3h,肿瘤切除约1/2时,患者突发室上速,HR150~160次/min,ABP50~60mmHg/30~35mmHg,停止手术操作后恢复窦性心律。3min后再次发生室上速,并迅速转为室颤,遂马上终止手术,给予电除颤、心肺复苏术,间断静推肾上腺素4mg,胺碘酮0.15g静推后泵注,吗啡10mg静推。抢救过程中维持ABP110/60mmHg左右,HR100次/min左右,患者SpO2 80%以上。
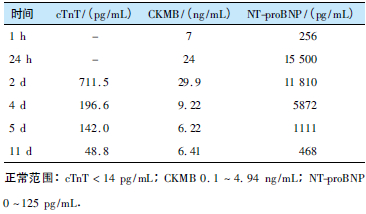
抢救30min后,患者心律转为窦性。气管导管内吸引可见粉红色泡沫样痰,考虑肺水肿给予呋塞米。肾上腺素、去甲肾上腺素持续静脉泵入维持ABP90~110mmHg/50~70mmHg,HR90~110次/min。转入重症医学科继续治疗。心电图示:V3-V6、Ⅰ、Ⅱ、aVF导联T波倒置,急查心肌酶示:肌酸激酶同工酶(CKMB)7ng/mL、N端脑钠肽前体(NT-proBNP)256pg/mL、肌红蛋白(Myo)900ng/mL。
床旁心脏超声示:左室心尖部心肌动度几乎消失,基底部、中部心肌运动良好,LVEF28%,每搏输出量(SV)30mL。患者
诊断首先考虑急性
心肌梗死,给予阿司匹林、硝酸甘油、曲美他嗪、呋塞米等药物治疗,维持多巴胺静脉泵入升压。患者病情逐渐好转,每日复查心电图显示T波倒置逐渐减轻。3d后停用多巴胺,自身血压恢复至正常范围。心肌酶学存在动态改变(表1)。
表1 心肌酶演变
患者自主呼吸改善,拔出气管导管。5d后复查心脏超声示:左室各段心肌未见变薄区,室壁运动未见明显异常,LVEF53%,SV65mL。冠状动脉CT
血管造影(冠脉CTA)示:右冠、左冠前降支狭窄70%,左回旋支狭窄50%,余未见狭窄病变。患者病情逐渐好转,距发病第14天出院。2月后患者因“左侧额颞顶部慢性硬膜外血肿”入院,复查心电图无ST-T改变,心脏超声无异常,心功能恢复良好,因患者拒绝再次手术治疗,遂出院继续药物保守治疗。
2.讨论
TTS是一种急性心力衰竭综合征,通常由躯体或心理等应激因素所诱发,好发于绝经后女性,
临床表现类似于急性冠脉综合征,包括胸痛、呼吸困难,少数患者也可能出现肺水肿,但严重室性心律失常、心源性休克、心搏骤停罕见,心电图及心肌酶亦呈动态变化,但冠脉造影多无明显狭窄,左室造影呈一过性心尖球形改变。
本病最典型的特征是发病初期左心室收缩功能严重障碍,但在数周至数月后心功能可完全恢复正常。TTS发病机制目前尚不明确,但应激诱发的交感神经兴奋和儿茶酚胺过量释放可能是该病的主要机制。
对于本例患者围术期病情变化,我们分析原因为以下方面:(1)患者入室后情绪紧张,血压偏高,可能存在心理应激因素,而这是诱发TTS的最主要原因之一。(2)术中经乙状窦后入路行小脑肿瘤探查切除术期间突发室颤,我们认为外科操作可能导致交感神经异常兴奋、儿茶酚胺释放增加,过量儿茶酚胺可直接损害心肌细胞或由于微
血管功能障碍间接导致短暂缺血性损伤,最终发生心功能障碍;此外手术创伤本身作为躯体应激因素,可激活垂体-肾上腺髓质释放儿茶酚胺可诱发TTS发生。(3)患者进一步冠脉检查未见严重器质性狭窄、斑块破裂及
血栓形成,随后心脏超声检查示心脏各室壁运动无异常,无心肌变薄现象,排除
心肌梗死可能性。但并不能除外以上应激因素诱发冠脉痉挛导致心尖部出现心肌顿抑。
冠脉痉挛是TTS的发病机制之一,曾报道冠脉痉挛会诱发TTS。本例患者既往无明确基础
心血管疾病病史,入院心电图和心脏超声无明显异常,于围术期突发室上速、室颤,血压骤降。心电图示广泛T波倒置,心肌酶轻度升高,符合TTS心电图及心肌酶谱动态变化特点,而心脏超声提示左室心尖部发生短暂性可逆性运动功能障碍,5d后患者心功能恢复,2月后复查患者心电图及心脏超声无异常,预后良好。结合患者发病原因、围术期病情变化、辅助检查及预后结果,最终
临床诊断为TTS,导致术中恶性心律失常和心力衰竭。
由于对TTS缺乏足够的认识,因此,本例患者的诊断和治疗依然存在不足之处。一方面,该患者为中年男性,术前否认
心血管基础疾病,因此,未能行冠脉造影检查,排除冠脉综合征可能性。虽然心脏CTA、MRI都有助于诊断TTS,但“黄金标准”依然是冠脉造影排除冠脉阻塞性疾病。另一方面,依据患者术中心电图变化,诊断首先考虑急性
心肌梗死,因此,给予了吗啡、呋塞米、阿司匹林、硝酸甘油、曲美他嗪等药物治疗。
由于未及时确诊为TTS,抢救时使用了肾上腺素、多巴胺等药物,虽然维持了血流动力学稳定,但是可能会导致体内儿茶酚胺水平进一步增高而加重病情进展。围术期和重症患者TTS表现往往缺乏特异性,更多的情况下会出现突发心脏衰竭、心律失常或心搏骤停。许多研究者就
预防围手术期TTS首次发作或复发提出了相关建议。大多强调围术期应避免心理应激,通过心理疏导或药物缓解患者术前焦虑情绪。
术中维持足够的麻醉深度,密切监测心电图变化,可选择经食道心脏超声(TEE)对左心室功能进行连续监测和评估,若患者出现急性左
心衰竭、肺水肿表现时,可根据循环监测给予血管活性药物维持血流动力学稳定。术后充分镇痛和镇静,
预防性应用β肾上腺素能阻断剂等。在全身麻醉苏醒和拔管阶段应尽量保持血流动力学的稳定,避免交感神经过度兴奋。如果患者处于TTS恢复期,则建议延迟择期手术,直至心肌运动功能恢复正常,或者优先考虑区域麻醉。
随着对TTS认识的提高,国内外对该病的报道日趋增多,回顾性研究发现,中枢神经系统损伤时常合并心功能异常。中枢神经系统疾病引起的心理或躯体应激,通过交感神经过度兴奋导致儿茶酚胺短时间内大量释放,其心肌毒性作用可能会促进TTS的形成。Porto等研究发现,中枢神经系统疾病是TTS的常见诱因之一,最常见于蛛网膜下腔出血。此外,亦可见缺血性脑
卒中、
癫痫、创伤性脑损伤、颅内肿瘤等疾病诱发TTS的报道。Santoro等回顾性研究分析了神经系统疾病和TTS之间的潜在联系,结果表明,对于合并严重神经系统疾病的患者,TTS存在更高的风险性。
本病例描述了1例颅内肿瘤患者于围术期突发TTS,旨在通过对发病机制、诊断、治疗的进一步总结,提高对TTS的认识,减少误诊误治。临床工作中,对患有中枢神经系统疾病的患者需进行充分术前评估,完善术前准备,当围术期出现心电图及心功能异常时,我们应该考虑到TTS发生的可能性,应注意及时行心肌酶、心脏超声以及冠脉造影、左室造影检查以明确诊断。TTS大部分患者长期预后良好,96%的病例心脏功能多在1周或数周内逐渐恢复正常。
原始出处:
来源:麻醉安全与质控
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言