骨质疏松是最常见的骨代谢疾病,其特征在于骨组织内炎症环境的形成,导致的破骨能力异常上升以及成骨能力下降。遗憾的是,现有的骨质疏松治疗药物仍存在促成骨能力有限,抗炎作用不理想和副作用显著等缺点。黑磷(BP)纳米片因其独特的综合物化性能(如高比表面积及良好的生物相容性等),在生物医学领域受到广泛关注。2020年,王小磊教授领衔的光健康团队发现BP可以负载足量药物靶向病变组织,并最后降解为磷酸根离子(PO43-)。PO43-是一种重要的成骨原料。然而,单纯将BP递送至骨组织内很难产生预想中的促成骨效果。主要原因在于,体内环境中缺乏促进BP分解的光照与氧气,BP在体内环境中往往需要近红外光照或搭载药物来增强体系的局部治疗效果。而骨质疏松作为一种全身骨骼系统的疾病,局部治疗效果的增强难以获得理想的结果。过氧化铜(CP)纳米粒子是一类具有增强芬顿酶催化活性的金属过氧化物,其可在酸性环境下分解并释放出铜离子(Cu2+)与H2O2。Cu2+在酸性条件下又会发生类芬顿反应催化H2O2生成羟基自由基(·OH,一种ROS)。有研究表明,Cu2+在骨矿化和骨再生中表现出显著的促进作用。而分解产生的副产物·OH具有高氧化性,因此CP常常被应用于抗肿瘤、抗菌以及污水处理领域。然而,将CP应用于组织再生的报道还较为罕见。理论上,·OH可以加速BP的分解,促进磷酸盐的产生,与BP发挥“负负得正”的促成骨作用。

图1 负载CP的BP纳米粒子(CuBA)用于骨质疏松治疗
受这种类芬顿反应启发(图1),王小磊教授团队与南昌大学第二附属医院程细高教授团队将CP与BP结合(BP/CP, CuB),形成了一个以·OH为中心的“催化体系”。该项工作以题为“Fenton-like Reaction Inspired “·OH Catalyzed” Osteogenic Process for the Treatment of Osteoporosis”的论文发表在医用材料类TOP期刊Advanced Healthcare Materials上。这种通过材料副作用相互抵消的方法集抗炎、促成骨和药物靶向于一体,为骨质疏松的治疗提供了一种新思路。
CuBA的合成和表征
本研究根据文献报道的方法制备出CP纳米粒子与BP纳米片,之后通过室温搅拌方法制备出负载CP的BP纳米粒子(CuB)。最后,通过表面富集氨基基团的聚多巴胺(PDA)包覆CuB,再将被羧基基团修饰的聚丙烯酸-阿仑膦酸钠(PAA-ALE)通过酰胺化反应锚定在PDA表面,获得具备骨靶向能力的自矿化BP/CP@ALE(CuBA)纳米粒子(图2)。在骨质疏松的炎症与微酸环境中,CP产生的Cu2+可对成骨细胞产生一定程度的促成骨作用,而·OH可以加速BP在体内无光环境下的降解;BP不仅可以作为成骨原料,还可以作为一种ROS清除剂,减轻骨质疏松的骨组织内的炎症水平,同时抵消CP潜在的ROS毒性,其产生的副产物也是磷酸根,可以进一步发挥“负负得正”的促成骨作用(图3-5)。

图2 CuBA的合成与表征
CuBA的抗炎性能研究
骨组织内的炎症水平升高是骨质疏松的病因之一,而ROS是造成炎症的主要原因,清除ROS的能力也代表了材料的抗炎能力。为了探究CuBA纳米粒子是否具有清除ROS的能力,本研究在体外进行了ABTS自由基清除实验与·OH清除实验,并在细胞内通过2,7-二氯荧光素二乙酸酯(DCFH-DA)荧光探针评估了CuBA清除细胞内ROS的能力。结果证实了材料中的BP具有很强的ROS清除能力,也就是抗炎能力,而CuBA中的BP不仅能清除CP产生的ROS,也有能力清除细胞在LPS刺激下产生的ROS(图3)。

图3 CuBA抗炎性能研究
CuBA的巨噬细胞调控作用
作为炎症过程中不可或缺的一环,巨噬细胞在维持体内炎症水平、抵抗异物入侵和组织修复中不可或缺。巨噬细胞作为一种具有可塑性和多能性的细胞群体,在微环境的影响或刺激下表现出明显的功能差异。根据激活状态和功能的不同,可分为以促炎细胞因子分泌为主的M1型和以抗炎细胞因子分泌为主的M2型。而巨噬细胞分泌的促炎和抗炎细胞因子在骨质疏松的发生和发展中起着关键作用。本研究选择了RAW 264.7细胞来评估CuBA纳米粒子对巨噬细胞的调节作用。结果显示(图4),当实验组加入含BP的材料后,M1表型标记(CD86)的表达显著降低,M2表型标记(CD206)的表达相比于对照组有一定的提高。
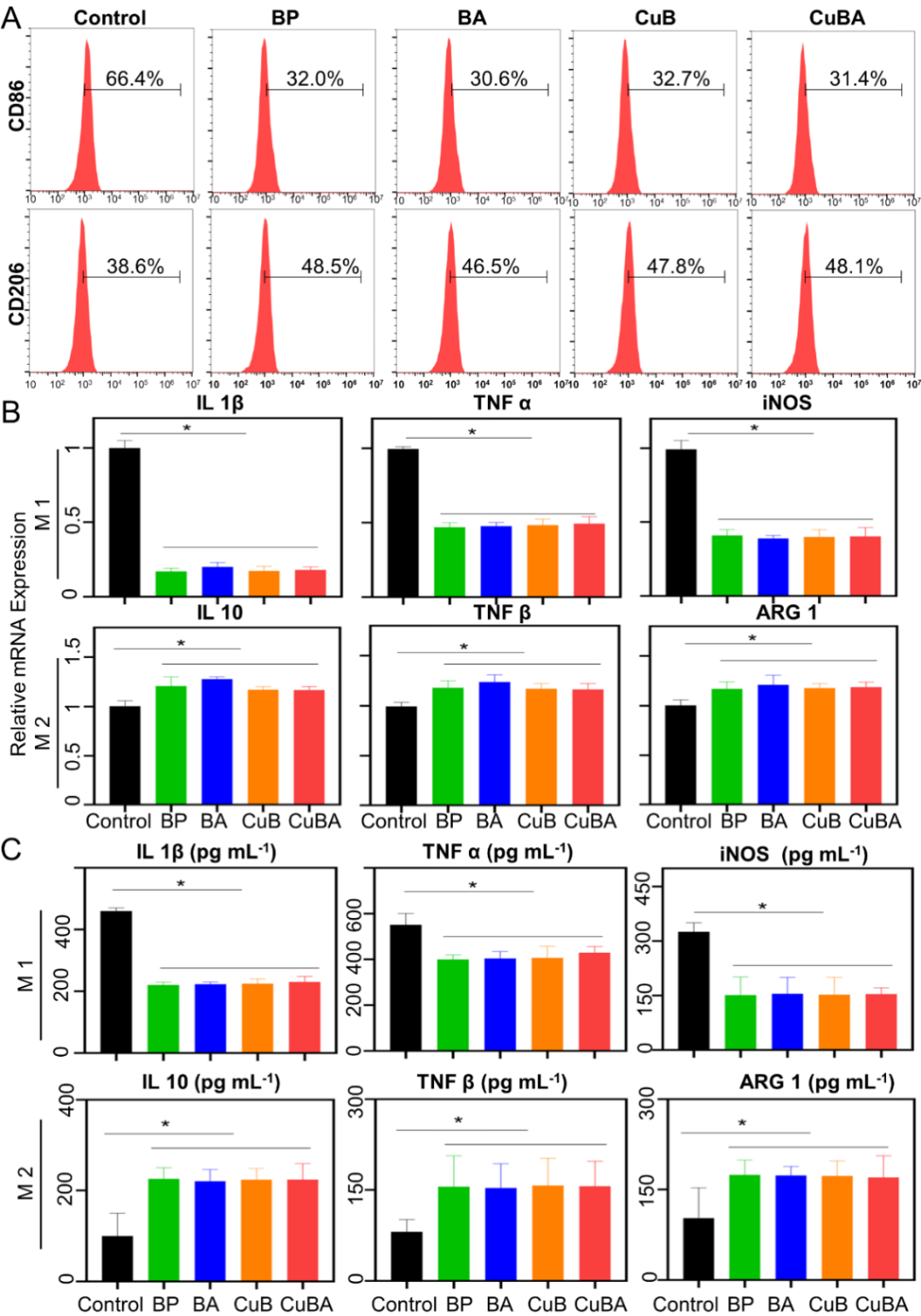
图4 CuBA调控巨噬细胞M1/M2表型
CuBA的促成骨性能评估
除了抗炎作用外,骨质疏松的治疗还与后续成骨能力的增强有关。于是本研究使用MC3T3细胞在体外评估了CuBA纳米粒子的促成骨能力本研究首先使用含促炎因子的培养基与成骨诱导培养基配成了含促炎因子的成骨诱导培养基,并用该培养基进行后续实验。本研究将MC3T3细胞与不同材料共同孵育7天后, qRT-PCR结果显示使用单纯培养基孵育的对照组中成骨相关基因(RUNX2,ALP,OPN,OCN)的表达相比与实验组显著降低,但实验组中BP组与BA组的升高水平相似,而CuB组与CuBA组表现出更高的、几乎相同的表达水平。本研究认为这是因为体外培养时细胞周围难以避免存在氧气与一定的光照,促进了BP的分解。而CuB组与CuBA组中出去氧气与光照的影响外,CP的存在依然加速了BP的分解,并释放出Cu2+进一步增强了材料的促成骨作用WB实验结果、ALP染色结果与茜素红染色结果也表现出相同的趋势。上述结果表明(图5),相较于单纯BP,CuBA纳米粒子在体外对MC3T3细胞的成骨能力有显著的促进作用。
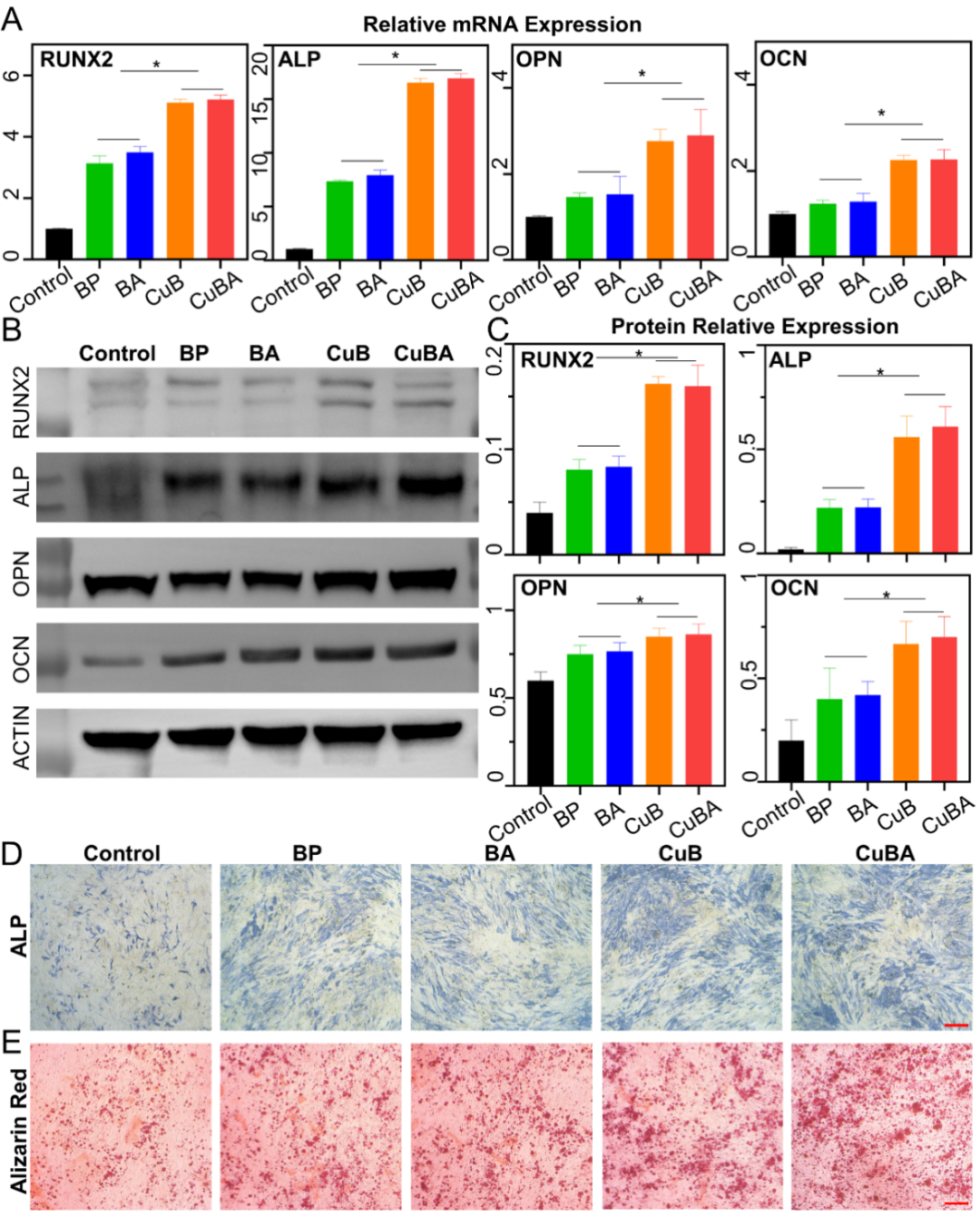
图5 CuBA的促成骨性能评估
CuBA对OVX小鼠模型的疗效评估
为了验证合成的材料在体内治疗骨质疏松的能力,本研究使用文献中报道的小鼠骨质疏松造模方法(OVX)。并在连续干预4周后取出小鼠的第三腰椎(L3)与左侧股骨通过micro-CT与组织学检测进行治疗效果的评估(图6)。结果表明,与Sham组相比,OVX组,BP组,BA组与CuB组的小鼠骨量显著下降,证明骨质疏松造模成功。而CuBA组的骨显著高于其他组(除Sham组),证实了本研究合成的CuBA纳米粒子对于骨质疏松具有显著的疗效。
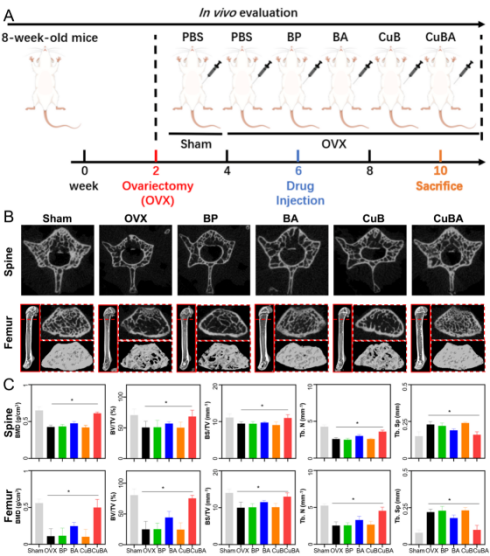
图6 CuBA对OVX小鼠的疗效评估
【小结】
本研究受CP与BP在酸性环境下的类芬顿反应启发,设计了一种以·OH为中心的“负负得正”抗炎促成骨系统,并通过将BP和CP包覆在有ALE修饰的PDA中,制备了一种新型CuBA纳米粒子用于治疗骨质疏松。该体系通过将PAA-ALE与粒子表面的PDA包膜进行酰胺化连接,使CuBA纳米粒子具备了骨靶向能力,从而在体内获得了更好的治疗效果。到达骨质疏松的骨组织后,既解决了BP在体内促成骨作用不足的缺点,又解决了CP潜在的ROS毒性。CP分解出的Cu2+促进了成骨,而副产物·OH被用于催化BP的分解产生大量的成骨原料,进一步促进了成骨。剩余的BP能够清除骨质疏松骨组织内的ROS从而发挥抗炎作用,并通过调节巨噬细胞极化来进一步增强成骨作用。这种抗炎促骨策略为纳米材料的设计和开发提供了见解,还可用于治疗骨科疾病以及其他疾病,如类风湿疾病和牙周炎。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202304091