Guidance-01研究结果
弥漫大B细胞淋巴瘤(DLBCL)患者在R-CHOP方案治疗下显著改善了预后,但仅有约60%的中高危(IPI≥2)患者可获得完全缓解(CR)。随着新型靶向药物的发展,越来越多的临床研究聚焦于在亚组患者中给予R-CHOP联合其他药物(R-CHOP-X)。例如PHOENIX研究发现,R-CHOP联合伊布替尼在年龄小于60岁、IPI 2–5的non-GCB淋巴瘤患者中具有生存获益,ROBUST研究发现R-CHOP联合来那度胺可改善IPI 3-5的ABC淋巴瘤预后,ECOG-ACRIN E1412研究发现可降低DLBCL进展或死亡风险(不考虑GCB或non-GCB亚型),POLARIX研究证实维泊妥珠单抗联合R-CHP可改善IPI 2–5患者生存。这些结果表明,新型靶向药物联合免疫化疗是 DLBCL 有前景的治疗方法。
分子异质性可能影响 DLBCL 的临床结局。两项全外显子测序 (WES) 研究提出了具有相当遗传特征的基因亚型,包括 MCD/C5 cluster、BN2/C1cluster和 EZB/C3 cluster,而N1、TP53相关/C2 cluster和 SGK1 相关/C4 cluster等亚型略有不同。最近的研究也证明了用特点基因的靶向测序进行简化基因亚型分型的可行性。除肿瘤细胞的基因改变外,肿瘤微环境在 DLBCL 进展中也起着必不可少的作用,目前已经定义了四种主要淋巴瘤微环境 (LME) 类别,包括生发中心样 (GC)。然而,根据多种基因亚型选择不同靶向药物的治疗策略尚未研究。
至于选择靶向药物的原理,发生 MCD 相关突变的 DLBCL 通常对BTK抑制剂伊布替尼敏感,BN2 亚型也显著富集 BCR-NF-kB 畸变;EZB 亚型中富集的组蛋白乙酰转移酶 CREBBP/EP300 突变可被组蛋白去乙酰化酶 (HDAC) 抑制剂靶向;去甲基化药物地西他滨对急性髓系白血病 (AML)、骨髓增生异常综合征 (MDS) 和伴有 TP53 突变的 DLBCL 患者有效。对于 N1 和无法分类亚型,应用来那度胺在 GCB和 ABC-DLBCL 中具有临床疗效。
上海交通大学医学院附属瑞金医院赵维莅教授牵头的Guidance-01研究是一项随机、2期研究,旨在探索分子分型指导的靶向药物联合R-CHOP(R-CHOP-X),在新诊断的中危或高危 DLBCL 患者中的疗效和安全性,以及探索可能从 R-CHOP-X 治疗中获益的分子和LME亚型。近日《Cancer Cell》发表了Guidance-01研究结果,第一作者为上海交通大学医学院附属瑞金医院张慕晨教授、田爽教授和付迪教授,通讯作者为赵维莅教授和许彭鹏教授。
本文亮点
1、基于分子分型的靶向药物可改善R-CHOP治疗DLBCL的疗效。
2、炎症和免疫耗竭的肿瘤对治疗的敏感性更高。
3、分子分型引导的免疫化疗是DLBCL有前景的一线治疗。
研究方法
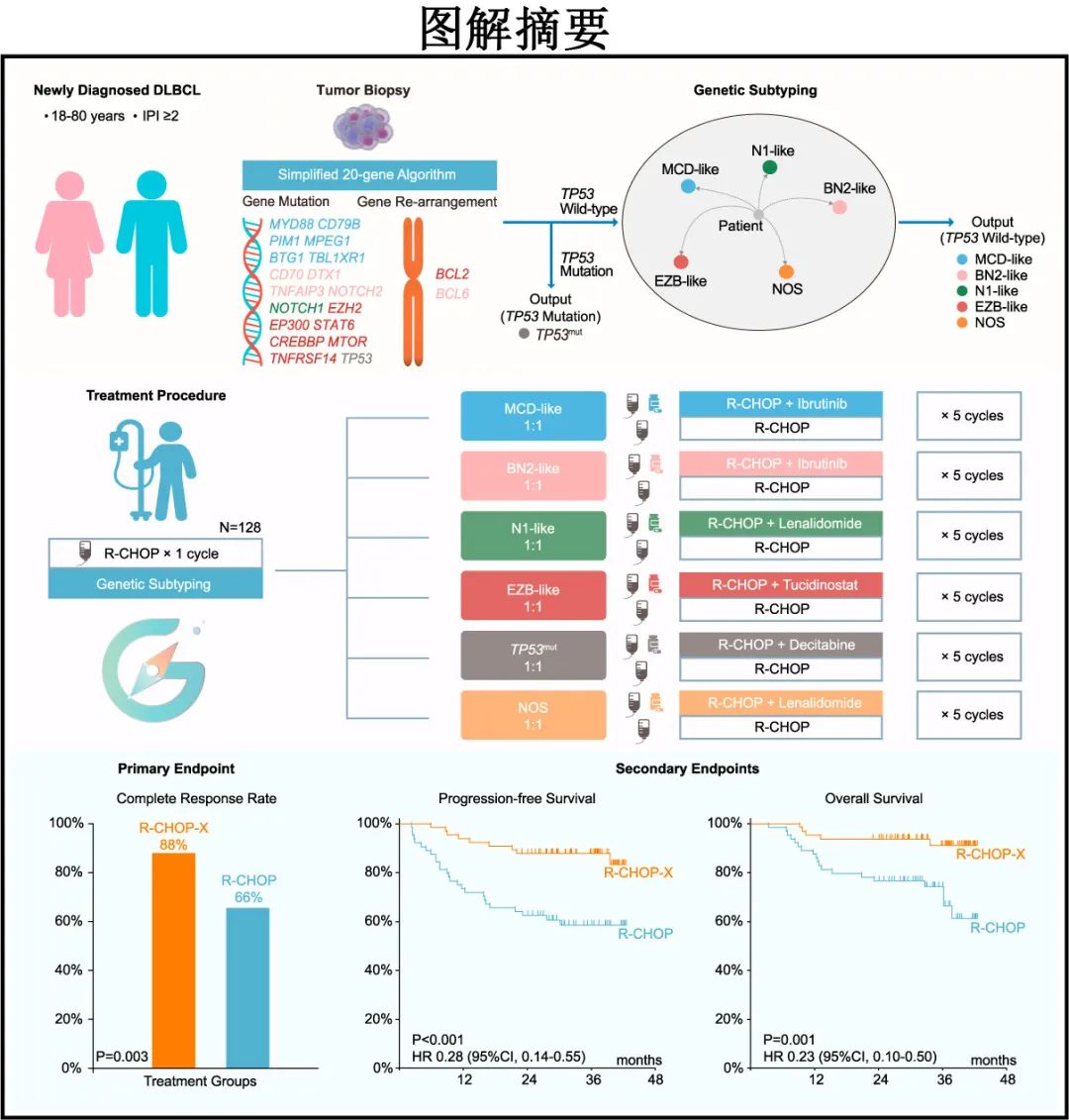
Guidance-01研究是一项开放标签、单中心、随机、II期研究,纳入年龄为18-80岁、新诊断、经组织学证实的 CD20 阳性DLBCL、ECOG体能状态0-2、IPI风险为中危或高危 (IPI ≥2)、器官功能充分的患者。
福尔马林固定石蜡包埋(FFPE)的肿瘤活检样本进行DNA测序,涵盖简化20基因算法的18个基因的CDS区域(BTG1、CD70、CD79B、CREBBP、DTX1、EP300、EZH2、MPEG1、MTOR、MYD88、NOTCH1、NOTCH2、PIM1、STAT6、TBL1XR1、TNFAIP3、TNFRSF14和TP53),新鲜冷冻样本进行RNA测序。
简化20基因算法采用PAM clustering策略将 DLBCL样本分配到预定义的基因亚型之一:TP53mut、MCD样、BN2样、N1样和EZB样,该分类是基于18个基因的突变数据和使用 FISH分析评估的2个基因(即 BCL2和BCL6)的重排数据。
所有患者均接受1个周期的标准R-CHOP治疗,根据基因亚型分层,其余5个周期按1:1随机分配至 R-CHOP-X 或 R-CHOP 组。根据分子亚组调节加入的药物(即X):MCD样和 BN2样加入伊布替尼、TP53突变加入去甲基化药物地西他滨、EZB样加入tucidinostat(组蛋白去乙酰化酶抑制剂)、N1样和非特指型(NOS)加入来那度胺。
研究结果
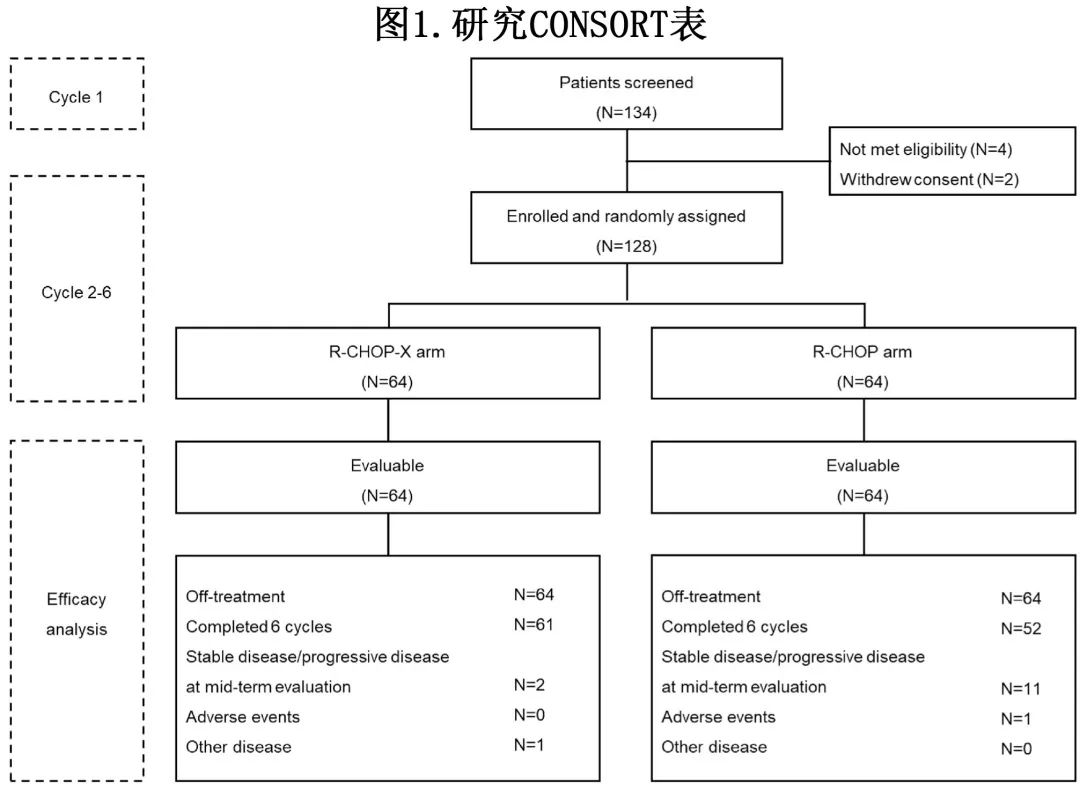
该研究纳入128例患者患者并按1:1随机接受标准 R-CHOP(n=64)或R-CHOP-X(n=64)治疗(图1)。
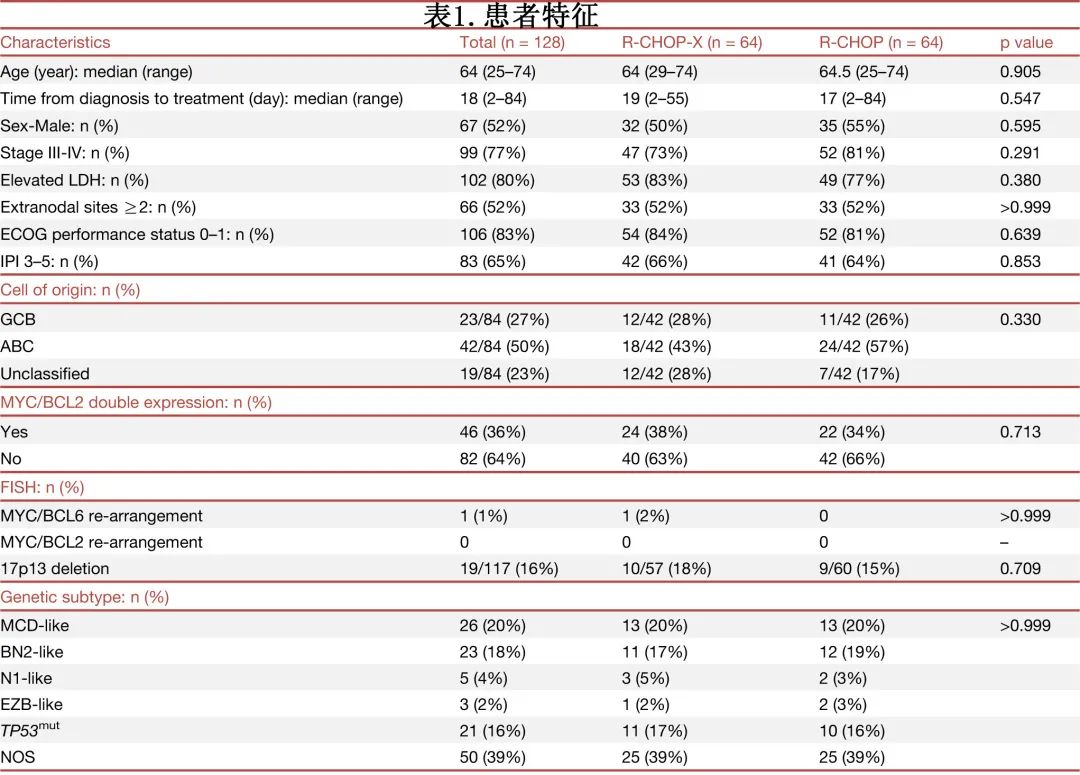
患者特征总结见表1,两组之间的基线临床和病理学特征相当,中位年龄为64岁。大多数患者呈现相对高危的疾病:77%为 Ann Arbor III 期或 IV 期,80%为血清 LDH 水平升高,52%为≥2个结外受累部位,65%为IPI 3-5。29例Ann ArborⅡ期患者中27例血清 LDH 水平升高,5例有2个结外部位。在84例可获得 RNA 测序 (RNA-seq) 数据的患者中,71%的患者表现为non-GCB 表型(ABC和无法分类)。通过免疫组织化学评估,36%的患者为 MYC/BCL2 双表达;1例患者为 MYC/BCL6 重排淋巴瘤,无患者出现 MYC/BCL2 重排。作者建立了简化20基因算法(STAR法),将患者分类为 MCD 样 (26/128,20%)、BN2样 (23/128,18%)、N1样 (5/128,4%)、EZB样 (3/128,2%)、TP53突变 (TP53mut)(21/128,16%) 和非特指型(NOS)(50/128,39%)。
临床疗效
主要终点
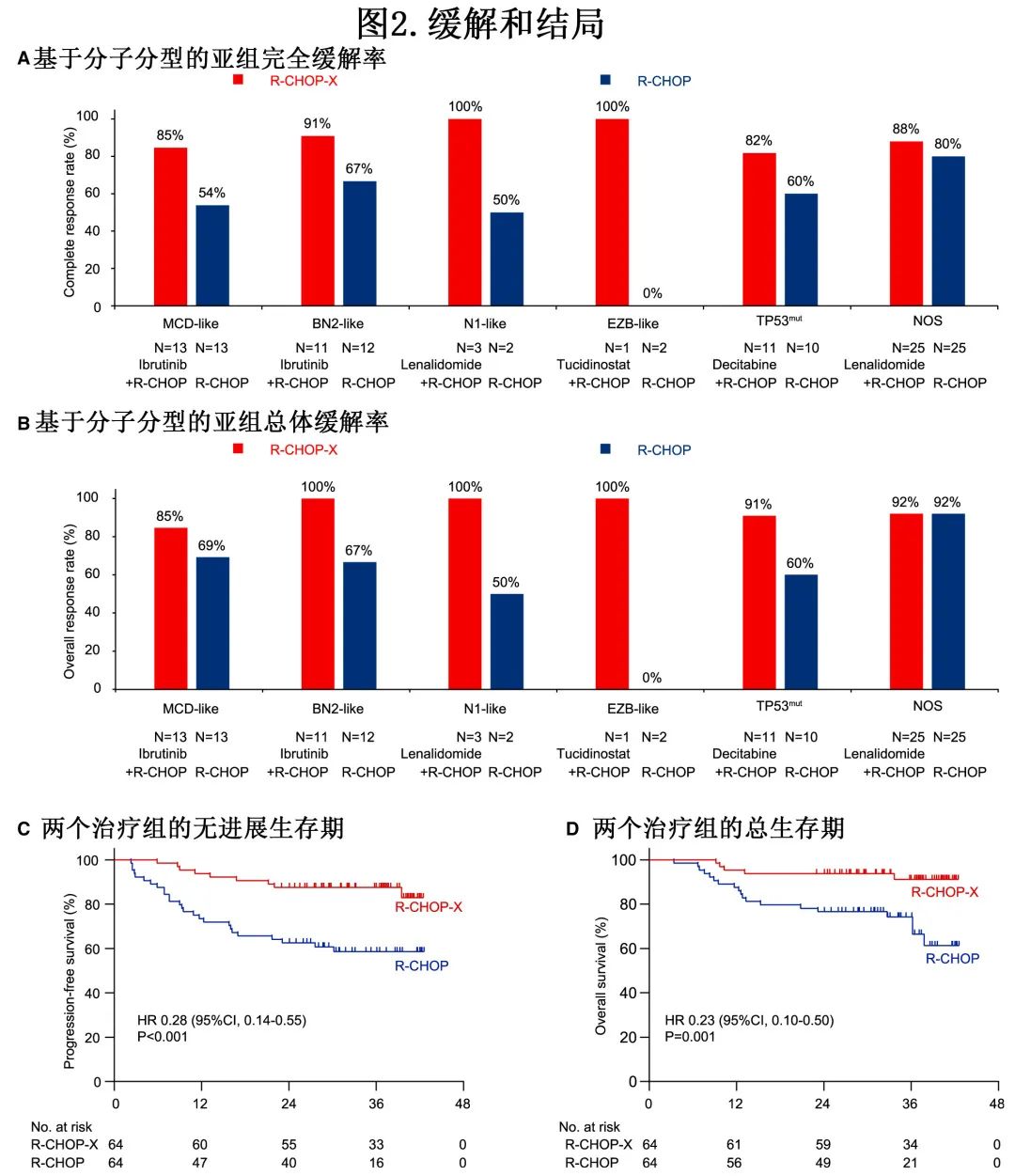
治疗结束时 R-CHOP-X 组和 R-CHOP 组的 CR 率 (CRR) 分别为88%(56/64) 和66%(42/64)(p=0.003),达到预先规定的主要终点。分子分型方面,R-CHOP-X组的 MCD 样、BN2样、N1样、EZB样、TP53mut和 NOS 的 CRR 分别为85%、91%、100%、82%和88%,而R-CHOP组分别为54%、67%、50%、0、60%和80%(图2A)。注:各分子分型内观察到的差异为探索性。
次要终点
治疗结束时 R-CHOP-X 组和 R-CHOP 组的客观缓解率(ORR)分别为92%和73%;p=0.005),且大多数分子分型的 ORR 显示改善(图2B)。中位随访36个月,未达到中位无进展生存期 (PFS) 和总生存期 (OS);R-CHOP-X 组和 R-CHOP 组的2年 PFS 率分别为88%和63% (HR=0.28,p<0.001)(图2C),且R-CHOP-X组的2年 OS 率也优于 R-CHOP 组(94% vs. 77%;HR=0.23,p=0.001)(图2D)。PFS 和 OS 的探索性亚组分析中,未显示 R-CHOP-X 明显获益的显著亚组包括≤60岁患者、IPI中低危患者、GCB亚型患者和 NOS 分子亚型患者。死亡的17例患者中16例死亡是由于疾病进展,另外1例在治疗后3个月死于心力衰竭和重度肺部感染。
淋巴瘤的后续治疗
在 R-CHOP-X 组3例部分缓解 (PR) 患者中,2例最终正电子发射断层扫描-计算机断层扫描显示残留病灶的患者接受了放疗,1例接受了脾切除术,并经病理学证实为DLBCL;3例疾病稳定 (SD) 患者中2例接受嵌合抗原受体 T 细胞 (CAR T) 治疗并获得CR,1例死于疾病进展;2例疾病进展 (PD) 患者接受二线化疗挽救治疗,死于疾病进展。R-CHOP 组5例 PR 患者中,3例接受放疗,2例接受二线治疗;7例 SD 患者中4例接受二线治疗后行自体造血干细胞移植,获得CR,3例死于疾病进展(其中1例接受 CAR T 治疗);10例 PD 患者中3例接受 CAR-T 治疗后死于疾病进展,7例接受二线治疗后6例死于疾病进展。
安全性和剂量强度
常见血液学和非血液学不良事件 (AE) 总结见表2。血液学毒性方面,3-4级中性粒细胞减少症是两组中最常见的AE(R-CHOP-X组81% [52/64],R-CHOP组75% [48/64]),此外3-4级血小板减少症分别有31%(20/64)和11%(7/64),3级贫血发生率分别为25%(16/64)和20%(13/64),未报告4级贫血;发热性中性粒细胞减少症发生率分别为20%(13/64)和11%(7/64),最高为3级。尽管血细胞减少症和血小板减少症的发生率增加,但与 R-CHOP 相比,R-CHOP-X未导致3级肺部感染(6%[4/64] 和5%[3/64])或胃肠道出血并发症(2%[1/64] 和3%[2/64])增加。R-CHOP-X 组和 R-CHOP 组所有级别总感染率分别为22%(14/64) 和20%(13/64)。未观察到给药相关死亡。
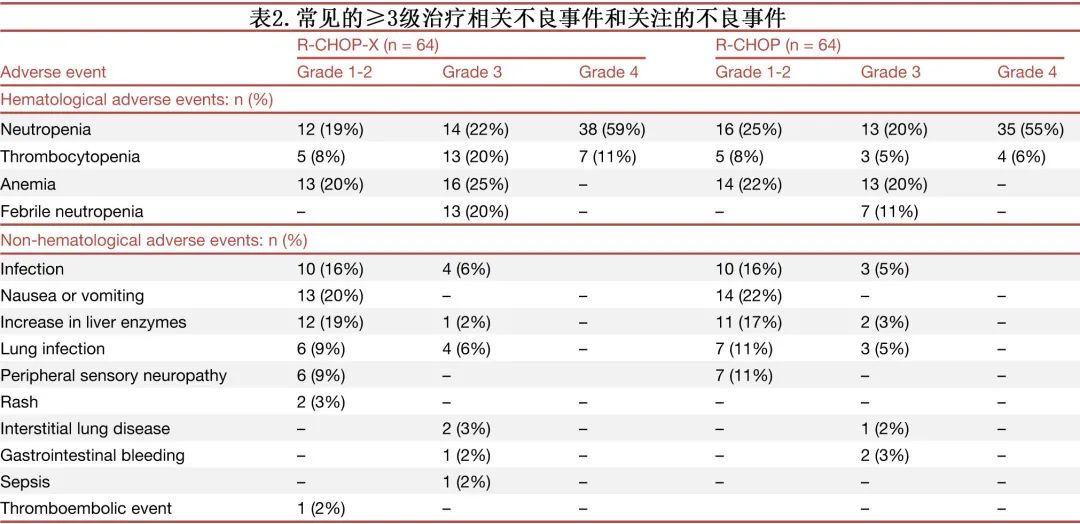
尽管 AE 发生率升高,但 R-CHOP-X 组与 R-CHOP 组间的化疗剂量强度相似。
标志物分析
简化20基因分型算法
为验证简化20基因算法,作者分析了 BC 癌症 (BCC)、血液恶性肿瘤研究网络 (HMRN) 和国家癌症研究所 (NCI) 队列的遗传特征。从简化20基因算法中排除 TP53mut 病例,从 LymphGen 算法中排除 A53 病例和 ST2 病例,所有4种亚型(简化20基因算法中的 MCD 样、BN2样、N1样和 EZB 样亚型;以及MCD、BN2、N1、和 LymphGen 算法中的 EZB 亚型)在 BCC 队列94%的患者、HMRN队列93%的患者和 NCI 队列90%的患者中匹配。通过简化20基因算法,将通过 LymphGen 分配至 BN2 亚型的患者分配至 MCD 样亚型时,发生主要不一致(BCC队列5例患者,HMRN队列11例患者,NCI队列6例患者)。
为进一步证实在每种亚型中选择靶向药物的原理,作者分析了先前报道的新诊断 DLBCL 患者肿瘤样本的基因组和转录组学数据,包括325例患者的 WES 和全基因组测序 (WGS) 以及325例患者中184例的 RNAseq 数据。根据简化20中基因算法,184例同时具有 WES/WGS 和 RNA-seq 数据的患者被分为MCD样(n=29)、BN2样 (n=24)、N1样 (n=9)、EZB样 (n=15) 和 TP53mut 亚型 (n=23)。基因表达数据显示,在 MCD 样 (p=0.006) 和 BN2 样亚型 (p=0.012) 中观察到 NF-kB 活化 (NFkB-11),表明对 BTK 抑制剂伊布替尼具有潜在反应。基因集富集分析显示,EZB样亚型中组蛋白去乙酰化信号通路显著上调(p=0.006),表明对 HDAC 抑制剂tucidinostat的潜在反应。组蛋白 H3 在赖氨酸 9(H3K9me3) 上的组蛋白甲基转移酶活性,通过调节内源性逆转录病毒 (ERV) 表达、γ-干扰素 (IFN-g) 产生和 T 细胞活化,在 DLBCL 进展中发挥重要的表观遗传学作用,在 TP53mut 亚型中显著上调 (p=0.015),并与下调的 IFN-g 产生 (p = 0.002)、I型 IFN 产生 (p = 0.002) 和 T 细胞活化 (p = 0.002) 通路有关。通过实时定量 PCR 进一步检测,与野生型 TP53 相比,TP53mut亚型的 ERV 水平显著降低(ERVL-E p<0.001,MER21C p<0.001,HERVK11 p=0.002,HERV16 p=0.018),表明对去甲基化药物地西他滨的潜在反应。由于在 N1 样或 NOS 亚型中未富集显著的致癌信号特征,因此应用了具有广泛抗淋巴瘤活性的来那度胺。
根据 GUIDANCE-01 队列中患者的基因亚型,基因组签名(genomic signatures)概述见图 3A。21例为TP53mut,称为 TP53 mut亚型。在野生型 TP53 患者中,MYD88、CD79B、PIM1、MPEG1、BTG1和 TBL1XR1 的突变在 MD 样亚型患者中富集。CD70、DTX1、TNFAIP3和 NOTCH2 的突变在 BN2 样亚型患者中富集。N1 样亚型患者具有典型的 NOTCH1 突变,EZB样亚型患者检测到EZH2、EP300、STAT6、CREBBP、MTOR和 TNFRSF14 的突变。荧光原位杂交 (FISH) 分析检测,87%(20/23) 的 BN2 样患者表现为 BCL6 重排。所有3例 EZB 样患者均表现为 BCL2 重排,但无 MYC 重排。本研究中用于遗传亚型分型的简化20基因算法示意图如图 3B 所示。
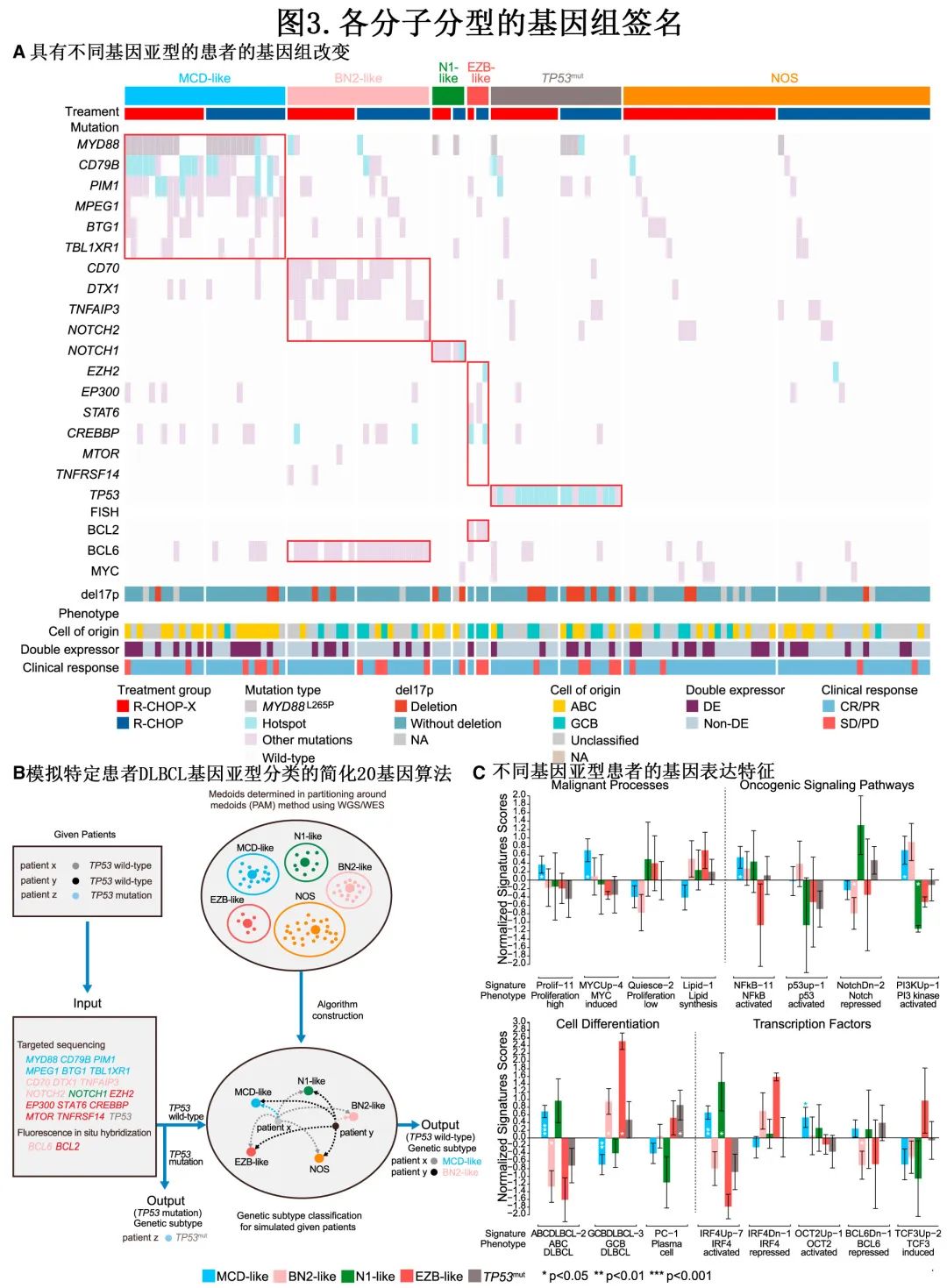
作者使用本研究中84例患者的 RNAseq 数据分析了基因表达谱(图 3C)。在184例用于建立简化20基因算法的患者中观察到相似的表达模式,但亚型间在恶性过程、B细胞分化和转录因子方面表现出不同的特征。简言之,MCD样亚型表达高水平的细胞增殖 (Prolif-11,p=0.028)、MYC癌蛋白 (MYCUp-4,p=0.010)、ABC-DLBCL标记 (ABCDLBCL-2,p<0.001) 和 IRF4 诱导的基因 (IRF4Up-7,p=0.002),但缺乏 GCB-DLBCL 标记 (GCBDLBCL-3,p=0.004)。EZB 样亚型表达 GCBDLBCL 标记 (GCBDLBCL-3,p=0.018) 和 TCF3 诱导的基因 (TCF3Up-2)。
各亚型的致癌信号通路也不同。NF-kB 激活 (NFkB-11) 在 MCD-like 中最高 (p=0.042),NOTCH抑制 (NotchDn-2) 在 BN2 样亚型中最低 (p=0.045),而 P53 靶向基因 (p53up-1) 在 TP53mut 亚型中被抑制。
通过 FISH 分析检测,128例患者中有117例可获得 17p13(del17p) 的缺失。这117例患者中,19例携带del17p,包括8例 TP53mut 患者(3例随机分配至地西他滨+ R-CHOP组、5例随机分配至 R-CHOP 组)、3例 MCD 样患者(1例随机分配至伊布替尼+R-CHOP组、2例随机分配至 R-CHOP 组)、2例 BN2 样患者(均随机分配至伊布替尼+R-CHOP组)。2例 N1 样(1例随机分配至来那度胺+R-CHOP组、1例随机分配至 R-CHOP 组)和4例 NOS 亚型(3例随机分配至来那度胺+R-CHOP组、1例随机分配至 R-CHOP 组)。在这些 del17p 患者中,R-CHOP-X组和 R-CHOP 组之间未观察到 PFS 和 OS 的显著差异。
淋巴瘤微环境亚型
LME 类别应用于84例有 RNA-seq 数据的患者。其中,分别有9例 (11%)、27例 (32%)、23例 (27%) 和25例 (30%) 患者归类为GC-、MS-、IN-和DP-LME(图4A)。在特定的 LME 类别中没有显著富集的基因亚型(图4B)。R-CHOP-X 组 DP-LME 患者的 ORR 显著高于 R-CHOP 组(100% vs.54%,p = 0.015)(图4B)。R-CHOP-X 组 IN-和 DP-LME 患者的 PFS 和 OS 显著优于 R-CHOP 组(图4C)。
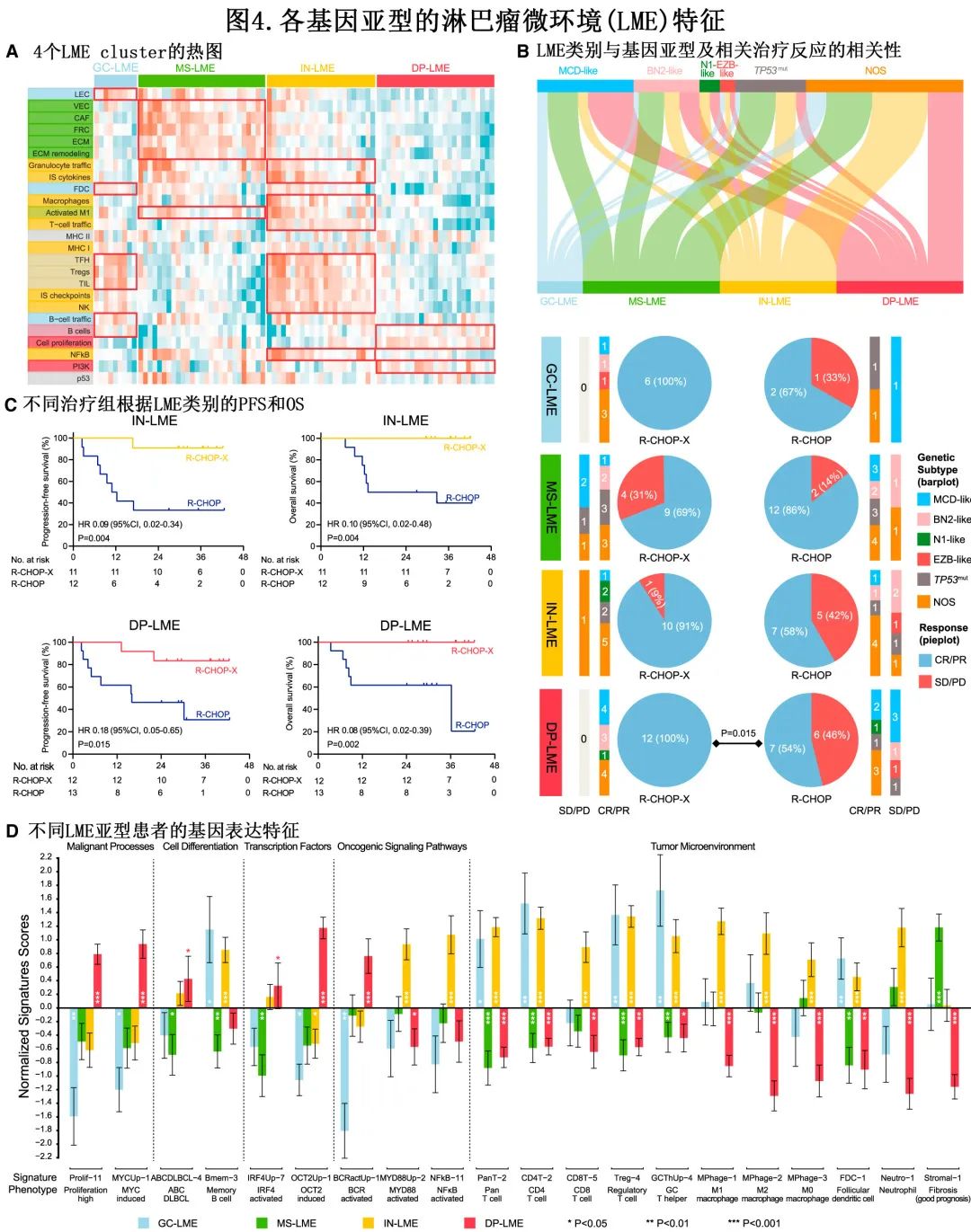
作者还确定了与 LME 亚型相关的特征(图 4D)。DP-LME 中增殖特征 (Prolif-11) 和 MYC 活性 (MYCUp-1) 增加(分别为p<0.001和p<0.001),GC-LME中增殖特征 (Prolif-11) 和 MYC 活性 (MYCUp-1) 降低(分别为p=0.004和0.013)。同时,LME亚型在细胞分化上存在差异,DP-LME高表达活化 B 细胞 (ABCDLBCL-4,p=0.020),in-LME表达记忆 B 细胞特征 (Bmem-3,p<0.001)。因此,DP-LME高表达转录因子IRF4(IRF4Up-7,p=0.019) 和OCT2(OCT2Up-1,p<0.001)。在致癌信号通路中,NF-kB(NFkB-11,p<0.001) 和 MYD88 靶向基因 (MYD88Up-2,p<0.001) 在 in-LME 中上调,而 BCR 信号 (BCRactUp-1,p<0.001) 在 DP-LME 中上调。在肿瘤微环境方面,GC-LME表达滤泡树突状细胞 (FDC-1,p=0.005)、总 T 细胞 (PanT-2,p=0.018)、CD4+ T细胞 (CD4T-2,p=0.003)、GC辅助性 T 细胞 (GCThUp-4,p=0.004) 和调节性 T 细胞 (Treg-4,p=0.007) 的特征。MS-LME 表达基质相关标记 (stromal-1,p<0.001)。IN-LME 表达CD8+ T细胞 (CD8T-5,p<0.001)、中性粒细胞 (Neutro-1,p<0.001) 和巨噬细胞(MPhage-1,p<0.001,M Phage-2,p<0.001和MPhage-3,p<0.001)的特征。而 DP-LME 缺乏所有的免疫细胞特征。
总结
该研究证明了 R-CHOP-X 的疗效和安全性,R-CHOP-X是一种基于机制的定制治疗,它靶向新诊断的 DLBCL 患者的基因和微环境改变。这项“概念验证性”研究可能提示量身定制的、基于机制的治疗策略具有潜在获益,并促进在该方向上进行进一步研究。
Guidance-01研究初步展示了基于分子分型辅助临床进行R-CHOP+“X”治疗模式的意义。基于Guidance-01的结果,瑞金团队与全国众多血液学同道共同开展了Guidance-02研究,旨在在更大范围内验证基于分子分型的R-CHOP+“X”方案的可行性。两个研究都是基于基因分型选择靶向药物的理念——用基因分型Panel来进一步细化DLBCL,有针对性的选择不同靶点的药物联合R-CHOP以取得更好效果。期待通过更详实的中国淋巴瘤患者数据为临床医生制定个体化治疗方案提供参考依据。
参考文献
Zhang M, Tian S, Fu D,et al.Genetic subtype-guided immunochemotherapy in diffuse large B cell lymphoma: The randomized GUIDANCE-01 trial.Cancer Cell . 2023 Sep 18;S1535-6108(23)00320-3. doi: 10.1016/j.ccell.2023.09.004.
Blood Reviews综述:弥漫大B细胞淋巴瘤的CNS预防——用证据说话
![]() 0
2023-06-16
点击查看
0
2023-06-16
点击查看

Blood:CAR T治疗551例老年复发/难治性DLBCL的真实世界证据
![]() 0
2023-07-12
点击查看
0
2023-07-12
点击查看

【Br J Haematol】来那度胺联合R-ESHAP治疗R/R DLBCL的II期研究
![]() 0
2023-08-07
点击查看
0
2023-08-07
点击查看

指南更新:弥漫大B细胞淋巴瘤一线治疗迎来新标准!B细胞淋巴瘤NCCN指南(2023.V1)更新要点速览
![]() 0
2023-08-20
点击查看
0
2023-08-20
点击查看

2022 弥漫大B细胞淋巴瘤临床研究年度盘点
![]() 0
2023-08-25
点击查看
0
2023-08-25
点击查看

Haematologica:CD19单抗Tafasitamab治疗R/R DLBCL的II期研究5年安全性和疗效
![]() 0
2023-09-14
点击查看
0
2023-09-14
点击查看
