在约10%的癌症中丝氨酸/苏氨酸激酶AKT发生了突变,这很大程度的说明了其在癌症中的致癌作用。除了AKT基因突变外,生长因子上游信号通路的失调常常能够激活癌细胞中的AKT。
GSK3β、FOXO和TSC2是AKT的三个主要的下游基因,其能够介导AKT对不同刺激的响应并行使多种功能。既往研究显示,AKT介导的TSC2磷酸化和抑制作用已被认为是AKT激活mTORC1(雷帕霉素复合物1)的主要机制。
mTORC1是细胞响应生长因子和营养素进行细胞增殖的中心调控因子,其在癌症中表达失调。精氨酸能够激活mTORC1。
相关机制示意图
CASTOR1(mTORC1亚基1)是一种新发现的胞质精氨酸传感器,其可对精氨酸响应并调节mTORC1的活性。有趣的是,高水平的CASTOR1蛋白会抑制AAS(包括精氨酸)对mTORC1的激活。由于癌细胞常处于低营养水平状态,因此可能存在另一种机制来调控CASTOR1的表达。
在该研究中,研究人员发现E29泛素连接酶RNF167能够对CASTOR1进行K29连接的多泛素化和降解。此外,AKT能够介导CASTOR1 S14位点的磷酸化,显著增加其与RNF167的结合,促进其泛素化和降解,并降低其对MIOS的亲和力,从而导致mTORC1的激活。因此说明AKT可通过TSC2和CASTOR1依赖性途径来激活mTORC1。
RNF167介导的泛素化和AKT1介导的磷酸化促进乳腺癌的发生发展
进一步的研究显示,几种具有较高CASTOR1表达的细胞类型对精氨酸的调节并不敏感。值得注意的是,AKT和RNF167介导的CASTOR1降解能够激活独立于精氨酸的mTORC1,并最终促进乳腺癌的发生发展。
总而言之,该研究结果揭示了mTORC1的相关调节机制,并将RNF167鉴定为mTORC1失调相关疾病的治疗靶标。
原始出处:
Li, T., Wang, X., Ju, E. et al. RNF167 activates mTORC1 and promotes tumorigenesis by targeting CASTOR1 for ubiquitination and degradation. Nat Commun 12, 1055 (16 February 2021).
Br J Cancer:多基因检测指导乳腺癌化疗的建议
![]() 0
2021-02-19
点击查看
0
2021-02-19
点击查看

英国MHRA允许开展阿霉素“前药”AVA6000治疗实体瘤的临床试验
![]() 0
2021-02-20
点击查看
0
2021-02-20
点击查看

Eur Radiol:乳腺钼靶之钙化灶——可疑形态钙化的临床意义在哪里?
![]() 0
2021-02-21
点击查看
0
2021-02-21
点击查看
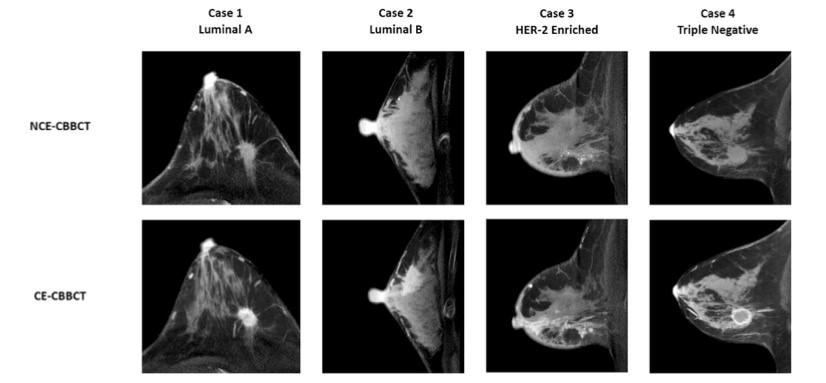
Eur Radiol:锥形束乳腺CT评价乳腺癌有何新意?
![]() 0
2021-02-22
点击查看
0
2021-02-22
点击查看
Nat Commun:BRCA1/BRCA2突变携带者的乳腺癌发病风险研究
![]() 0
2021-02-22
点击查看
0
2021-02-22
点击查看

Cell matabolism:向肥胖说不!Cell子刊揭示肥胖对乳腺癌恶化的作用机制
![]() 0
2021-02-23
点击查看
0
2021-02-23
点击查看