急性冠脉综合征(ACS)是内科危重症之一,冠状动脉粥样硬化斑块破裂是导致ACS发生的首要原因。然而,非动脉粥样硬化直接导致的ACS在
临床实践中也并非罕见。它们的
临床表现和处理方式有别于一般的ACS。本文分享了笔者工作中遇到的6个非典型ACS病例,希冀对各位同道的临床工作有所帮助。
下面共有6个ACS的病例,您觉得他们的病因是什么呢?
1
31岁女性,产后1周突发急性胸痛。心电图提示前壁ST段抬高
心肌梗死(STEMI)。患者无心
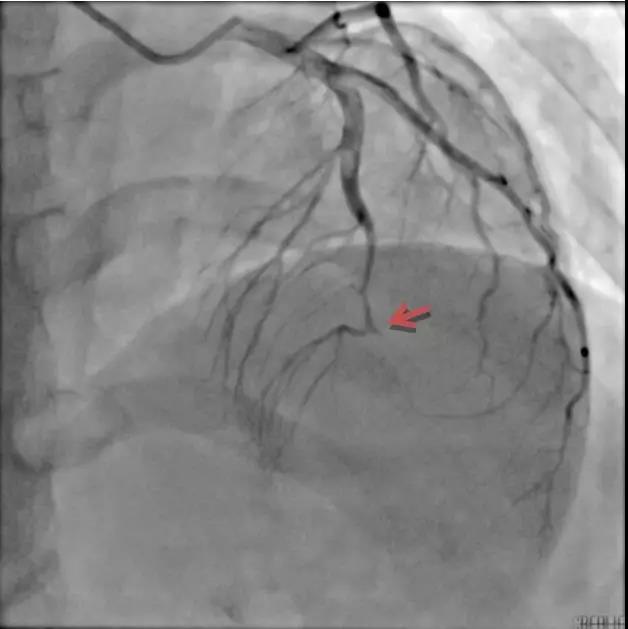
血管疾病危险因素并否认其他慢性疾病。急诊冠脉造影见前降支中远段渐变细并闭塞,余
血管光滑(图1-1),予2.0×20 mm球囊扩张及2.25×30 mm支架植入后恢复TIMI3级血流。
图1-1 病例1,箭头示前降支中远段逐渐变细并闭塞
该患者
诊断考虑疑似冠状动脉自发夹层导致心梗可能大,但遗憾的是当时没有留取腔内影像资料。
冠脉自发夹层导致心梗
冠脉自发夹层是无冠心病危险因素女性围产期心梗的主要原因,发病机制主要有内膜撕裂学说和滋养层血管破裂学说,确断依赖腔内影像,根据2018年美国心脏病协会(AHA)发表的专家
共识(图1-2),可根据患者具体情况选择药物、冠脉介入或外科搭桥治疗。
图1-2 2018AHA专家共识对冠脉自发夹层的处理流程
2
51岁男性,突发胸痛4小时。心电图提示前壁STEMI。患者无
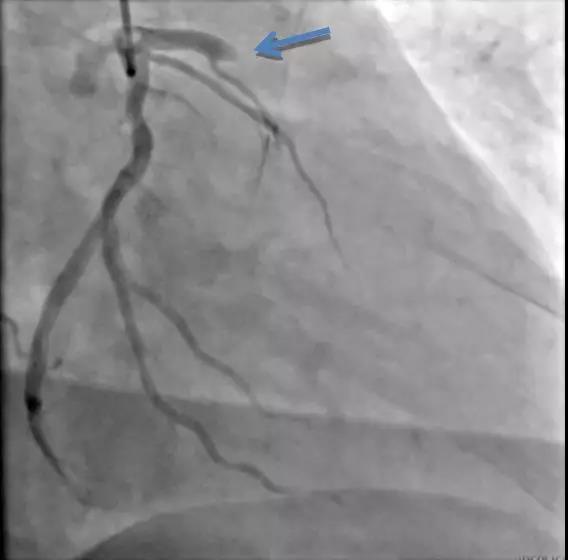
心血管疾病危险因素并否认其他慢性疾病。急诊冠脉造影显示前降支近段闭塞,余血管光滑(图2-1)。予2.5×15 mm球囊扩张和3.5×18 mm支架植入后恢复TIMI3级血流。次日超声心动图(心超)发现左房占位,黏液瘤可能 (图2-2)。4周后行外科手术,病理证实为左房黏液瘤。
图2-1 病例2,箭头示患者前降支突然中断
图2-2 病例2,箭头示心超中左房粘液瘤样占位
诊断
该患者诊断高度怀疑左房黏液瘤导致冠脉栓塞。
左房黏液瘤导致冠脉栓塞
左房黏液瘤及其附着
血栓理论上均可能导致冠脉栓塞,但临床实践中的病例报道相对较少,此类患者通常无传统冠心病危险因素,造影通常无冠脉弥漫病变,而表现为类似血栓病变,血管突然闭塞的形态。确诊依赖于获取冠脉内栓子与外科手术标本进行病理对照。如PCI术前怀疑粘液瘤引起冠脉栓塞,可通过抽吸等手段恢复血流,尽可能不植入支架。
3
53岁女性,急性胸痛入院,心电图提示前壁STEMI。发病前与家人发生剧烈争执,无冠心病危险因素。急诊冠脉造影提示冠脉各支均通畅。左室造影见收缩期心尖球形改变(3-1)。术后心脏磁共振检查示心尖节段前壁活动明显减弱至消失,局部心肌水肿但无明显心肌坏死(图3-2)。1个月后复查心超和心脏磁共振,心脏活动恢复正常。
图3-1 病例3,心室造影心尖呈球形改变
图3-2 病例3心脏磁共振左室短轴位,左图箭头示室间隔心肌水肿,右图钆剂注入后未见明显延迟强化,提示没有明显心肌坏死
诊断
该患者诊断考虑为Takotsubo综合征,又称为心尖球形综合征和心碎综合征。
Takotsubo综合征
Takotsubo综合征易发于绝经期女性,患者一般无冠心病危险因素,多由剧烈情绪激动诱发。目前认为该症与交感神经系统过度激活造成的大量儿茶酚胺释放导致急性心肌顿抑相关。根据2018年发表的《国际Takotsubo综合征专家共识》,诊断依赖年龄、性别、情绪诱发、冠脉造影和左室造影结果。同时,心脏磁共振所见室壁活动异常,心肌水肿但缺乏心肌坏死有重要提示价值。该症可能与远期不良事件相关,目前治疗参照
心肌梗死神经内分泌拮抗治疗,但尚缺乏系统的循证医学证据。
4
59岁女性,突发持续压榨样胸痛4小时。心电图提示前壁STEMI。患者无冠心病危险因素。急诊冠脉造影显示前降支近段闭塞,余血管光滑。血管内超声(IVUS)见闭塞远/近段管腔结构正常(图4-1),闭塞段见低信号团块影(图4-2)。2.5×15 mm-3.0×15 mm球囊扩张后植入3.0×12 mm支架,血流未恢复,IVUS见支架贴壁良好,无夹层。冠脉内予以替罗非班和硝普钠后血流未恢复,遂下台。
图4-1 病例4 血管内超声前降支闭塞近端(左)和远端无明显粥样硬化负荷。
图4-2 病例4 血管内超声前降支闭塞段未见明显粥样硬化斑块负荷,但有形态不规则的低密度团块样物质。
次日补充病史,患者诉近2月有反复发热(最高39℃),白细胞升高(最高 20.0×10^9/L),间断使用多种抗菌药治疗,近一周无发热。血沉(ESR)54 mm/h,C反应蛋白(CRP)36.03 mg/L,球蛋白增高,主动脉瓣区轻微收缩期杂音。心脏彩超发现主动脉左冠瓣下见一个15×6 mm大小带蒂毛绒状赘生物(图4-3),随血流在主动脉瓣口摆动,主动脉瓣轻度反流,左室射血分数(LVEF)约35%。
图4-3 病例4 术后心超见主动脉瓣上赘生物
诊断
因高度怀疑感染性心内膜炎引起冠脉栓塞,予以大剂量抗菌药抗感染。但患者术后24 h又出现发热(最高体温38.9℃),白细胞升至19×109/L,并出现急性
心衰症状和贫血、肝损和肾功能不全。左心室迅速扩大,左室射血分数(LVEF)进一步降低,患者于2周后死亡。
感染性心内膜炎合并STEMI发病较少,机制可为脓肿压迫冠脉开口或赘生物直接栓塞冠脉。已发表病例报道中主动脉赘生物多于二尖瓣。在一组586名感染性心内膜炎患者的研究中发现,ACS发生率为2.9%,其中64%的患者死亡。对于怀疑感染性心内膜炎合并冠脉栓塞患者,研究显示溶栓效果不佳且易导致脑出血。PCI术中多见无复流和术后心肌多发脓肿,推测PCI容易导致菌栓碎裂,引起微循环栓塞和感染扩散。在一些案例中血栓抽吸可有效恢复血流。积极的
抗生素治疗同样非常重要。
5
62岁男性,因活动后胸闷1个月,加重2天入院。患者有吸烟、
高血压和
糖尿病史,造影显示前降支次全闭塞,植入3.0×18 mm支架后狭窄消失,予阿司匹林+氯吡格雷抗血小板治疗。术后第9天,患者晚饭后剧烈胸痛,心电图提示前壁STEMI。急诊造影提示前降支支架近段起闭塞,予以血栓抽吸+球囊扩张后血流恢复。基因检测提示患者肝酶CYP2Y19为对氯吡格雷弱代谢型。
诊断
疑似氯吡格雷抵抗导致亚急性支架内血栓。
氯吡格雷抵抗导致亚急性支架内血栓
氯吡格雷本身为前体药物,经肝细胞色素P450代谢转化为活性代谢物(硫醇衍生物)后才发挥抑制血小板聚集的作用。其关键酶同工酶CYP2C19存在显著的基因多态性,按其对氯吡格雷的转化效率可分为超强/强代谢基因型、中代谢基因型、弱代谢基因型,弱代谢患者难以将氯吡格雷转化成活性成分发挥抗血小板作用。研究显示氯吡格雷基因型与早期支架内血栓相关。2012年AHA《不稳定心绞痛(UA)/(非ST段抬高型
心肌梗死)NSTEMI指南》推荐可以对ACS患者予以基因CYP2Y12检测(Ⅱb,C)并根据不同基因型推荐个体化调整抗血小板方案。临床药物基因组学实施联盟(CPIC)也对基于CYP2C19基因检测的氯吡格雷个体化治疗进行了推荐(图5-1)。在临床实践中,对于左主干或冠脉近端植入支架或接受复杂PCI手术的患者,可以进行基因检测,以避免由于氯吡格雷代谢异常导致的支架内血栓引发灾难性后果。
图5-1 基于CYP2C19基因型的个体化抗血小板方案临床路径。原图来自《氯吡格雷抗血小板治疗个体化用药基因型检测指南解读》,中国实用内科学杂志2015年35卷第一期38-41页
6
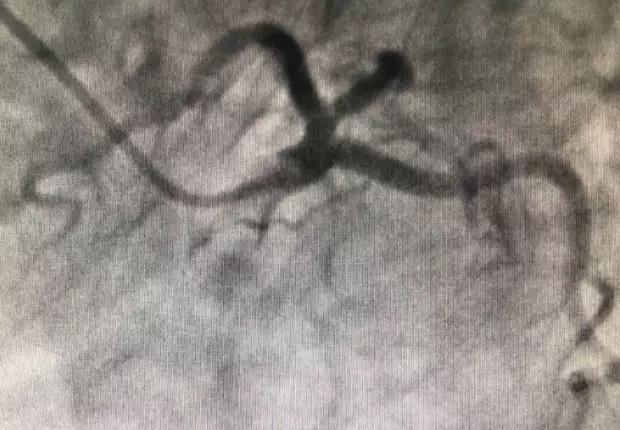
65岁女性,因稳定性心绞痛行冠脉造影,提示前降支近中段严重狭窄(跨第一对角支),植入3.5×30 mm支架植入。1年后复查支架通畅,无新发斑块(图6-1)。支架植入后13个月因“反复胸闷1周”入院。心电图示前壁、高侧壁缺血改变,肌钙蛋白增高,冠脉造影见前降支支架内再狭窄60%,第一对角支开口狭窄99%,以3.5×12 mm+2.5×15 mm球囊行对吻扩张,狭窄明显改善。1个月后再次发生ACS,造影见前降支支架内再狭窄95%、对角支开口狭窄95%,再次球囊对吻扩张并将氯吡格雷改为替格瑞洛。1个月后再发ACS。急诊冠脉造影见前降支支架内再狭窄99%、对角支开口闭塞,IVUS见支架内组织增生,但未见支架形态明显改变,球囊对吻扩张后前降支以药物球囊处理。2个月后患者再次ACS,造影提示前降支支架内99%狭窄,对角支闭塞,患者接受外科搭桥手术(图6-2)。支架内反复再狭窄的常见原因包括血栓形成和支架形态不良(支架贴壁不良、支架断裂)。该患者规律服用抗血小板药物,影像学检查未见支架形态不良。
图6-1 病例6患者术后1年复查造影,提示前降支支架良好
图6-2 图为患者随后反复发生4次ACS时的造影结果
诊断
本例患者需要考虑支架成份过敏(聚合物过敏、金属过敏)可能。
支架成分过敏导致心梗
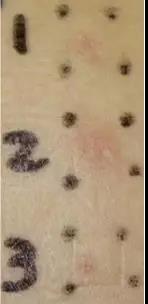
支架成分过敏以金属成份过敏更多见,尤其钴和镍,多在药物释放完毕后出现(支架植入后6-9个月),之后短期内反复发生,球囊扩张多无效;光学相干断层成像检查可发现支架内可见巨噬细胞和嗜酸性细胞的明显浸润伴内膜迅速增生。皮肤过敏试验(图6-3)可能提供诊断依据,日本医生曾报道一例54岁女性半年内反复4次支架内狭窄,支架皮肤实验呈阳性,给予激素和
免疫抑制剂后15个月无再狭窄发生。
图6-3 支架成份皮肤过敏试验:在一例反复支架内再狭窄的患者皮肤上使用真实支架材料进行接触试验:1为钴铬合金药物支架;2钴铬合金裸支架;3对照组。试验提示患者对钴铬合金裸支架明显过敏,对钴铬合金药物支架轻度过敏。原图来自Catheter Cardiovasc Interv. 2016 Mar;87(4):E137-42
小结
以上病例并没有涵盖特殊类型ACS的全部。临床医生应牢记部分患者的ACS并非由冠状动脉粥样硬化直接引发。完善的冠心病风险评估、病史追溯、冠脉形态观察往往能够起到有效提示作用。同时,术前心超、术中腔内影像和术后心脏磁共振影像等技术都能帮助诊断。由于发病原因、临床特点各异,对于此类患者更应强调因地制宜的个体化治疗策略。
来源:中国医学论坛报今日循环
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言
![]() 0
2019-01-05
点击查看
0
2019-01-05
点击查看
![]() 0
2019-01-13
点击查看
0
2019-01-13
点击查看

![]() 0
2019-02-13
点击查看
0
2019-02-13
点击查看
![]() 0
2019-03-14
点击查看
0
2019-03-14
点击查看
![]() 0
2019-06-20
点击查看
0
2019-06-20
点击查看
![]() 0
2019-07-04
点击查看
0
2019-07-04
点击查看
