双特异性抗体的研发已有二十多年的历史。
和单抗相比,双抗的应用具有单抗不具备的优点,但双抗研发也有比单抗研发更高的技术要求。如何拓宽双抗的应用并克服研发中遇到的技术瓶颈,是大家都关心的问题。
在同写意15周年活动前夕,庆典嘉宾,Ab Studio Inc.创始人刘跃博士接受了同写意的采访,就双抗研发对以下三个问题发表了感想:
1)你对双抗药物的开发未来是否看好?为什么?
2)你认为双抗开发的关键和难点是什么?为什么?
3)你认为未来双抗开发的重点治疗领域是什么?为什么?
刘跃博士是同写意第64期活动报告人,图为刘跃博士在会议现场。
01 关于双抗开发的未来
靶向多靶点和同一靶点的不同表位会带来更好的疗效,这一点已得到业界公认。而达到这一目的的方法却可以有很多种。比较常用的方法有:
# 联合使用抗不同靶点或同一靶点不同表位的单抗
比如trastuzumab(Herceptin)和bevacizumab(Avastin)就曾被联用于治疗“primary inflammatoryHer2 positive”
乳腺癌(https://clinicaltrials.gov/ct2/show/NCT00717405)。
# 使用几种单抗的混合物,模拟多抗
比如Sym004, 两种抗EGF-R 单抗的混合物,就曾被应用于治疗对EGF-R 单抗疗法耐药的头颈癌病人(https://clinicaltrials.gov/ct2/show/results/NCT01417936)。
# 使用双特异性抗体
和前两种方法相比,双抗有两种优势:首先,“AB”形式可以解决一些”A+B”形式无法解决的问题,比如T cell recruitment。其次,在好的设计和好的平台护航下,“AB”的生产成本应该低于”A+B”。在过去的二十年间,双抗的构建和应用都有了长足的进步。
FDA迄今为止批准的三例双抗catumaxomab(anti-CD3 and anti-EpCAM),blinatumomab(anti-CD3 and anti-CD19)和emicizumab(anti-Factor IXa and Factor X)分别使用不同的结构设计和应用不同的靶点生物学,它们作为双抗在
临床应用的实证既预示了双抗应用的广泛前景,也暴露了不少现有双抗模式本身及研发过程中存在的问题。
相信随着业界同仁们的共同努力,双抗药物设计和生产会越来越进步,在未来的应用也会更越来越广泛。所以关于双抗开发的未来,我觉得可以总结成一句哲学名言:“前途是光明的,道路是曲折的”。
02 双抗开发的关键和难点
双特异性抗体的开发关键我认为在于如何根据相关的靶点生物学来选择合适的技术平台和克服与具体平台相关的技术难点。简单地说,就是要根据应用来设计。
以FDA 已批准的三例双抗为例,它们现有的优点都来自于应用需要和设计统一的部分,而它们的缺点也是来自于应用需要和设计不统一的部分。下面是我的逐例分析:
1)Catumaxomab(anti-CD3 and anti-EpCAM)
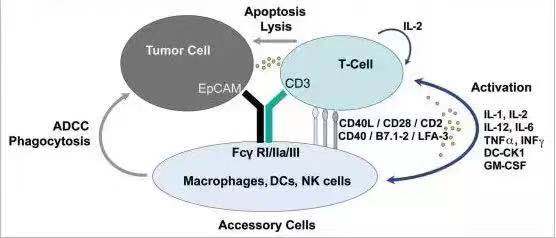
做为第一例被FDA批准的双抗,catumaxomab想要达到的应用目标是“一个三功能” 的双特异性抗体。如下图所示,左臂靶向EpCAM阳性的肿瘤细胞,右臂recruit T 细胞,Fc端结合NK, Macrophage等效应细胞,通过
Cited from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2840231/figure/F1/
T cell mediated lysis, cytotoxicity by released cytokines(e.g., IL1β, IL-2, IL-6, IL-12 or DC-CK1),phagocytosis or ADCC等多重效应来杀伤肿瘤细胞。
作为第一个被FDA批准的T cell recruiter类双抗,catumaxomab具有里程碑式的意义。事实上,在对有腹水的
卵巢癌和其它癌患者的治疗中,catumaxomab的确显示了良好的疗效。
但在这一过程中,细胞因子风暴引起的发热、恶心、呕吐等副作用多有出现,同时,在第0,3,7和10天分别进行10,20,50and150μg四次注射后,70%的患者出现了Human anti-mouse antibody/human anti-rat antibody(HAMA/HARA)。
这些副作用可能和以下因素相关:
o
Rat/Mouse 嵌合抗体对人体的
免疫原性;
o 双抗对CD3较高的亲和力导致的未结合肿瘤细胞时就低活化T细胞所引起的细胞因子风暴;
o 双抗在结合肿瘤细胞后过度活化T细胞引起的细胞因子风暴;
o EpCAM 在某些正常组织上也有相当量的表达引起的双抗对正常组织的潜在非特异性杀伤。
回顾这一抗体的研发和应用,在治疗的有效性需求上,设计达到了很好的满足。但在治疗的安全性需求上,设计却有不少可以改进的方面。比如抗体可以人源化以大幅降低HAMA/HARA。
CD3端的亲和力可以做一些差异化设计来研究一下亲和力在什么范围内可以让抗体比较好地到达安全性和有效性的平衡。但是,catumaxomab的里程碑意义依然无容置疑。它为我们打开了这一类双抗疗法的窗口。
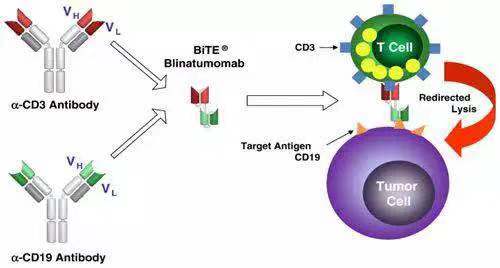
2)Blinatumomab(anti-CD3 and anti-CD19)
Blinatumomab是第二例FDA 批准的T cell recruiter 类双抗。这一双抗把抗CD19和CD3的两个单抗的ScFV用一个“GGGGS” 连在一起,通过T cell mediated lysis, cytotoxicity by released cytokines来治疗适应症(复发型ph-ALL)。由于去除了Fc,这一双抗没有ADCC和CDC功能。尽管Blinatumomab没有人源化且使用了外源性的His tag(https://www.drugbank.ca/drugs/DB09052)使纯化更方便。
因为分子量小,半衰期短,所以只有小于1%的受治疗患者有ADA反应。但由于有T cell activation,依然有相当一部分患者有细胞因子风暴引起的副作用
(https://www.researchgate.net/publication/284640091_A_review_of_blinatumomab_a_novel_immunotherapy)。
Cited from: https://www.sciencedirect.com/science/article/pii/S0014482711001029
同时,由于Blinatumomab的血清半衰期只有1.25+/-0.63小时,所以静脉用药时需要使用infusion bump。这在
临床使用上有一定的不便之处。Blinatumomab的应用需求中的安全性和有效性平衡需求通过所选的技术平台和结构模式得到了一定的满足,但是在成药性部分的PK需求上则未得到满足。这也真是”BITE” 这种平台在临床应用上的最大局限。
3)Emicizumab(anti-Factor IXa and Factor X)
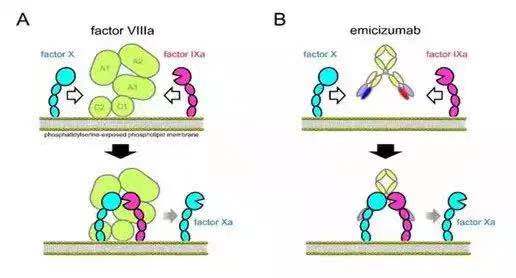
Emicizumab是FDA 批准的第三例双抗,它的应用和前两例完全不同。它的机制是模仿凝血因子VIII,与凝血因子IXa和X结合后,促进X降解成Xa并释放Xa,使凝血级联反应得以进行和完成。所以它是个VIII因子的“仿制品”。
Cited from: https://www.quora.com/What-is-the-mechanism-of-action-of-emicizumab
如果说catumaxomab验证了双抗在T cell recruitment 上的可应用性,blinatumomab用一个新的结构平台延伸了这类应用的话。Emicizumab在临床应用上的成功则预示了双抗应用范围的广泛性和不可限性:只要有临床需要和生物学意义,又和双靶点相关的问题,都可以尝试用双抗来解决。
Emicizumab的研发在抗体工程学上也是经典案例,几乎运用了所有工程学方法:Fc engineering to enable the formation of the best hetero-dimer, common light chain screening and optimization, affinity maturation, Fv humanization and optimization, remove deamidation, remove positive patch, remove hydrophobic patch and remove predicted immune-epitope……
Emicizumab作为最近一个被FDA 批准的双抗,虽然也有一定的副作用(https://www.rxlist.com/hemlibra-side-effects-drug-center.htm#overview),但目前在有效性,安全性和成药性方面尚未有不良报道。
这一双抗筛选以VIII因子的功能实验做主导,充分体现了从应用出发进行设计的理念。在发表的相关文献中,作为VIII因子的“仿制品”,emicizumab未能完全模仿VIII因子的一个性状是:VIII因子与IXa结合的亲和力(KD)在nM级,而其与X因子的亲和力(KD)在1-3uM, 远低于其与IXa的结合。
可能是因为与IXa的结合起稳定结构的作用,而与X的低结合更有利于释放被降解后的Xa因子。而emicizumab和IXa及X的亲和力则非常接近,都在uM数量级。其和IXa的结合仅稍高于和X 的结合。Emicizumab和VIII的这种差别可能基于研发技术的限制,也可能是基于其和VIII蛋白结构和形状的差异。
综上所述,双抗的研发门槛非常高,要达到安全性,有效性,成药性的平衡比单抗更难。那如何能设计并制备同类中最好的双抗呢?我认为,需要按顺序做好以下几点:
o 首先要思考做一个双抗需要满足什么样的临床需求和解决什么样的临床问题
o 双抗需要具有哪些功能才能最好地满足这一临床需求和解决这一临床问题
o 选用什么样的结构和平台才能使双抗具备这些功能
o 用选定的结构和平台构建双抗并进行序列优化,用体外实验测试有效性,安全性和成药性
o 选一个最好的序列进行中试及动物实验
设计应该为应用服务,能最大限度满足应用的设计,哪怕用的是最简单的平台,也是一个好的设计。
03 未来双抗开发的重点治疗领域
如前文所述,我认为Emicizumab的研发成功给了双抗研发者一个启示:只要是和临床需求关联并且有生物学意义的双靶点,都可以用来开发双抗。所以双抗的应用不会局限在某类疾病领域,而是会涵盖需要双靶点生物学的所有疾病领域。根据过去二十年的双抗研发工作判断,未来的双抗研发重点可能会集中以下治疗领域:
1)恶性肿瘤
Catumaxomab和Blinatumomab都是这样的案例。
除了这两种模式的双抗外,DARTs和TandAbs也曾被报道过可以把免疫效应细胞导向肿瘤并杀伤肿瘤(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4687327/0.)
这一类双抗其应用的有效性已有实例证明,未来的方向应该是如何研发有效性,安全性和成药性更好统一的第二代双抗。Genentech2:1模式的TCB及IgM Bioscience的IgM类T cell engagers是平衡这类双抗安全性,有效性的新尝试。
Ab Studio通过computer aided design辅助的高低双抗平台,对类似于catumaxomab的“三功能”双抗做了改良和优化的尝试。我们选的第一对双靶点是CD20和CD3。吸取了catumaxomab高副作用的教训,我们人源化了双抗序列,并且在CD3结合上仅维持了极低的亲和力。
在体外实验中,这一双抗既无法在与CD20-细胞和CD3+模型T细胞温育的情况下活化T细胞,也无法通过ADCC/CDC杀伤CD3+模型细胞,且与PBMC温育后也不影响PBMC中T细胞的比例。说明其在体外实验条件下具有非常好的安全性。
在有效性实验中,该双抗可以在与CD20+靶细胞和CD3+模型T细胞温育的情况下与Benchmark类似地活化T细胞,并可以通过T细胞杀伤及诱导CD20+靶细胞ADCC/CDC引发比CD20单抗及Benchmark更广泛的肿瘤杀伤效应。
在PBMC engrafted CD20+肿瘤及耐药肿瘤模型中,该新型双抗都显示了非常好的有效性。我们在双抗Fc区引入的新突变使该双抗的heterodimer形成比例更高, 纯化更容易。Computer designed成药性也通过生化分析得到了验证。
由于有成功案例的证明和支持,预期未来这一研发方向依然会是主流。
? 应用二:通过结合I-O双靶点后更有效地抑制肿瘤生长
比如靶向PD-1/CTLA4 的双抗,靶向PD-L1/41BB的双抗……, 通过更多的机制来更好地活化免疫系统, 抑制肿瘤生长。
? 应用三:通过结合双靶点后更有效地抑制对肿瘤生长必需的信号传导通路来抗瘤
比如抑制Her2和 Her3的MM-111(HSA body bsAbs),抑制IGF-IR和 HER3的MM-141(ScFv-IgGs)及抑制EGFR 和 HER3的Duligotuzumab(two-in-one(DAF))。随着对多种肿瘤发病机制及信号传导通路的进一步研究,相信未来会发现更多的与信号传导相关的双靶点,用以研发更多的双抗。
比如靶向VEGFA和angiopoietin-2(Ang-2)的RG7221(CrossMab)。这类双抗既可以用于治疗肿瘤,也可以用于治疗其他
血管增生型疾病,如湿性视网膜黄斑病变。
? 应用五:通过结合一个内吞缓慢的主靶点和另一个内吞快速的次靶点来诱导主靶点内吞,以更好地阻断主靶点的功能
比如Andreev J等最近报道的靶向Her2和PRLR的双抗ADC,就可以借助PRLR的快速内吞加快Her2的内吞及诱导更有效的靶细胞杀伤。类似于这一发现,我们发现靶向PDL1和另一靶细胞表面快速内吞靶点的双抗也可以加速PDL1的内吞,因此可以更有效地阻断PDL1/PD1的相互作用。在PDL1单抗不起效的
胰腺癌细胞模型上,我们研发的内吞型PDL1双抗显示了良好的
胰腺癌细胞杀伤效应。
比如Ablynx公司一系列结合细胞因子和HSA双靶点的nanobodies, 和TNF-α,IL-6R…的结合是功能需要,和HSA的结合是为了延长半衰期。还有Ablynx的靶向IL-17A/F的双抗。
3)CNS
比如靶向BACE1和TfR的双抗。和BACE1的结合是为了靶向阿兹海默症靶点,而和TfR的结合则为了让抗体穿越血脑屏障。
比如靶向Psl和PcrV的双抗BiS4αPa。其和Psl的结合是为了阻断细菌的免疫逃避,和PcrV的结合是为了阻止细菌毒性因子的释放。随着双抗研发的持续深入,相信在不远的将来,会有越来越多的疾病得到新一代双抗的有效治疗。
刘跃博士
Ab Studio Inc. CEO、联合创始人
在22年的抗体药物研发职业生涯中,刘跃博士领导和参与过多种疾病的14个治疗用抗体研究,包括研发抗
血栓抗体对心肌梗塞和静脉栓塞进行导向显像和导向溶栓;能被肿瘤特异性内吞的抗体对肿瘤进行抗体偶联药物治疗;针对阿兹海默症和帕金森氏综合症、视网膜黄斑病变及研发针对多种罕见病的治疗用抗体。其中两个抗体已进入II期临床。
刘博士曾供职于DigitAb Inc.(2007-08),UCSF(2009-11),Elan Pharmaceuticals(2011-12)和Prothena Bioscience(2012-16)并担任 Prothena的创新俱乐部负责人。2017年初作为共同创始人在旧金山湾区创建了Ab Studio Inc.。
来源:生物探索
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言