Dorzagliatin是基于葡萄糖激酶(glucokinase,GK) 作为血糖传感器,在血糖稳态调控中发挥核心作用的全球领先科学概念而开发。通过修复成年2型糖尿病患者下降的GK功能,重塑血糖稳态,而实现治疗2型糖尿病。

Dorzagliatin分子结构式
华领医药在中国同时开展2项52周的3期注册临床研究,此次公布的是在从未接受过糖尿病药物治疗的2型糖尿病患者中开展的HMM0301的24周研究结果。HMM0301临床研究的前24周为随机双盲、安慰剂对照的疗效和安全性研究,患者以2:1比例纳入dorzagliatin或安慰剂组,接受一天两次dorzagliatin 75mg或安慰剂治疗,研究者每4周进行一次随访,该研究的后28周为开放式活性药物治疗的安全性研究,所有患者均接受dorzagliatin 75mg一天两次治疗。
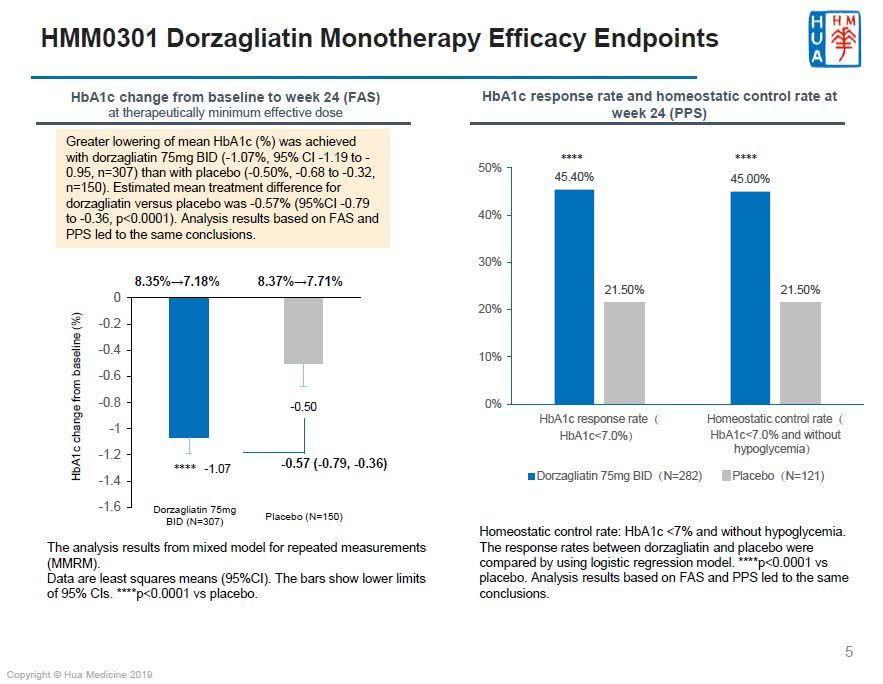
HMM0301临床研究已达到主要疗效终点。经过24周治疗,dorzagliatin治疗组的糖化血红蛋白(HbA1c)从基线8.35%降低了1.07%(最小二乘法平均值),安慰剂组从基线8.37%降低了0.5%。dorzagliatin治疗组HbA1c降低与安慰剂组相比,组间差异具有显著的统计学意义(p<0.001)
图片来源(华领医药)
Dorzagliatin在24周单药治疗期间安全耐受性好,与2018年5月发表在《柳叶刀:糖尿病内分泌》杂志上的2期临床研究结果一致(详细见:Lancet Diabetes Endo:国产II型糖尿病新药临床效果显著)。按照美国糖尿病协会ADA的低血糖标准,临床相关低血糖发生率(见附录1)低于1%,且未观察到严重低血糖(见附录2)。针对临床安全数据集的分析结果显示,dorzagliatin与安慰剂组双盲期期间的不良事件发生率相似,大部分的不良事件严重程度为轻度,无死亡事件。Dorzagliatin治疗组,未发生研究者判定的与药物相关的严重不良事件。

华领医药研发管线(图片来源:华领医药)
作为HMM0301的首席研究者,中华医学会糖尿病学分会现任主任委员、南京鼓楼医院内分泌科主任朱大龙教授指出,“HMM0301研究24周的初步研究结果,使我们在修复血糖传感、重塑血糖稳态,针对糖尿病病因开发全球糖尿病新药的征程中又迈进了一步。Dorzagliatin通过在胰岛、肝脏和肠道发挥作用,调节胰岛素、胰高糖素和GLP-1的分泌,促进血糖稳态平衡。非常高兴看到dorzagliatin临床研究的新进展,希望dorzagliatin的成功,为2型糖尿病患者提供一种新的治疗手段。”
“我们对dorzagliatin单药临床研究结果非常兴奋,它首次在临床试验中验证了使用双重机制葡萄糖激酶启动剂治疗2型糖尿病是可行的、有效的、安全的。” 华领医药创始人,首席科学官,首席执行官陈力博士说。“华领医药一直在开展对dorzagliatin的各项研究,旨在通过对其最低治疗有效剂量的探索,使dorzagliatin为修复血糖传感器GK功能的基石药物,用单药,或联合临床广泛使用的降糖药品,如二甲双胍,DPP4抑制剂,SGLT2抑制剂,GLP-1受体激动剂或胰岛素,来实现2型糖尿病的个性化治疗,遏制糖尿病的发生和发展。我们正在开展的HMM0302【NCT03141073】3期临床试验就是在二甲双胍足量治疗失效的2型糖尿病患者中展开的,希望dorzagliatin联合二甲双胍能给此类患者带来福音。我们正在美国和中国开展着多个临床研究,探索dorzagliatin在不同的2型糖尿病患者人群治疗效果,以及在代谢性疾病和认知功能障碍相关领域的新用途。”
HMM0302研究的首席研究者、中华医学会糖尿病学分会前主任委员、中日友好医院内分泌科代谢中心前主任杨文英教授:“这一里程碑,无论对中国糖尿病药品市场,还是全球糖尿病患者,都具有重大意义。除了这个重要的3期临床研究,目前还有多项dorzagliatin的临床研究在中国进行。我们相信dorzagliatin为解决2型糖尿病的病因提供了新的希望。”
“我们大约8年前在中国创建了一个真正的创新型生物技术公司——华领医药,希望她能为全球糖尿病人带来福音。” 华领医药董事长、ARCH风险投资创始人和常务董事罗伯特-尼尔森先生说。“随着HMM0301临床研究24周核心资料的产生,华领医药成为中国第一个开发全球首创新药的生物技术公司,能够在展示所期望的安全指标的同时,成功达到主要治疗终点。这对华领医药、中国临床研究者都是一个重大的里程碑,更是对全球倍遭糖尿病苦难折磨的社会群体的一个重大里程碑。”
HMM0301临床研究设计
HMM0301是在中国从未接受过糖尿病药物治疗的2型糖尿病患者中展开的随机双盲、安慰剂对照的注册性52周3期临床研究,共纳入463位受试者。其中前24周为随机双盲、安慰剂对照的疗效和安全性研究,受试者以2:1比例入组,随机接受一天两次口服75mg dorzagliatin 或安慰剂。后28周为开放式活性药物治疗的药物安全性研究。同时,临床研究者贯彻中华医学会糖尿病学分会的指南要求,对受试者进行加强锻炼和饮食控制,并按时进行自我血糖监控的教育。在第24周时,对dorzagliatin的主要疗效终点进行评估。本研究由中华医学会糖尿病学会现任主任委员朱大龙教授领衔,在中国40家临床中心开展。华领医药预期在2020年第二季度获得52周临床研究结果。
本公司无法保证本公司将于2020年第二季度获得52周临床研究结果或可以成功开发或最终成功推出dorzagliatin。本公司股东及潜在投资者于买卖本公司股份时务请审慎行事。
关于Dorzagliatin
Dorzagliatin是全球首创双作用的葡萄糖激酶启动剂,旨在通过恢复2型糖尿病患者的葡萄糖稳态来控制糖尿病渐进性退变性疾病发展。通过修复葡萄糖激酶的葡萄糖传感器功能的缺陷, dorzagliatin具有恢复2型糖尿病患者受损的血糖稳态状态下的潜力,可作为治疗该疾病的一线护理治疗标准,或作为与目前批准的抗糖尿病药物联合使用的基础治疗。
关于华领
华领医药是一家立足中国,针对全球糖尿病患者尚未满足的临床需求,研发全球原创新药的生物技术公司。华领医药汇聚全球高端人才和科技资源,以国际顶级生物医药投资团队为依托,成功实现了全球首创糖尿病新药dorzagliatin在中国完成药品可开发性临床验证,率先进入注册性临床试验阶段。目前公司已在中国开展2个3期临床试验以及在美国进行2个1期试验治疗成人2型糖尿病。公司将启动药品生命周期管理相关临床试验,并拓展糖尿病个性化治疗和管理的先进理念,联合中国和美国糖尿病领域专家,实现对糖尿病和代谢性疾病及其并发症的有效控制。
附录1. 根据美国糖尿病协会ADA在2019年发布的糖尿病医学诊疗标准(Standards of Medical Care in Diabetes), 低血糖定义为血糖水平<3.0 mmol/liter。
附录2. 根据美国糖尿病协会ADA在2019年发布的糖尿病医学诊疗标准(Standards of Medical Care in Diabetes),严重低血糖定义为无特定的葡萄糖阈值,伴有严重认知障碍的低血糖症,需要外部援助才能恢复。
附录3. II期临床研究结果报道:Lancet Diabetes Endo:国产II型糖尿病新药临床效果显著
Stroke:糖尿病与缺血性卒中的风险增加有关
![]() 0
2019-11-07
点击查看
0
2019-11-07
点击查看

Diabetes Care:儿童胰腺炎与成年后糖尿病风险
![]() 0
2019-11-07
点击查看
0
2019-11-07
点击查看
J Diabetes:实锤!睡眠效率低将大大增加糖尿病风险!
![]() 0
2019-11-07
点击查看
0
2019-11-07
点击查看
Nat Rev Genet. :环状RNA的合成与功能,与糖尿病、神经系统疾病、心血管疾病和癌症等疾病有关
![]() 0
2019-11-09
点击查看
0
2019-11-09
点击查看

JCEM:细胞因子与糖尿病进展之间的关联
![]() 0
2019-11-09
点击查看
0
2019-11-09
点击查看

Diabetes Care:预防性植入ICD的糖尿病患者适当电击和死亡率分析
![]() 0
2019-11-12
点击查看
0
2019-11-12
点击查看