梅斯医学小编按:
这篇研究不仅仅是铜死亡,还会给人类带来很多启示与启发。
首先,铜在人体蓄积可能会引发多种疾病,如肝豆状核变性等。但是,铜又是必不可少的。事实上,其它金属也如此,如锰,铬,锌,铂,银等这些金属,无论是过多或过低,都是不可以的。过多了,会对特定的脏器形成损伤,也许将来,我们还会发现锰死亡,铬死亡,铂死亡等新的死亡现象。人类对于这些金属离子在人体内的作用,可能存在精确地调控作用。甚至,这些金属离子多与少,还能对人体正常功能起到关键的平稳作用。
其次,这篇研究也为人类治疗铜代谢障碍疾病,如Menke病、肝豆状核变性(Wilson病)、CTR1缺陷等铜代谢障碍疾病带来新的治疗机遇。
当然,人体和哺乳动物铜稳态的关键靶点包括作为血浆中交换性铜的主要蛋白载体的铜蓝蛋白、CTR1(也被称为SLC31A1)和细胞铜摄取的相关离子转运体、胞浆金属伴侣(ATOX1)和胞浆线粒体金属伴侣(CCS, SCO1, SCO2,COX11和COX17)靶向将铜插入金属酶和依赖铜的ATP酶ATP7A和ATP7B,具有铜输出和金属伴侣的功能。金属硫蛋白1 (MT1)和MT2是三种富硫醇蛋白中的两种,具有与多种铜离子结合的高亲和力。同时,铜也是一种动态信号金属和金属变构调节剂,例如在脂解过程中依赖铜的磷酸二酯酶3B (PDE3B),细胞生长和增殖中的丝裂原活化蛋白激酶激酶1 (MEK1)和MEK2,自噬中的激酶ULK1和ULK2。最近有新的理论,细胞依赖铜增殖的称为铜增生,与这篇铜死亡刚好对应。这些酶可能与FDX1信号存在某些交互作用,这可能都是未来研究的热点。
最后,还是肿瘤!与非分裂细胞相比,癌细胞对铜的需求更高。有研究显示,在动物模型和多种癌症患者的肿瘤或血清中铜浓度升高,这些癌症包括乳腺癌、肺癌、胃肠道癌、口腔癌、甲状腺癌、胆囊癌、妇科癌、前列腺癌。未来铜螯合剂有望被开发作为肿瘤的辅助治疗药物。
以下是正文
从细菌、真菌到植物和动物,铜都是生命的基本元素。在人类体内,它与酶结合,帮助血凝块、激素成熟和细胞处理能量,也参与很多生物学行为。但是,过多的铜会杀死细胞,造成多个脏器病理伤害。正常情况下,细胞通过主动的内环境平衡机制来调节细胞内铜的含量,保持在一个相对极低水平,以防止过量的铜积累而导致细胞损伤。铜稳态的遗传变异导致危及生命的疾病,并且铜离子载体和铜螯合剂都被建议作为抗癌剂。然而,铜离子载体诱导的细胞毒性机制仍不清楚。
2022年3月17日,麻省理工学院和哈佛大学Broad研究所Peter Tsvetkov和Todd R. Golub团队团队在Science 在线发表题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”的研究论文,该研究在人类细胞中表明,依赖于铜的、受调节的细胞死亡不同于已知的死亡机制,并且依赖于线粒体呼吸,该研究证明铜毒性的发生机制不同于所有其他已知的调节细胞死亡机制,包括细胞凋亡、铁死亡、焦亡和坏死性凋亡,故研究人员将这种细胞死亡方式命名为——Cuprotosis(铜死亡) 。该研究发现依赖线粒体呼吸的细胞对铜离子的敏感性比进行糖酵解的细胞高近1000倍。通过多重CRISPR基因敲除筛选,该研究确定了促进铜诱导死亡的关键基因-FDX1。铜死亡是通过铜与三羧酸 (TCA) 循环的脂酰化成分直接结合而发生的。这导致脂酰化蛋白质聚集和随后的铁硫簇蛋白质丢失,从而导致蛋白质毒性应激并最终导致细胞死亡。这些发现可以解释对铜稳态机制的需求。

铜离子载体是与铜结合的小分子,可将铜运送到细胞中,因此是研究铜毒性的有用工具。多条证据表明铜离子载体诱导细胞死亡的机制涉及细胞内铜的积累,而不是小分子伴侣本身的影响。铜诱导毒性机制不是很清楚,以往有一些研究是相互矛盾的,涉及的相关snrmqn括诱导细胞凋亡、不依赖半胱天冬酶的细胞死亡、活性氧 (ROS)诱导 或抑制泛素-蛋白酶体系统。因此,铜结合分子作为细胞死亡诱导剂的跨界功效表明它们靶向进化上保守的细胞机制,其机制尚未阐明。
为了确定铜离子载体的细胞毒性是否依赖于铜本身,该研究分析了强效铜离子载体 elesclomol 的对细胞的杀伤潜力。研究人员首先在489个细胞系中测试了1448个载铜药物对细胞的杀伤效果,结果表明载铜药物elesclomol对几乎所有的细胞系均有杀伤作用。但是,改变这些化合物的铜结合能力会导致细胞杀伤能力的丧失。
于是,研究人员以铜结合分子Elesclomol为研究对象,发现单独加入Elesclomol不影响细胞的生长,而一旦加入铜离子,细胞生长受到极大抑制。相反,加入其他金属,例如铁、钴、锌、镍等,未能增强细胞死亡,这些结果表明铜离子载体诱导的细胞死亡主要依赖于细胞内铜的积累。
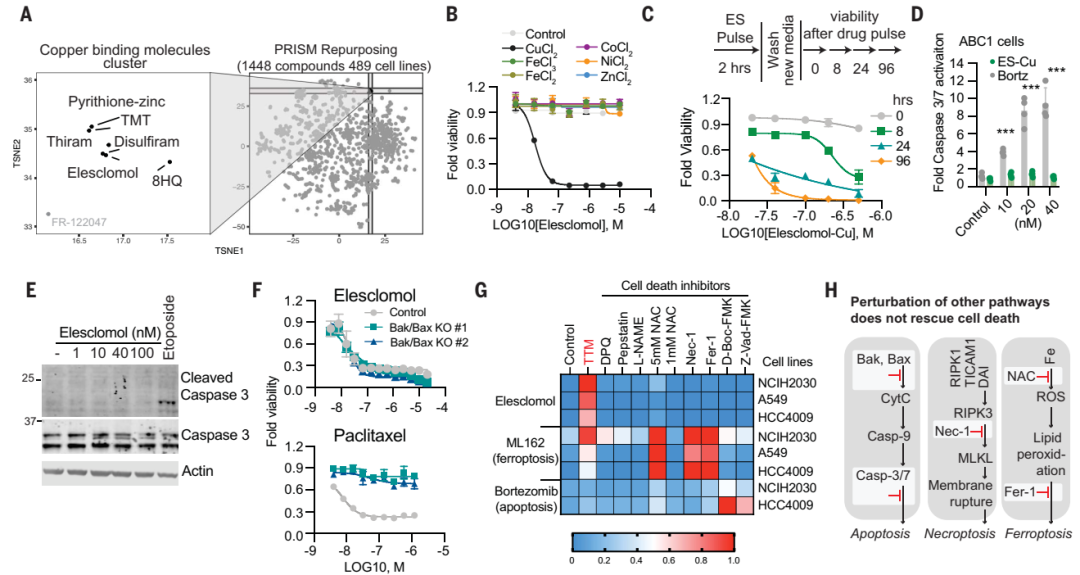
图1. 铜离子载体诱导的细胞死亡与传统死亡途径不同
为进一步验证铜对细胞的影响,研究人员使用丁硫胺酸亚砜胺(BSO,消耗细胞内铜螯合剂谷胱甘肽)联合Elesclomol处理细胞,结果同样诱导细胞死亡。而采用四硫代钼酸盐(TTM,一种铜螯合剂)联合Elesclomol处理细胞,则细胞生长不受影响。这些结果表明,铜离子载体诱导的细胞死亡主要依赖于细胞内铜的积累。更重要的是,研究人员发现铜离子载体诱导的细胞死亡是一种新的细胞死亡途径,明显区别于传统死亡方式(凋亡,铁死亡,坏死)。
研究人员观察到更依赖线粒体呼吸的细胞对铜离子的敏感性比进行糖酵解的细胞高近1000倍。如果采用药物干预线粒体功能后,细胞对铜离子的敏感性发生显著变化。通过乏氧条件培养细胞,研究人员进一步证实了铜诱导的细胞死亡需要线粒体呼吸参与,而糖酵解产生的ATP方式,对铜诱导的细胞死亡影响较小(梅斯小编:这提示肿瘤细胞似乎更耐受铜死亡?)。
进一步研究人员发现铜并不直接参与电子传输链(ETC),而只是在三羧酸(TCA)循环中发挥作用。经代谢组学研究发现,对铜敏感细胞中与TCA相关的代谢物明显更多。这些结果表明铜诱导的细胞死亡与线粒体代谢之间紧密联系,铜与TCA循环之间息息相关。

图2. 线粒体呼吸调节铜离子载体诱导的细胞死亡
影响铜离子载体关键基因FDX1
为了确定介导铜毒性的特定代谢途径,研究人员通过多重CRISPR基因敲除筛选,确定了促进铜诱导死亡的关键基因--铁氧还原蛋白1(FDX1),发现该基因编码一种Elesclomol可直接靶向的蛋白,该蛋白可将二价铜离子转化更毒的一价铜离子。FDX1基因此前还发现在肺癌,PCOS等中起重要作用。
发现敲除FDX1会减弱铜离子载体诱导的细胞死亡。此外,当细胞在糖酵解条件下生长时,大多数铜离子载体(如elesclomol、disulfiram和NSC319726)失去了杀伤活性。这些结果进一步说明铜与线粒体代谢联系十分紧密,而且与FDX1有关。
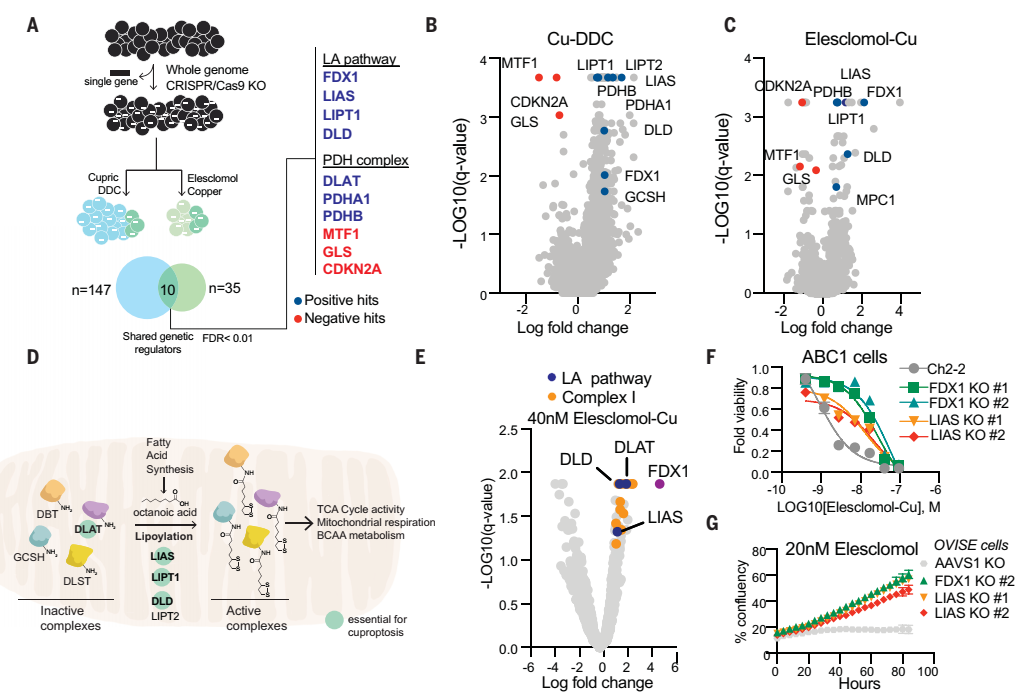
图3. FDX1是铜离子载体诱导细胞死亡的关键基因
FDX1作为蛋白质脂酰化的上游调节因子发挥作用
接下来,研究人员发现敲除FDX1或脂酰化相关酶可以使细胞免于铜毒性。因此,作者猜测FDX1可能是蛋白质脂酰化的上游调节因子。为了验证这一猜测,作者首先通过检索公共数据库,发现FDX1和硫辛酸代谢与细胞存活高度相关。其次,作者对208例人类肿瘤标本进行了FDX1和硫辛酸的免疫组织化学染色,进行了半定量分析,结果发现FDX1和脂酰化蛋白的表达高度相关。
最后,作者通过免疫印迹和免疫组织化学检测,发现FDX1基因敲除导致蛋白质脂酰化完全丧失,同时也导致细胞呼吸显著下降。这些结果均表明FDX1是蛋白质脂酰化的上游调节因子。此外,作者还发现铜干扰铁硫簇,而铁硫簇是几种关键代谢酶的一部分。当这种酶降低时,细胞更容易死亡。
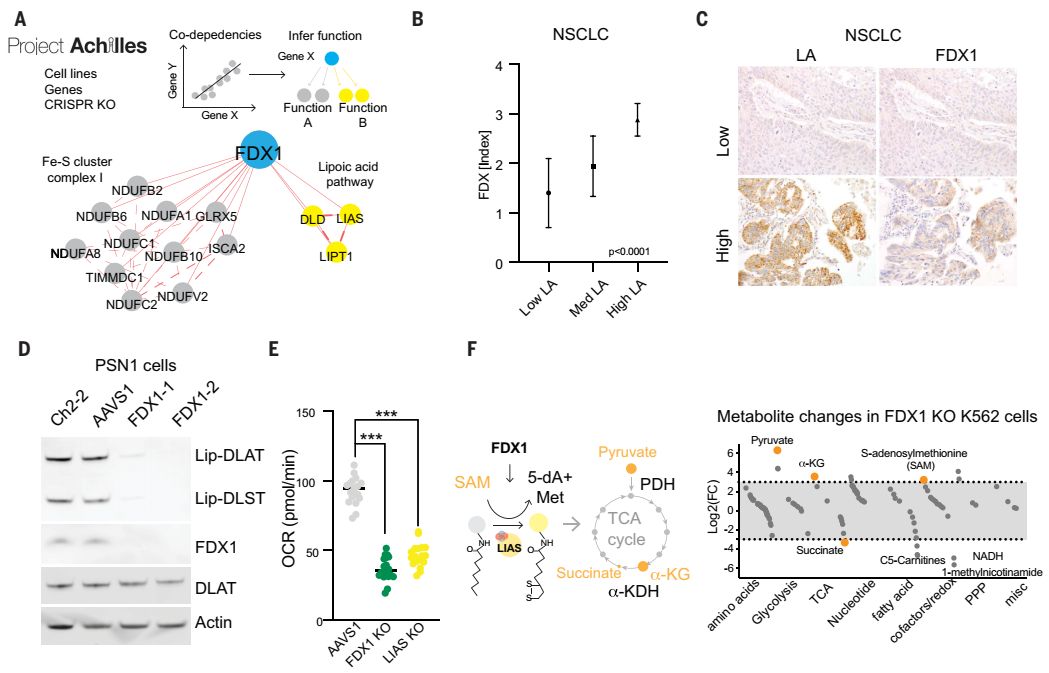
图4. FDX1是蛋白质脂酰化的上游调节因子
铜是一把双刃剑,在整个动物界,它作为酶的辅助因子是必不可少的;同时又可能诱导细胞死亡。铜稳态的遗传变异会导致危及生命的疾病。铜离子载体和铜螯合剂都被认为是抗癌剂。然而,铜超载导致细胞死亡,其中的机制尚不清楚。在此,作者证明铜诱导细胞死亡的发生机制不同于所有其他已知的调节性细胞死亡机制,包括凋亡、铁死亡、焦亡和程序性坏死。因此,研究人员将这种细胞死亡方式命名为——Cuprotosis(铜死亡) 。
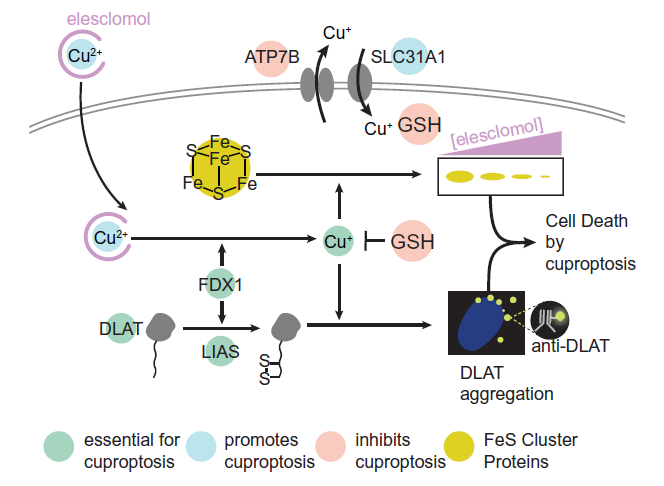
图5 铜死亡机制图
原始出处:
Peter T., et al., Copper induces cell death by targeting lipoylated TCA cycle proteins. Science 2022.DOI: 10.1126/science.abf0529 https://www.science.org/doi/10.1126/science.abf0529