美国临床肿瘤学会(ASCO)年度会议将在2021年6月4日至8日举行,国内外诸多顶级研究成果即将公布。在大会揭幕之前,已有科学人员开始宣布临床研究摘要以及报告的计划。梅斯医学将持续关注并报道学术亮点,分享给各位同道。
乳腺癌专题汇总:
ASCO 2021:摘要概览与展望21 |乳腺癌最新研究概览(HER2阳性乳腺癌专栏)
ASCO 2021:摘要概览与展望19|乳腺癌最新研究概览(三阴性乳腺癌专栏)
ASCO 2021:摘要概览与展望15 |乳腺癌最新研究概览(ER阳性乳腺癌专栏)
ASCO 2021:摘要概览与展望11 |乳腺癌最新研究概览(浸润性乳腺癌专栏)
ASCO 2021:摘要概览与展望10 |乳腺癌最新研究概览(三阴性乳腺癌专栏)
ASCO 2021 :摘要概览与展望8 | 乳腺癌最新研究概览(男性乳腺癌专栏)
1.Durvalumab可改善TNBC的长期疗效:GeparNUEVO II期随机研究的结果表明,除了基于蒽环类/紫杉烷类的新辅助化疗以外,新的辅助durvalumab用于早期三阴性乳腺癌(TNBC)
背景:
GeparNuevo试验研究了早期TNBC患者在标准新辅助化疗(NACT)中加入抗PD-L1检查点抑制剂(CPI)durvalumab的作用。Durvalumab会增加病理完全缓解(pCR)率,尤其是在开始化疗之前仅接受durvalumab治疗的患者(Loibl等人,Ann Oncol 2019)。
方法:
GeparNuevo将患有cT1b-cT4a-d肿瘤的患者随机分组,并每4周中央确认TNBC接受durvalumab(D)1.5 g iv或安慰剂治疗。前2周(窗期)给予D /安慰剂单药治疗(0.75 g iv),随后每周D /安慰剂加nab-紫杉醇125 mg /m²持续12周,然后D /安慰剂加表柔比星/环磷酰胺(EC )q2周,共4个周期。基质肿瘤浸润淋巴细胞(sTILs)将其分层(低(≤10%),中(11-59%),高(≥60%))。主要目标是pCR(ypT0 ypN0)。次要事件发生时间终点包括有创无病生存期(iDFS),远距无病生存期(DDFS)和总体生存期(OS)。
结果:
在2016年6月至2017年9月之间,总共招募了174名患者。使用durvalumab的pCR率为53.4%,而安慰剂为44.2%(OR 1.45)。Durvalumab效应仅在窗口队列中可见(OR 2.22)。中位随访42.2个月后,有174例患者发生了34例事件。pCR与非pCR的3年iDFS分别为92.0%和71.9%。接受durvalumab治疗的3年iDFS为84.9%,而接受安慰剂治疗的为76.9%(HR 0.54); 3年期DDFS为91.4%和79.5%(HR 0.37); 3年OS为95.1%和83.1%(HR 0.26)。窗口之间和窗口组之间在iDFS,DDFS和OS中均未发现差异。
结论:
尽管pCR升高小且术后无继续治疗,但在TNBC的新辅助化疗中加入Durvalumab仍可显着改善长期预后。需要质疑的是,是否需要使用CPI进行辅助治疗。
DOI:10.1200/JCO.2021.39.15_suppl.506
2.新辅助化疗(NAC)后残留三阴性乳腺癌(TNBC)患者(pts)的铂类化疗(P)与卡培他滨(C)的术后III期随机临床试验:ECOG-ACRIN EA1131
背景:
NAC完成后仍有残留浸润性疾病(RD)的TNBC患者复发风险很高,卡培他滨辅助剂(C)可降低复发风险。临床前模型支持在TNBC基础亚型中使用铂试剂(P)。EA1131检验了以下假设:在NAC辅助使用P代替C的情况下,基底亚型TNBC的患者无创生存期(iDFS)不会较差,但会有所改善(主要目的)。
方法:
新辅助紫杉烷+/-蒽环类化疗后且手术样本中RD至少为1 cm RD的临床II / III TNBC分期(1:1)随机接受P(卡铂或顺铂每3周一次,共4个周期)或C(每3周14 / 7d,共6个周期)。通过PAM50在手术标本中分析了TNBC亚型(基础型与非基础型)。假设C组的4年iDFS为67%,则选择非劣效性设计(危险度[HR]的非劣效性余量[HR]为1.154)(替代性HR为0.754)。非自卑首先被测试。如果显示出非劣势性,则将进行P相对于C优越性的正式测试。
结果:
在2015年至2020年之间,有401名参与者被随机分为P或C(招募目标为775),其中310名(77%)患有TNBC基础亚型疾病(主要分析人群)。Pts的中位年龄为52岁,白人为71%,黑人为19%。在诊断时,大多数肿瘤为高等级(78%),T2(59%),N0 47%和N1 40%。残留肿瘤为37%ypT1、44%ypT2和47%ypN0。任何毒性的总发生率相似(P占83%,C占80%),但P更为常见3级和4级毒性(无5级)(25%比15%)。在中位随访18个月后,发生了113例iDFS事件(占全部信息的58%)。P组的3年iDFS为40%(95%CI,29%-51%),C组为44%(95%CI,32%-55%)。武器P / C的HR为1.09(95%重复置信区间为0.62-1.90),并且最终拒绝自卑的可能性(即,条件功率)为6%。数据安全与监视委员会建议在2021年3月的第5次中期分析中停止该试验,因为该试验不太可能显示出P臂的劣等或劣势。
结论:
无论采用何种治疗方法,NAC后患有TNBC并发RD的参与者的3年iDFS均低于预期。现有数据表明,该研究不太可能确定P对C的非劣效性。此外,P的严重毒性更常见。在TNBC,尤其是基底亚型且RD至少1 cm的患者中NAC和高复发风险后,使用辅助P不能改善预后。现在将进行RD组织(NGS),循环标记物(ctDNA和CTC治疗前后)和患者报告结果(PRO)问卷的相关分析。
DOI:10.1200/JCO.2021.39.15_suppl.605
3.脑脊液(CSF)样本循环肿瘤DNA(ctDNA)评估对三阴性乳腺癌(TNBC)患者脑转移(BrM)的早期检测的实用性
背景:
尽管治疗有所改善,但诊断为TNBC的患者预后较差,出现BrM的可能性更高。识别高BrM风险的患者,从而能够预测谁将从适当的附加治疗中受益,仍然是一个关键问题。ctDNA代表与乳腺癌的结果和侵袭性相关的有价值的工具,但尚未鉴定出预后和预测性生物标志物来预测TNBC中BrM的发生。我们研究了评估CSF-ctDNA对早期识别TNBC中BrM风险的有用性。
方法:
在2016年1月至2020年12月期间,前瞻性纳入了323例接受新辅助疗法+手术(NACT)并具有完全缓解(CR)的新诊断非转移性TNBC患者。手术后,从所有患者中获取CSF测量ctDNA的样品:用QIAamp循环核酸试剂盒(Qiagen,Valencia,CA,美国)提取CSF-ctDNA,并测量ctDNA水平。使用Kaplan-Meier方法估算生存曲线,并将其与对数秩检验进行比较。使用多因素Cox回归来确定3年时的死亡风险。
结果:
NACT后,在126/323(39%)患者中可检测到CSF-ctDNA,在III期诊断为101/126(80%)。126名(98.4%)ctDNA +患者中有124名随后发生了BrM。相反,只有2名(2/197,1%)ctDNA患者随后发生了BrM,其他195名患者仍处于CR中(p <0.001,Fisher精确检验)。CSF-ctDNA确实与PFS和OS相关:无法检测到的ctDNA与上等PFS(HR 0.3; p = 0.002)和OS(HR 0.2; p <0.01)相关,表明存活率很大程度上取决于BrM的发作。中位随访3年,ctDNA +与ctDNA-患者的中位PFS为13个月vs未达到,p = 0.004(通过对数秩检验)。ctDNA +与ctDNA-患者的OS中位数为NACT与未达到相比有16个月,p = 0.0016(通过对数秩检验)。在多变量分析中,可检测到的CSF-ctDNA成为BrM和24个月死亡率发展的最佳预测指标(HR:3.62; p <0.0001)。年龄,分期,Ki67%和对化疗的反应与预后无关。
结论:
NACT后,可检测到的CSF-ctDNA与PFS和OS显着相关,从而识别出早期有风险的患者在TNBC中发展为BrM。
DOI:10.1200/JCO.2021.39.15_suppl.507
4.他汀类药物的使用与三阴性乳腺癌患者的临床结局之间的关系
背景:
他汀类药物已显示出靶向与乳腺癌致癌相关的途径,特别是在更具侵略性的乳腺癌亚型(例如三阴性乳腺癌(TNBC))中。鉴于他汀类药物的毒性有限,成本低廉,易于使用,他汀类药物疗法与改善乳腺癌结局之间的关联,特别是在治疗方式更有限的侵袭性乳腺癌中,可能对公共卫生产生重要影响。在这里,我们研究了I-III期乳腺癌(特别是TNBC)妇女中他汀类药物治疗与乳腺癌结局的关系。
方法:
我们利用了监测,流行病学和最终结果(SEER)-医疗保险和德克萨斯州癌症登记处(TCR)-医疗保险数据。我们纳入了从2008年至2015年被诊断为组织学确诊的I-III期乳腺癌的66岁或以上女性。我们使用多变量Cox比例风险回归模型检查了他汀类药物的使用与总体生存期(OS)和乳腺癌特定生存期(BCSS)的关联,并根据年龄,种族,教育程度,州购买,居住区,阶段,亚型,内分泌进行了调整治疗,放射线,化学疗法,手术,他汀类药物基线使用,合并症和基线高血压。对于BCSS,我们使用Fine和Gray方法计算了竞争性死亡风险。我们要求所有个体都可以生存直到诊断后的12个月,这被定义为随访期的开始。
结果:
我们确定了45063例符合入选标准的I-III期乳腺癌患者,其中22,518例(50.0%)在诊断后一年内接受了他汀类药物(使用他汀类药物的患者)。他汀类药物使用者和非使用者的5年累计乳腺癌特异性死亡累积估计分别为5.9%和6.9%(P <.001)。在整个队列中,调整后的模型显示他汀类药物的使用与BCSS改善之间存在统计学上的显着相关性(亚分布危险比[SHR]为0.82; 95%CI为0.70至0.97;P = .021),但与OS无关(危险比[HR],0.96; 95%CI,0.90至1.03;P = 0.23)。TNBC患者的BCSS(SHR,0.60; 95%CI,0.42至0.86; P = .006)和OS(HR,0.76; 95%CI,0.61至0.95; P= .018)。分阶段显示,他汀类药物在TNBC中的治疗仅限于局部疾病患者。使用倾向评分匹配模型以及将我们的分析限于乳腺癌诊断后开始的他汀类药物治疗时,我们的结果是一致的。
结论:
在非转移性乳腺癌女性中,我们发现使用他汀类药物与TNBC女性的OS和BCSS获益相关。我们的数据表明,他汀类药物可能在某些乳腺癌患者中作为辅助疗法发挥作用,并支持进一步研究,尤其是在TNBC患者中,对于这些患者,有效治疗选择更为有限。
详情参见:Association of statin use with clinical outcomes in patients with triple-negative breast cancer.
DOI:10.1200/JCO.2021.39.15_suppl.523
5.肠道微生物组成对早期三阴性乳腺癌(TNBC)的新辅助化疗(NACT)反应的影响
背景:
肠道微生物组对肿瘤生物学,进展和对免疫疗法的反应的影响已在多种癌症类型中得到证实。但是,关于肠道微生物成分对化学疗法的影响的了解还很少。先前我们已经表明,在32名患者的NACT期间,肠道微生物组保持不变。在这里,我们调查了早期TNBC人群中肠道微生物组与对NACT反应之间的关联。
方法:
纵向粪便样本收集自ARTEMIS试验(NCT02276443)中的85例新诊断的早期TNBC早期患者。所有患者均接受标准的NACT联合阿霉素/环磷酰胺(AC)治疗;使用超声评估容量变化,建议在4个AC周期后<70%容量减少(VR)的患者除标准NACT外还接受靶向治疗,以提高缓解率。我们对使用2x250 bp配对末端读取协议从85个预AC粪便样品中提取的细菌基因组DNA进行了16S测序。将经过质量过滤的序列聚类为操作分类单元,并使用Mothur方法和Silva数据库版本138进行分类。对于基于分类单元的单变量分析,在物种,属,科,类,logit转换后,使用DESeq2分析订单级别。使用phyloseq计算组类别内的α-多样性指数。微生物α多样性(样本内多样性)通过辛普森的倒数指数进行测量。使用群体之间的加权UniFrac距离测量β多样性。使用DESeq2分析评估了菌群丰度与病理完全缓解(pCR)或残留疾病(RD)之间的关联。
结果:
来自85例患者的AC前粪便样本可供分析。其中,pCR患者46例,RD患者39例。在pCR和RD组之间,α多样性(p = 0.8)或β多样性(p = 0.7)没有显着差异。但是,相对于RD患者,pCR患者的肠道微生物组富含长双歧杆菌(p = 0.03)。RD患者的肠道微生物组中富含Lachnospiraceae(p = 0.03)和Bacteroides thetaiotaomicron菌种(p = 0.02)。
结论:
我们已经证明与RD患者相比,pCR患者的肠道微生物组成存在显着差异。需要在更大的研究中进一步研究,以支持接受化学疗法(例如益生菌补充或粪便微生物群移植)的TNBC患者的肠道微生物组调控的治疗性探索。
DOI:10.1200/JCO.2021.39.15_suppl.590
6.按临床亚型分类的乳腺癌局部复发后的生存率
背景:
我们试图探讨局部复发(LRR)对现代治疗的不列颠哥伦比亚省乳腺癌(BC)患者生存率的影响。
方法:
一项回顾性队列研究设计确定了自04 / 2005-12 / 2013年起被诊断患有I-III BC期的患者,这些患者接受了手术治疗并随后发生了LRR。排除是LRR,双侧既往/同步BC和其他浸润性癌症在120天内死亡或远处转移。LRR后,检查了总生存期(OS)和与OS相关的因素,包括临床亚型和辅助治疗(AdTx)。我们将临床亚型定义为:Luminal(Lum)A-雌激素受体(ER)和孕激素受体(PR)阳性,HER2阴性以及1或2级。Bum-Bum为A级但为3级,或为Aum级,但仅是ER或PR阳性之一;三阴性(TNBC)-ER,PR和HER2阴性; 和HER2阳性(使用任何ER,PR)。在没有较早的LRR的情况下,我们将足够的AdTx定义为:(a)TNBC:> = 50%的计划化疗(Chx)。
结果:
最终队列中有492例患者,从LRR到诊断的中位随访时间分别为7.2年和11.8年。LRR在本地占69.3%(n = 341),在区域+/-本地占30.7%(n = 151)。与仅局部性相比,区域性复发与较高的T和N分期,分级和Lum状态相关(p <= 0.01)。在LRR处重新评估了82%的生物标志物,在32%的受试者中,其初始诊断发生了变化:ER表达增加3.8%,损失6.1%;PR表达增加9.1%,损失15.1%;HER2过表达增加了3.7%,减少了4.8%。超过一半的患者(n = 255,52%)没有通过选择或推荐接受足够的AdTx。AdTx不足,局部复发与区域复发的比例相似。从第一次LRR死亡的时间在局部复发与区域复发之间(中位数2.7年)没有显着差异。
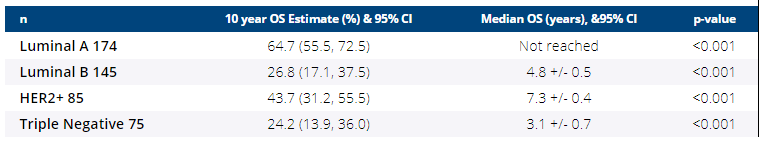 按临床亚型划分的总生存率(OS)(从第一次局部复发之日起)
按临床亚型划分的总生存率(OS)(从第一次局部复发之日起)
结论:
我们的数据提供了现代辅助治疗时代LRR后OS发生率。LRR后的OS因临床亚型而异,其中TNBC表现最差,而Lum A表现最好。超过一半的用户没有收到足够的AdTx。尽管有类似的治疗选择,但Lum A的LRR后OS明显长于B亚型,这强调了需要针对生物学的疗法。在所有其他亚型中,OS均较低,强调了避免LRR的重要性。
详情参见:Survival following locoregional recurrence in breast cancer by clinical subtype.
DOI:10.1200/JCO.2021.39.15_suppl.543
7.对多柔比星和环磷酰胺(AC)临床反应不理想的三阴性乳腺癌(TNBC)患者(pts)进行新辅助阿特唑单抗(atezo)和纳布-紫杉醇(nab-p)
背景:
新辅助抗PD-(L)1疗法可改善未选择的TNBC的病理完全缓解(pCR)率。但是,考虑到免疫相关不良事件(irAE)可能导致长期发病的可能性,重要的是要优化在新型新辅助治疗中使用这些新型药物的风险获益比。超声检查对新辅助疗法(NAT)的临床反应欠佳与pCR发生率低有关(2-5%,GeparTrio和Aberdeen试验)。在这里,我们报告了对TNBC的pts进行atezo和nab-p作为NAT第二阶段的单臂II期研究的结果,对AC的临床反应欠佳(NCT02530489)。
方法:
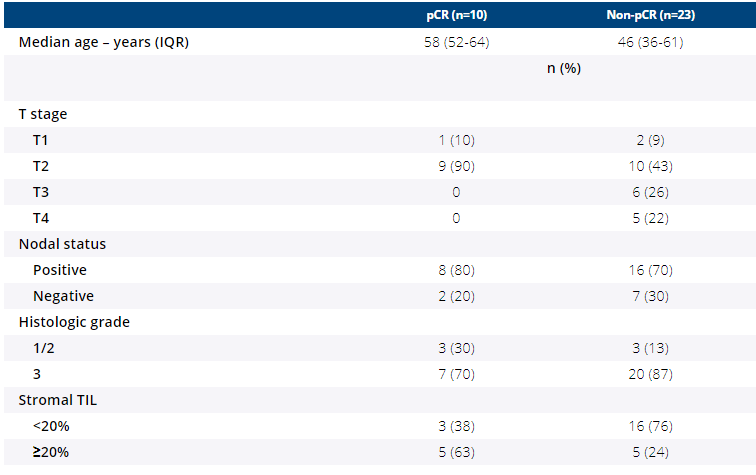
符合I-III期TNBC的患者对阿霉素和环磷酰胺(AC)的4个周期表现出次佳反应,这些疾病定义为疾病进展或超声检查表明肿瘤体积缩小了80%以下。Pts在接受手术之前接受了atezo(1200mg IV,Q3周x 4)和nab-p(100mg / m2 IV,Q1周,x 12)作为NAT的第二阶段,随后接受了佐剂的atezo(1200mg IV,Q3周,x 4) 4个周期)。这项单臂,两阶段的Gehan型研究旨在检测pCR从5%改善到20%,以便认为该方案值得在大型,随机,II / III期试验中进一步研究。成功的定义是,在37例患者中有8例中的pCR。在一部分患者中,有足够的基线肿瘤组织可用于基质TIL评估(n = 29)。
结果:
从2 / 2016-12 / 2020开始,共招募了34分。在完成NAT的33位患者中,pCR率为30%(10 / 33,95%CI:16-49%),pCR / RCB-1率为42%(14 / 33,95%CI:25) -61%)。下表描述了临床病理特征。≥20%的患者发生的与治疗相关的不良事件(所有级别)包括疲劳(73%),贫血(55%),周围感觉神经病(55%),中性粒细胞减少症(48%),皮疹(42%),ALT升高(39%),AST升高(33%),恶心(30%),厌食(24%),腹泻(21%),肌痛(21%)。因irAEs引起的阿替佐停服发生在4分(12%,肾炎[n = 2];肾上腺功能不全[n = 1];肝炎[n = 1]);这些患者中有2位患有pCR。
结论:
这项研究达到了其主要终点,证明了在该高危pt人群中有希望的活动信号(pCR = 30%,历史对照组为5%)。由于irAEs导致的12%停用率证实了对仅对高危疾病患者无AC反应的免疫治疗策略的进一步评估值得进一步研究。探索性的基因组和免疫学相关研究正在进行中。
DOI:10.1200/JCO.2021.39.15_suppl.592
8.talimogene laherparepvec(TVEC)联合新辅助化疗治疗非转移性三阴性乳腺癌的2期试验
背景:
TVEC是一种改良的溶瘤性单纯疱疹1(HSV1)病毒,目前已被FDA批准用于治疗不可切除的皮肤和淋巴结黑色素瘤。TVEC被设计为优先于正常组织裂解肿瘤细胞以释放肿瘤相关抗原,产生GM-CSF以激活树突状细胞,并刺激T细胞浸润肿瘤(TIL)。乳腺癌中的TIL与对新辅助化疗(NAC)的较好反应相关,因此我们假设肿瘤内TVEC可以增强对NAC的反应。我们报告了在2-3 TNBC阶段将NAC与TVEC结合的2期试验的结果。
方法:
阶段II-III TNBC PTS(N = 37)将被注册到单个臂,最佳西蒙2阶段2期试验以TVEC(10 ^ 6 PFU 1 ST然后剂量10 ^ 8 PFU×4个剂量)周1,4-术前静脉给予2,6,8,10 +每周紫杉醇(80mg / m2)x 12,然后静脉给予q2周剂量密集AC(阿霉素/环磷酰胺60/600 mg / m2)x 4。主要终点指标为残留癌症负担0率(RCB0)。假设p1 = 45%vs. p0 = 30%,且单面I型错误率为0.10,功效为70%,则试验满足了37个可评估点中≥15RCB0响应的主要终点。
结果:
在Moffitt(5/2018 – 4/2020)入选了40分患者,其安全性评估为3分,由于治疗不彻底,其有效性未评估。研究人口统计学:中位年龄49岁(27-66岁),白人67.5%,黑人10%,西班牙裔15%,临床II期83%和III 17%,淋巴结+ 42%。RCB0比率= 16/37(43%,95%CI 27-61%)和另外9点RCB-1(RCB0 / 1比率68%,95%CI 50-82%)。毒性与预期的NAC毒性无显着差异,只是短暂的G1-2发烧,发冷,注射部位疼痛增加。4名患者发生G2-3血栓栓塞事件(10%),略高于NAC预期的6%。
结论:
在NAC中添加TVEC可以增加RCB0的发生率,并具有可控的毒性,因此有必要在TNBC中进行进一步的研究。免疫相关性和更新的生存数据将在会议上介绍。
DOI:10.1200/JCO.2021.39.15_suppl.578
9.自我认同为非洲裔美国人(AA)或非非洲裔美国人(NonAA)的三阴性乳腺癌(TNBC)患者的肿瘤免疫微环境的特征分析
背景:
与NonAA患者相比,非洲裔美国人(AA)中三阴性乳腺癌(TNBC)的发生率更高和预后更差的肿瘤生物学差异(如果有)是未知的。我们假设肿瘤免疫微环境的差异可能会导致结果差异。这项研究的目的是表征和比较自认为NonAA或AA的患者之间TNBC的免疫微环境。
方法:
在进行任何全身性治疗之前,先收集福尔马林固定石蜡包埋的手术切除的癌和成对的正常组织,并收集2000- 2017。根据临床阶段,诊断年龄和诊断年份对这两个队列进行匹配。我们进行了体细胞和种系全外显子组测序(WES),大量RNA测序以及免疫组织化学,以评估PD-L1表达(SP142)。在H&E玻片上评估基质基质浸润淋巴细胞(sTIL)。在基因和途径水平上比较了突变负荷,突变频率和基因表达差异。免疫细胞组成是通过基因表达反褶积分析(TIDE)估算的。
结果:
两个队列之间的肿瘤突变负担相似。在基因水平上,很少有基因具有显着不同的体细胞突变频率,或AA和NonAA样品之间的差异mRNA表达。途径水平的改变显示,AA样品中的体细胞突变对炎症,免疫力(适应性;先天性),抗原呈递和同种异体移植排斥途径的影响更大。受影响的基因因癌症而异,并且没有复发,因此在基因水平分析中被遗漏了。基因集富集和共表达分析还显示,AA样品中较高的免疫相关途径表达。无监督的共表达聚类分析证实了AA患者中涉及免疫,炎症和细胞因子/趋化因子信号传导的基因协同过表达。两个免疫疗法反应的预测特征,免疫样品发炎,AA样品中的IFNG以及sTILs评分和PD-L1阳性率也更高。这些发现增加了免疫检查点抑制剂可能在AA患者中特别有效的可能性。在NonAA样本中,EMT过渡,血管生成,脂肪生成,肌生成,脂肪酸代谢,TGFβ信号传导,紫外线反应和缺氧途径被过度表达。TIDE分析表明,NonAA样品中的TAM M2,总体TIDE得分和免疫排斥得分较高。紫外线反应和缺氧途径均过表达。TIDE分析表明,NonAA样品中的TAM M2,总体TIDE得分和免疫排斥得分较高。紫外线反应和缺氧途径均过表达。TIDE分析表明,NonAA样品中的TAM M2,总体TIDE得分和免疫排斥得分较高。
结论:
与NonAA患者相比,AA患者中的TNBC更经常在与免疫功能有关的基因中出现体细胞突变,并过表达免疫和炎症基因。
DOI:10.1200/JCO.2021.39.15_suppl.564
10.预测早期三阴性乳腺癌中甲状腺卡培他滨维持治疗的益处:SYSUCC-001研究的结果
背景:
最近的临床试验和荟萃分析表明,在早期三重阴性乳腺癌(TNBC)的标准化疗中加入卡培他滨的益处。我们旨在开发一个个性化的预测模型,以量化TNBC中维持节律性卡培他滨的临床获益。
方法:
汇总来自SYSUCC-001试验的患者,随机分为接受或不接受节律性卡培他滨维持治疗的标准治疗。候选协变量包括年龄,肿瘤大小,淋巴结,组织学等级,Ki-67百分比,淋巴管浸润,化疗方案和卡培他滨用药。主要终点是无病生存期(DFS)。连续协变量的非线性效应通过受限三次样条曲线建模。我们使用Cox比例风险模型开发了生存预测模型。
结果:
总共招募了434名患者(发展队列中的306名和验证队列中的128名)。在开发队列和验证队列中,估计的5年DFS分别为77.8%(95%CI,72.9-82.7%)和78.2%(95%CI,70.9-85.5%)。年龄和淋巴结对DFS有明显的非线性影响。在最终预测模型中,与DFS显着相关的四个协变量是年龄,淋巴结,淋巴管浸润和卡培他滨用药。该模型在开发队列和验证队列中分别具有0.722(95%CI,0.662-0.781)和0.764(95%CI,0.668-0.859)的C指数表现出合适的校准和公平判别能力。我们基于该模型设计了一个易于使用的在线计算器,能够预测卡培他滨的维护效益。
结论:
基于证据的预测模型可以识别出那些最需要维持节律性卡培他滨治疗的患者,从而有助于在日常临床实践中做出治疗决策。
DOI:10.1200/JCO.2021.39.15_suppl.521
这是一条正在持续更新中的专栏,请注意保存收藏此专栏~
更多内容关注梅斯医学ASCO专题页:https://meeting.medsci.cn/ASCO2020
参考来源:https://meetinglibrary.asco.org/results?meetingView=2021%20ASCO%20Annual%20Meeting