三阴性乳腺癌(TNBC)具有较高的分子异质性和转移潜力,预后效果较差。因针对TNBC的治疗方式有限,放射(IR)治疗仍是淋巴结或脑转移患者的常见选择。因此,迫切需要制定策略来增强TNBC肿瘤对低剂量IR的敏感性。
2022年12月23日,中国科学院,昆明医科大学及北京大学等多单位合作,陈策实、蒋德伟及智旭共同通讯在Advanced Science 在线发表题为“RNF126-Mediated MRE11 Ubiquitination Activates the DNA Damage Response and Confers Resistance of Triple-Negative Breast Cancer to Radiotherapy”的研究论文,该研究报道了E3泛素连接酶RNF 126对IR诱导的ATR-CHK1途径激活以增强DNA损伤修复(DDR)的重要作用。
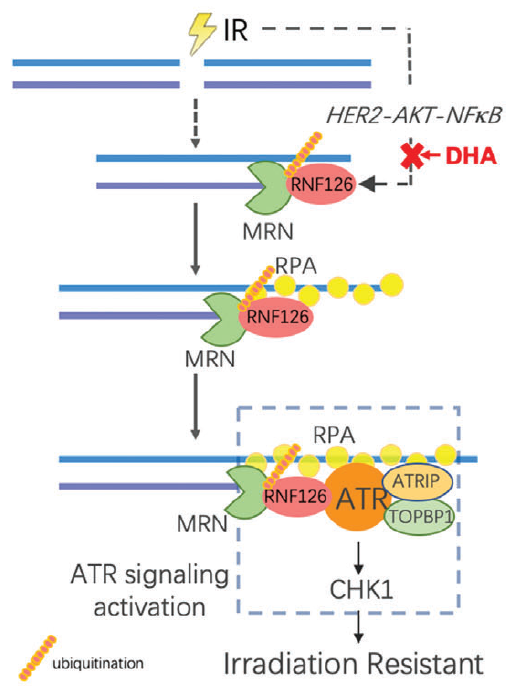
在机制上,RNF126与MRE11-RAD50-NBS1(MRN)复合物物理结合,并在K339和K480处使MRE11泛素化以增加其DNA核酸外切酶活性,随后的RPA结合和ATR磷酸化以同源重组修复的方式持续促进DDR。因此,RNF126的缺失导致TNBC细胞和小鼠的基因组不稳定性和放射敏感性增加。此外,研究发现IR激活HER2-AKT-NF-κB通路来诱导RNF126表达,双氢青蒿素靶向RNF126表达显著提高了脑部TNBC肿瘤对体内IR治疗的敏感性。总之,上述结果表明RNF126介导的MRE11泛素化是DDR的关键调节因子,为提高TNBC的放疗敏感性提供了希望靶点。
乳腺癌已成为全球癌症发病的主要原因,2020年大多数国家女性中乳腺癌的发病率和死亡率最高。三阴性乳腺癌(TNBC)占乳腺癌发病率的15%-20%,缺乏雌激素受体(ERα)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,增殖、复发和转移率较高,因缺乏有效靶向药物预后效果相对较差。放射(IR)治疗是TNBC的主要治疗策略之一,已被确定能够改善乳腺癌患者的局部区域控制,对高危患者的长期生存产生积极影响。然而,IR也不可避免地对患者的正常组织造成损害。近年来,通过提高敏感性、降低毒性、增加便捷性且降低成本来实现最佳放疗效果的治疗策略受到广泛关注。
正常细胞和癌细胞都具有复杂的信号网络来克服基因组不稳定性的威胁,即DNA损伤修复(DDR)系统。在大多数癌症中,一种或多种DDR途径或能力的丧失会增大其它途径的被依赖性,为通过靶向DDR提高IR敏感性提供了可能。IR主要通过诱导DNA损伤,特别是DNA双链断裂(DSB)导致细胞死亡。修复真核细胞中的DSB有两种不同的途径:同源重组(HR)修复利用同源DNA作为模板,以高保真的方式完成受损或缺失DNA序列的修复;非同源端接(NHEJ)修复直接连接DSB的末端,无需模板,虽使用更广泛但容易出错。这些不同途径之间的平衡对正确修复DSB至关重要。然而,HR和NHEJ的选择机制尚不清晰。
MRN复合物对于维持基因组稳定性和支持正常细胞功能极其重要。MRN复合体由MRE11、RAD50和NBS1组成,其中二聚体MRE11形成复合物的核心。
MRE11具有dsDNA 3’-5’核酸外切酶活性和ssDNA核酸内切酶活性,可进行DSB末端切除术和3’端突出生成。在DNA损伤和修复过程中,MRN复合物通过激活ATM信号被募集到DSB位点,这对于响应IR诱导DNA损伤时ATR的募集和激活也是必需的。
文章模式图(摘自Advanced Science )
RNF126属于E3泛素连接酶的RING型家族,在多种生物过程中起关键作用,包括DNA损伤和修复、癌症发展、细胞质蛋白质质量控制和细胞内蛋白分选。
RNF126与DDR有关,其直接与转录因子E2F1相互作用,促进BRCA1的转录激活。RNF126的抑制增加了细胞对PARP(聚ADP-核糖聚合酶)抑制剂的敏感性。此外,RNF126优先泛素化Ku80蛋白,从受损的DNA双链中释放Ku70/80并使其降解,有利于NHEJ修复的完成。
Lee等人[1]报道RNF126是DNA损伤反应的负调节因子。在IR诱导的DNA损伤形成过程中,RNF8和RNF168之间的RNF126功能抑制RNF168介导的H2A中K13/15的单泛素化,从而损害NHEJ修复。在紫外线损伤的情况下,研究表明RNF126以依赖于RNF8的方式被募集到DSB,并且泛素化RNF168抑制RNF168介导的γH2AX泛素化和下游DDR因子的募集。然而,RNF126在DDR中的作用仍然存在争议,其在体内的功能在很大程度上仍然未知。如果RNF126同时参与HR和NHEJ,那么当DSB发生时,RNF126如何平衡两种修复模式?RNF126如何响应IR进行调节?可以在药理学上靶向RNF126来提高TNBC的红外敏感性吗?
该研究构建了一个RNF126敲除(KO)小鼠模型,并证明了RNF126在IR处理后促进小鼠存活。实验发现RNF126是IR诱导的DDR激活的调节因子之一,通过泛素化和激活MRE11来促进RPA-ATR-CHK1信号级联。值得注意的是,研究发现双氢青蒿素通过破坏HER2-AKT-NF-κB信号传导来抑制IR诱导的RNF126表达,并提高IR治疗对脑TNBC肿瘤的疗效。临床上,RNF126的高表达与TNBC患者的预后不良有关。上述研究结果为提高TNBC对IR治疗的敏感性提供了有希望的靶点。
昆明动物研究所陈策实研究员、蒋德伟研究员和北京大学第三医院智旭副研究员为该论文的共同通讯作者。昆明动物研究所博士生刘文婧是该研究的第一作者。论文的完成得到了天津医科大学石磊和张锴教授的技术支持。该工作得到了国家重点研发计划、国家自然科学基金、云南省应用基础研究计划的资助。
参考文献:
[1] N. S. Lee, H. R. Chang, S. Kim, J. H. Ji, J. Lee, H. J. Lee, Y. Seo, M. Kang, J. S. Han, K. Myung, Y. Kim, H. Kim, J. Biol. Chem. 2018, 293, 588.
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202203884
来源:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言