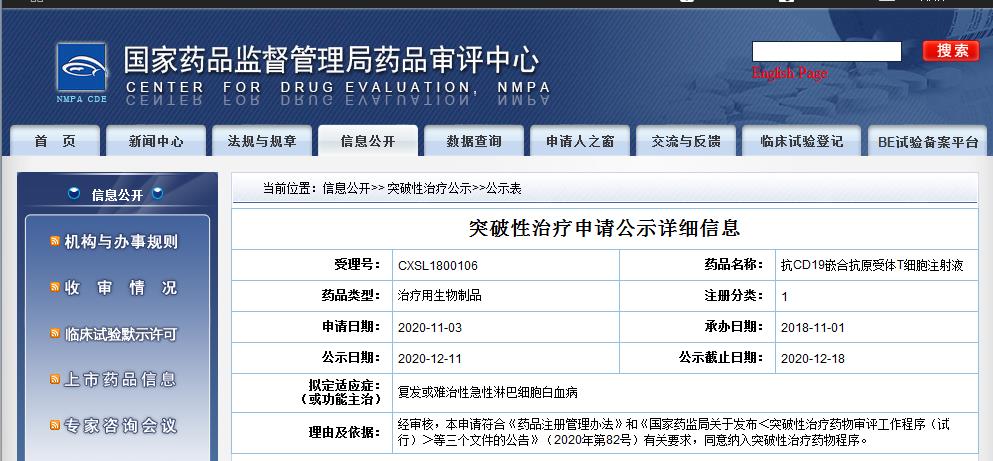
据国家药监局药审中心官网信息显示,合源生物CAR-T细胞治疗产品CNCT19细胞注射液(抗CD19嵌合抗原受体T细胞注射液)获准纳入“突破性治疗药物”(CDE受理号:CXSL1800106),拟适应症为为复发或难治性急性淋巴细胞白血病。
据了解,目前针对成人复发或难治性急性淋巴细胞白血病适应症,在全球范围内尚未有CAR-T产品获批,此前已获批上市的三款CAR-T疗法,Kymriah用于用于治疗25岁以下、难治性或两次或多次复发的B细胞前体急性淋巴细胞白血病(ALL)患者、25岁及以下病情难治或移植后复发或两次及以上复发的B细胞急性淋巴细胞白血病(B-ALL)患者,以及成年两次或多次全身治疗后复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的患者。Yescarta则获批用于治疗成年特定类型大B细胞淋巴瘤患者。2018年8月,欧盟批准Yescarta上市,用于治疗成年两次或以上系统性治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)和原发性纵隔大B细胞淋巴瘤(PMBCL)的患者,今年获批的Tecartus用于治疗复发性或难治性套细胞淋巴瘤(MCL)的成年患者。
CNCT19细胞注射液是合源生物具有自主知识产权的靶向CD19的CAR-T细胞治疗产品,源自中国医学科学院血液病医院(中国医学科学院血液学研究所),2019年11月29日,CNCT19细胞注射液获得国家药品监督管理局两项新药临床试验许可,分别为治疗复发或难治性急性淋巴细胞白血病的临床试验(受理号:CXSL1800106)和治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤的临床试验(受理号:CXSL1800107),目前,两项临床试验均率先进入注册临床II期阶段,根据合源生物产品管线进展,目前,该两项试验均已完成二期临床研究。
据前期临床研究数据显示,CNCT19细胞注射液在治疗成人复发或难治性急性淋巴细胞白血病中展现优异疗效和安全性,完全缓解率超过90%,目前最长生存已逾3年,此前,合源生物预测该产品或将2022年投放市场。
另悉,2019年6月,美国CASI公司与合源生物签署许可协议,获得CNCT19项目全球独家商业权益。
截止目前,除了CNCT19,还包括传奇生物的LCAR-B38M、药明巨诺的JWCAR029、科济生物的CT053等CAR-T疗法均被纳入突破性治疗品种。