截至今年2月27日,国内现有249项与2019新型冠状病毒相关的临床试验进行了登记注册。临床试验数量之多引发了业内一些专家的存疑和担忧,指出不能因为疫情紧迫而一味求快,规范、安全、伦理一个都不能少。与此同时,也有专家提出,许多患者尤其是重症患者正在急迫地等待救治,如用牺牲速度的方式来保证原则,可能会让那些重症患者错过最佳治疗机会。临床试验设计应寻求效率兼顾质量的最优解。

嵇元教授从复旦大学数学系本科毕业,在美国威斯康星大学获得统计学博士。他在美国MD Anderson 癌症中心9年期间担任助理教授和副教授,终身教授。目前他是美国芝加哥大学生物统计学教授,终身教授。嵇元教授的科研专注于创新和可转化的计算和统计方法。他是美国国立健康局资助的PI,主持和参与超过1000万美元的NIH科研项目。他发表了超过120篇学术论文,包括在Nature, Nature Methods, JCO, JNCI, JASA, Radiology,Biometrics,这些跨医学和统计学的各类杂志上。他是一期贝叶斯自适应性临床试验设计方法mTPI和mTPI-2的创造人。两个方法已经在国际上被普遍应用, 包括发表在Lancet Oncology, JAMA Oncology,和JCO等顶级杂志上的临床试验。在2015年美国多个媒体报道了他在肿瘤组学方面的工作。他发表在Nature Methods 上的TCGA-Assembler 已经被下载超过10000次。他研发的SCUBA亚组分析方法被哈佛精准临床试验创新挑战纳入前十名的创新方法。他同时还是LAIYA(雷亚)咨询的创始人。雷亚专注于贝叶斯自适应性试验设计方案,包括给免疫肿瘤治疗的临床开发。
为什么注册临床试验RCT要有对照、随机和遮盲这三个标准?大部分注册临床都采用随机对照临床试验(RCT),对照、随机和遮盲是三个金标准,都是必须应用的。因为它们的使用,通过临床试验我们可以建立新药和疗效之间的因果关系,并且客观地回答新药是否有效或者是否比对照组有更高的疗效这个临床试验的关键问题。
对照的作用是使得新药的疗效可以和现有的方法做比较,使得最终我们可以了解新药是否对患者比已有治疗方法有更好的疗效。
随机的作用是去除已知和未知的混杂因素(confounders)对临床试验结果的影响,使得最终可以建立药效的因果关系(causal relationship),而不是相关关系(correlation)。
遮盲,尤其是双盲的作用是为了消除患者(受试者)和研究人员的主观偏向造成的影响。减少最终的试验结果的主观性和偶然性。
在现代医学历史中,随机对照双盲试验极大地提高了对新药和新的医疗器械在人体上是否有疗效的准确判断,避免了由于主观臆断,非随机的医学数据的误导,和各种混杂因素带来的偏差(例如选择性偏差)对最终疗效判断的错误结论。可以说,由于有了这三个准则,使得人类可以准确客观的判断新药的疗效,极大地提高了现代药物研发的可靠性。
那么,标准的RCT是否应该作为新冠病毒药物临床试验的唯一选择?我的理解是不应该是唯一选择。新冠病毒的传播由于是季节性的,而且可能持续时间较短,可能不超过几个月,导致了治疗药物临床研发需有out-of-box的想法。这里的“box”指的是临床试验的金标准,对照、随机、遮盲。我接下去先从五个方面简单地阐述对于新冠病毒临床试验的一些考量,然后提出适应性,尤其是贝叶斯适应性设计的对于新冠病毒临床试验的可行性。
1)试验速度。传统的RCT一般耗时耗力。在设计和执行上要达到对照、随机和双盲都需要消耗不少准备和执行的时间。目前最快的新冠病毒RCT原计划也要到4月底才能完成。这在新冠病毒强季节性的背景下显然是有所风险的。风险在于可能试验做完了,疫情也基本结束了。
2)后勤保障。由于中国绝大部分患者都在湖北武汉和周边地区,中国的新冠临床试验应该都是在武汉和周边的医院展开。这样可以提高入组的速度和效率。但是,由于武汉周边的患者数目和需求巨大,医疗资源和人员严重不足,会使得RCT所需要的后勤保障任务艰巨。可以想象医护人员在超负荷、高风险的环境下要同时应对大量的患者,要保证双盲、随机、对照的正确实施会有挑战。
3)试验人群。目前全球没有有效治疗新冠肺炎的药物。但是大部分的新冠病毒患者都能够在没有有效药物治疗的前提下自行康复。少部分患者会产生严重症状,甚至死亡。所以新药研发可以考虑对于重症患者和轻症患者区别对待。对于类似Remdesivir这样的抗病毒药物,可以考虑入组有严重或者比较严重的症状的患者。对于一些没有既往数据或者机制不明确的治疗方法,可以尝试在轻症患者上研发。当然,不论是哪一种药物,哪一类人群,治疗安全性都是要有保障。这是伦理和监管部门需要管控的主要方向。
4)试验终点的选择。目前在clinicaltrials.gov 上面注册的新冠病毒临床试验,很多都采用了time-to-clinical-improvement (TTCI)的生存时间作为终点。这里的clinical improvement 是根据有序(ordered )的临床症状评分。有些是5分的系统,有些是7分的系统。满分代表死亡,0分代表康复。分数越高症状越严重。对于情况比较严重的患者,有效的药物应该可以至少延缓症状变重的时间。这个就像在癌症临床研究中使用PFS 和 OS作为终点是一个道理。这样的终点对于重症患者是非常合理的。而且由于大部分患者的症状都会在比较短的时间里面得到变化,不管是恶化还是好转,选择TTCI 不会延长试验的时间。
5)统计方法和设计。这是我们重点要讨论的问题。根据我们前面的阐述,传统的注册临床RCT依据对照、随机、双盲的原则,统计提供样本量和中期分析的设计,严格控制一类和二类统计错误。那么根据1-4的讨论,是不是RCT 是唯一选择呢?
我们接着第5)条继续讨论。
新冠病毒有高度季节性,可能在2-3个月消退。同时,短期内新冠肺炎的重症患者无药可救,有未被满足的临床需求(unmet medical needs)。这些特殊的背景使得采用一些加速研发的试验设计成为可能。比如加速审批(Accelerated Approval),见图一。这些方法使用单臂试验,通过对历史对照和真实世界临床数据的比较,在药物疗效显著的前提下加速审批。这些可能的研发路径在特殊的场景下都已经得到实际的验证,例如在中国和美国的免疫肿瘤药物研发,像PD-1抑制剂的研发和审批。
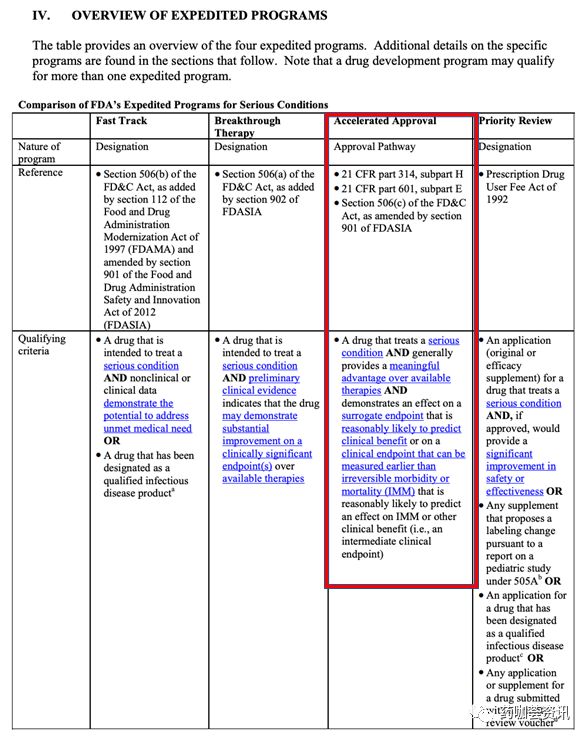
图1 美国药监局加速审批路径。来自美国FDA Guidance forIndustry Expedited Programs for Serious Conditions – Drugs and Biologics.
对于新冠病毒的治疗药物瑞德西韦(Remdesivir),如果考虑在重症患者中的试验,使用替代终点,如14天之内的临床缓解率,可以尝试使用单臂贝叶斯适应性设计(图2)。这里缓解的终点可以定义为临床症状评分不增加,或者降低1分以上。这个设计能够充分利用在中国已有的重症患者临床数据,形成历史对照。利用实时监控的手段争取提早结束临床试验,赢得时间。这个设计需要有历史的临床数据作为支持,数据越大越准确就越能够提高试验的效率。试验本身只有单臂入组,患者均接受Remdesivir的治疗。由于这个药物此前已经做过人体试验,其剂量和给药方案都非常明确,并且安全性有保障。这些先天优势都给单臂的临床试验设计做了铺垫。试验终点可以通过提高缓解率的后验贝叶斯分析实时监控,在满足足够的后验显著性下提前终止试验,有条件批准Remedesivir上市。反过来,如果实时监控发现药物有更好疗效的后验可能性很小,就提前终止试验。宣布无效。让其他的药物可以获得患者资源进行研发。这个单臂的试验设计虽然绕过了随机、对照和遮盲的准则,但仍然可以保持一定的科学严谨性。比如,在做获批的时候,可以要求药物的疗效要达到极大的统计可靠性。而且疗效要明显,有足够的数据支持。这些都可以通过贝叶斯的统计推断做出。由于不需要有对照、随机和双盲,入组和试验的速度会大大提高,并且对一线的医护人员也不会加大更多的负担。由于有大量的患者有需求,入组方面也会比较顺利。中期分析可以实时的通过图二右侧的类似表格进行。操作方便。
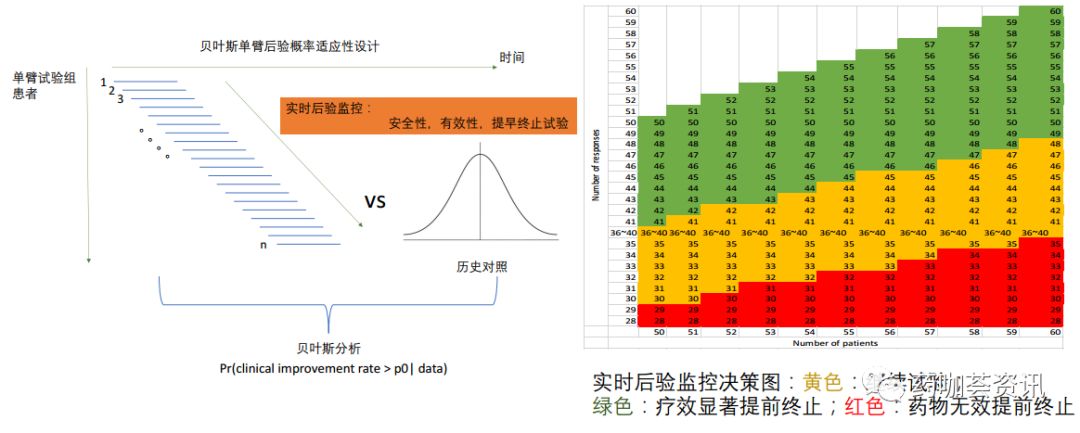
图2 贝叶斯单臂适应性设计。左图为设计示意图。单臂入组,通过历史对照实现统计分析。全程实时监控。通过后验分布分析安全性和有效性,允许提早终止试验。右图为有效性实时监控的示范表格
讨论和总结
我们看到在clinicaltrials.gov 上最新的美国新冠病毒Remdesivir的临床试验(NCT04280705)也采用了适应性设计。虽然该试验采用了双盲、对照、随机的传统RCT方法,但是设计中采用了通过中期分析提早终止试验的方案,并且更加灵活的使用了主方案(master protocol)的想法,允许不同的治疗药物实时的进入和退出试验。也就是说,虽然目前该临床试验的药物是Remdesivir,但是该试验允许今后新型治疗药物进入该试验,而不需要重新启动一个新的临床。这种主方案的设计理念很值得中国的临床研究学习。当然,由于我们国家疫情很严峻,患者众多,我国的临床试验可以考虑更加灵活的单臂贝叶斯设计方法,来加速药物的研发。目前由中日友好医院牵头的Remdesivir 试验(NCT04257656)也考虑了中期分析,使得试验有机会提前终止。否则按照预期在4月底5月初才有结果可能和疫情的发展会有脱节。也就是说即便到时候试验成功,可能疫情已经收尾,为时已晚。
作为总结,我对新冠病毒的药物研发,尤其是重症患者的治疗性药物的临床试验设计做了一些out-of-box的讨论。希望能够对今后的工作有所启发。祝患者早日康复,疫情尽早结束!