弥漫性软脑膜胶质神经元肿瘤是2016年世界卫生组织(WHO)中枢神经系统肿瘤分类第4版修订版中新增的病理类型,是以广泛软脑膜生长为主的少见的胶质神经元肿瘤,大部分呈低度恶性,部分出现间变特征。肿瘤细胞由少突胶质细胞构成并伴神经元分化,同时缺乏异柠檬酸脱氢酶(IDH)基因突变,伴BRAF KIAA1549基因融合以及单独1p缺失或1p/19q共缺失。此类肿瘤预后多样,大部分生长缓慢伴继发性脑积水,部分呈侵袭性生物学行为。由于
临床少见、
组织学形态极易与其他中枢神经系统肿瘤或炎症性病变相混淆,目前国内尚未见诸报道。本研究报道1例弥漫性软脑膜胶质神经元肿瘤患儿的
诊断与治疗经过,总结其
临床病理学特点并结合相关文献,以期提高对该病的
诊断与鉴别诊断能力。
患儿男性,5岁9个月,因脑积水1.50个月,反复抽搐发作2次,于2015年11月25日入院。患儿于1.50个月前无明显诱因突发睡眠中意识障碍和抽搐发作,表现为双眼凝视、牙关紧闭、四肢屈曲抖动,呼之不应,意识障碍,大小便失禁,持续数分钟后自行缓解,意识逐渐恢复,无发热、呕吐、腹泻、头晕、头痛。外院头部CT检查(2015年10月8日)显示,双侧侧脑室、第三脑室明显增宽,考虑重度脑积水。腰椎穿刺脑脊液检查仅蛋白定量轻度升高(具体数据不详),抗酸杆菌和隐球菌涂片阴性。
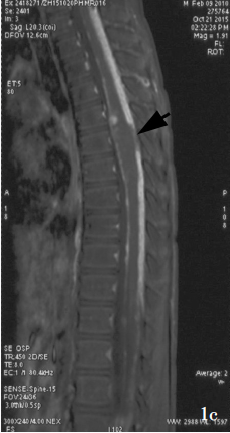
头部MRI检查(2015年10月14日)显示,双侧侧脑室明显增宽,提示脑积水,并可见双侧小脑上沟散在斑片样异常略高信号影(图1a,1b)。脊髓MRI检查(2015年10月19日)显示,T5~7水平脊髓增粗,可见髓内异常略高信号影(图1c),增强扫描脑干表面、双侧小脑半球表面脑膜、全脊膜和部分硬脊膜、马尾神经增厚并呈强化征象。
图1 头部和脊椎MRI检查(2015年10月14和19日)所见。1a头部横断面T2WI(10月14日)显示,双侧侧脑室明显增宽,提示脑积水;1b头部横断面T2WI(10月14日)显示,双侧小脑上沟散在斑片样异常略高信号影(箭头所示);1c脊椎矢状位T2WI检查(10月19日)显示,T5~7水平脊髓增粗,可见髓内异常略高信号影(箭头所示)
遂行左侧侧脑室Ommaya囊外引流术,引流脑脊液外观清亮、透明,压力约为100mmH2O(1mmH2O=9.81×10-3kPa,50~100mmH2O),术后予苯巴比妥(具体剂量不详)
预防癫发作。患儿7d前再次出现意识障碍,表现为双眼凝视,呼之不应,大小便失禁,持续约2h后出现抽搐发作,持续约30min后自行缓解。外院再次行左侧侧脑室Ommaya囊外引流术,术后恢复良好。复查头部和脊髓MRI(2015年11月18日)显示,双侧小脑上沟和幕上脑池小脑幕纵裂散在斑片样异常高信号影,T5~7水平脊髓增粗,可见脊髓内异常高信号影(图2),考虑中枢神经系统结核可能性大。
图2 2015年11月18日头部和脊椎MRI检查所见。2a头部横断面T2WI显示,双侧侧脑室明显增宽,较前改善不明显;2b头部横断面T2WI显示,双侧小脑上沟散在斑片样异常高信号影较前增多(箭头所示);2c脊椎矢状位T2WI检查显示,T5~7水平脊髓增粗,可见髓内异常高信号影(箭头所示)
为求进一步诊断与治疗,遂至我院就诊,门诊以“脑积水,脊髓病变原因待查”收入院。患儿自发病以来,精神良好,睡眠、饮食正常,大小便正常,体重无明显变化。既往史、个人史及家族史患儿足月剖宫产,围生期无特殊疾病病史,4个月会翻身、9个月会叫“爸妈”、1岁会独立行走、2岁会说完整句子但吐字不清、上幼儿园时(2013年5月)教师诉语言发育落后,于外院行头部MRI检查未见明显异常。
预防接种史无特殊,无禽类、牲畜密切接触史,无疫情、疫区、疫水接触史,无牧区、矿山、高氟区、低碘区居住史,无化学物质、放射物、毒物接触史,否认肝炎、结核病、疟疾等传染性疾病病史,否认手术史、外伤史。头孢菌素类
抗生素皮试阳性(具体不详),口服头孢菌素类
抗生素未见皮疹,否认其他药物和食物过敏史。父母非近亲婚配,身体健康。家族中无类似疾病病史,无家族遗传性疾病病史。
体格检查患者体温36.8℃,呼吸19次/min,脉搏92次/min,血压为96/60mmHg(1mmHg=0.133kPa)。神志清楚,语言流利,头围52.40 cm,左侧额部头皮可见手术瘢痕,长约3 cm,余皮肤未见皮疹和瘢痕;眼结膜无水肿,双侧瞳孔等大、等圆,直径约3mm,对光反射灵敏;咽部无充血,心、肺、腹部未见明显异常。颈部柔软,无抵抗,Brudzinski征阴性,四肢肌力和肌张力正常,膝腱和跟腱反射略亢进,双侧Babinski征阳性。
辅助检查实验室检查:腰椎穿刺脑脊液外观清亮、透明,总细胞计数8×106/L[(0~15)×106/L],白细胞计数5×106/L[(0~10)×106/L],蛋白定量4680.50mg/L(200~400mg/L)、葡萄糖3.60mmol/L(3.10~4.40mmol/L)、氯化物111.50mmol/L(111~123mmol/L),细菌、真菌、抗酸杆菌、新型隐球菌和寄生虫涂片呈阴性,血清结核杆菌
感染T细胞斑点试验(T-SPOT.TB)阴性。胸部CT和腹部超声检查均未见明显异常。诊断与治疗经过临床诊断为脑积水;脊髓病变原因待查。
遂于2015年12月6日于全身麻醉下行胸髓病变探查切除术+椎管重建术。术中可见蛛网膜与软脊膜之间有半透明的胶冻样异常组织增生,位于脊髓背侧,边界清晰,血供较差,与脊髓和脊神经有少许粘连,堵塞蛛网膜下隙。手术大部分切除病变组织,行组织病理学检查。
(1)大体标本观察:手术切除标本为灰白色破碎组织一堆,切面呈灰褐色,大小约1.50 cm×1.20 cm×0.50 cm,质地中等,无明显包膜,局部可见出血。经体积分数为4%的中性甲醛溶液固定,常规脱水、透明、石蜡包埋,制备4μm连续脑组织切片,行HE染色和
免疫组织化学染色。
(2)HE染色:光学显微镜观察,纤维背景和纤维分隔下可见胞质透亮的小圆肿瘤细胞呈巢团样分布,纤维内亦可见散在分布的肿瘤细胞,未见坏死和核分裂象(图3)。
图3 光学显微镜观察所见HE染色×200。3a纤维背景和纤维分隔下可见低至中等密度、形态相对单一且胞质透亮的小圆肿瘤细胞呈团巢样分布,似少突胶质细胞;3b纤维内可见散在分布的肿瘤细胞
(3)
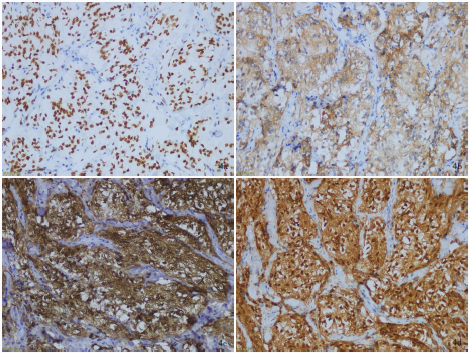
免疫组织化学染色:采用EnVision二步法,检测用试剂盒购自美国Dako公司;检测用抗体包括少突胶质细胞转录因子2(Olig-2,1∶100)、突触素(Syn,1∶150)、微管相关蛋白-2(MAP-2,1∶200)、神经元核抗原(NeuN,1∶150)、神经元特异性烯醇化酶(NSE,1∶100)、Ki-67抗原,购自北京中杉金桥生物技术有限公司,S-100蛋白(S-100,1∶2000)购自美国Dako公司。结果显示,肿瘤细胞胞核表达Olig-2(图4a),胞质表达Syn(图4b)、MAP-2(图4c)和S-100(图4d),Ki-67抗原标记指数为4%~10%(图4e),不表达NeuN和NSE。
图4 光学显微镜观察所见免疫组织化学染色(EnVision二步法)×200。4a肿瘤细胞胞核表达Olig-2;4b肿瘤细胞胞质表达Syn;4c肿瘤细胞胞质表达MAP-2;4d肿瘤细胞胞质表达S-100;4eKi-67抗原标记指数为4%~10%
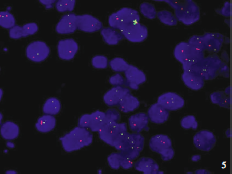
(4)荧光原位杂交(FISH)染色:采用FISH法检测1p/19q缺失,检测用探针为LSI?1p36/1q25和LSI?19q13/19p13探针(美国Abbott公司)。于荧光显微镜下计数100个肿瘤细胞,1个细胞内单个红点即为1个缺失,此种细胞数目>30%即为单独1p缺失。结果显示,1p杂合性缺失,即计数100个肿瘤细胞,其中>30%的细胞均出现单个红点(图5);采用FISH法检测BRAFKIAA1549基因融合,检测用探针为D7Z1DNA探针(美国Abbott公司),检测位点为染色体7p11.1~q11.1,重复2次,未见BRAFKIAA1549基因融合。最终诊断为弥漫性软脑膜胶质神经元肿瘤。
图5 荧光显微镜观察可见1p杂合性缺失(计数100个肿瘤细胞,1个细胞内单个红点即为1个缺失,此种细胞数目>30%即为单独1p缺失)FISH染色×1000
术后10d拔除引流管,未予放射治疗或药物化疗。患儿共住院22d,出院后6d出现喷射状呕吐,进食后呕吐明显,予甘露醇(具体剂量不详)静脉滴注降低颅内压,效果较差,仍频繁呕吐。复查头部MRI(2015年12月23日)显示,脑室系统明显扩张,其内可见引流管影,脑沟、脑裂和脑池变浅,中线结构无移位。遂予经颅穿刺脑脊液引流术,3个月后随访时已死亡。
原始出处:
来源:中国现代神经疾病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言