[摘要] 晚期乳腺癌的综合诊疗已进入“精准分类、精确分层”时代,并迈向个体化精准医学之路。2023年晚期乳腺癌不同分子分型研究领域取得了多项突破性进展,其研究结果影响临床指南,改变临床实践。激素受体阳性晚期乳腺癌的研究重点在于细胞周期蛋白依赖性激酶4和6(cyclin-dependent kinase 4 and 6,CDK4/6)抑制剂治疗失败患者的治疗选择。人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)低表达晚期乳腺癌已成为一个新兴治疗方向,而T-DXd是其重要的治疗选择。PHILA研究结果的公布,开启了HER2阳性晚期乳腺癌一线治疗的新纪元。同时T-DXd已成为临床治疗实践中酪氨酸激酶抑制剂治疗失败后的首选。晚期三阴性乳腺癌(triple-negative breast cancer,TNBC)中免疫治疗和靶向治疗相关研究也如火如荼,TORCHILIGHT研究、BEGONIA研究等取得了阳性结果。与此同时,探索TNBC精准治疗的 “复旦分型”的系列临床研究也在持续进行中,有望改变目前的治疗模式。本文对2023年晚期乳腺癌的重大临床研究进展按照不同分子分型进行梳理和总结,以期更好地为临床治疗提供参考和指导。
[关键词] 晚期乳腺癌;临床研究;研究进展
[Abstract] The comprehensive diagnosis and treatment of advanced breast cancer has entered the era of "accurate classification and precise stratification", and is moving towards the road of personalized precision medicine. In 2023, significant breakthroughs have been achieved in the research on different molecular classifications of advanced breast cancer, influencing clinical guidelines and transforming clinical practice. The primary focus of research for hormone receptor positive advanced breast cancer lies in selecting appropriate treatments for patients who have failed cyclin-dependent kinase 4 and 6 (CDK4/6) inhibitors. Advanced breast cancer with low human epidermal growth factor receptor 2 (HER2) expression has emerged as a promising treatment direction, with T-DXd being an important therapeutic option. With the release of results from the PHILA study, a new era has begun for first-line treatment of HER2-positive advanced breast cancer. Simultaneously, T-DXd has become the preferred choice in clinical practice following tyrosine kinase inhibitor failure. Research related to immune and targeted therapy for advanced triple-negative breast cancer (TNBC) is also progressing rapidly, yielding positive outcomes in studies such as TORCHILIGHT and BEGONIA. Additionally, ongoing clinical studies on precision treatment based on the "Fudan classification" for TNBC are expected to revolutionize current treatment approaches. This paper summarized major advancements in clinical research on advanced breast cancer in 2023 according to various molecular classifications, aiming to provide improved reference and guidance for clinical management.
[Key words] Advanced breast cancer; Clinical study; Research progress
最新全球癌症统计数据表明,乳腺癌是世界范围内女性发病率最高的恶性肿瘤[1]。近年来,乳腺癌的综合诊疗也经历了从经验医学过渡到循证医学,再逐步向个体化精准治疗迈进的过程[2]。而乳腺癌临床实践的改变必须基于最佳的循证医学证据、专家共识、产品的可及、随机对照试验、真实世界研究等。本文回顾2023年度改变晚期乳腺癌临床实践的重要研究。
1 激素受体阳性晚期乳腺癌
临床研究不断发展,激素受体(hormone receptor,HR)阳性晚期乳腺癌的治疗已经全面进入靶向治疗联合内分泌治疗的时代[3]。近年来细胞周期蛋白依赖性激酶4和6(cyclin-dependent kinase 4 and 6,CDK4/6)抑制剂的出现为患者治疗带来希望,目前国内也有4种CDK4/6抑制剂获批上市:阿贝西利、哌柏西利、达尔西利、瑞波西利。DAWNA-2研究[4]分析了中国首个自主研发的CDK4/6抑制剂达尔西利联合芳香化酶抑制剂(aromatase inhibitor,AI)对比安慰剂联合AI,在期中分析时已达到主要终点。结果显示,达尔西利联合AI相比单药AI治疗无进展生存期(progression-free survival,PFS)延长了12.4个月(30.6个月 vs 18.2个月,P<0.001),且展现出良好的安全性和耐受性。同时达尔西利已于2023年1月18日正式被纳入国家医保药品目录,未来将以更高的可及性,惠及更多需长期用药的晚期乳腺癌患者。
随着CDK4/6抑制剂在国内可及性的不断提升,激素受体阳性、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性的晚期乳腺癌患者会在一线、二线以及辅助治疗阶段接受CDK4/6抑制剂联合内分泌解救治疗,因此将会有大量人群面临CDK4/6抑制剂治疗失败,其后的治疗方案也面临多种选择。临床研究中将晚期内分泌治疗失败的患者分为原发性和继发性内分泌治疗耐药。在晚期乳腺癌解救治疗中将原发性内分泌治疗耐药定义为一线内分泌治疗<6个月出现疾病进展,而继发性内分泌治疗耐药即不符合原发性内分泌治疗耐药的其他内分泌治疗耐药的情况。现有的临床研究围绕跨线使用CDK4/6抑制剂、更换靶点如磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)/蛋白激酶B(protein kinase,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导通路抑制剂治疗、口服选择性雌激素受体调节剂(selective estrogen receptor modulator,SERD),或者转向传统化疗,以及选择抗体药物偶联物(antibody-drug conjugate,ADC)等方案均展开了积极探索。
解放军总医院第五医学中心开展了一项全国多中心、回顾性比较队列研究[5]旨在评估激素受体阳性、HER2阴性晚期乳腺癌患者经CDK4/6抑制剂治疗失败后,CDK4/6抑制剂跨线或更换其他靶点治疗,何种方案更为获益。该研究从中国临床肿瘤学会(the Chinese Society of Clinical Oncology,CSCO)乳腺癌专家委员会(CSCO Expert Committee on Breast Cancer,CSCO BC)的数据库中筛选了激素受体阳性HER2阴性晚期乳腺癌患者,这些患者均为哌柏西利治疗进展后接受了阿贝西利或西达本胺治疗方案。研究结果显示,哌柏西利治疗失败后,选择以阿贝西利为基础的内分泌治疗方案较西达本胺组中位PFS延长(5.0 个月 vs 2.0 个月,P<0.001),提示哌柏西利治疗进展后换线使用阿贝西利是临床治疗中的更优选择,但是还需要更大规模的前瞻性临床试验来进一步评估。
既往研究[6-7]表明,AKT信号转导通路激活与内分泌治疗及CDK4/6抑制剂的耐药性存在关联,因而AKT一直被视为极具治疗前景的靶点之一。而2023年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)大会上,CAPItello-291研究[8]报道的关键临床亚组的探索性PFS分析结果显示,无论AKT信号转导通路相关基因是否突变,患者均能从capivasertib联合氟维司群治疗中获益,且该方案在既往接受或未接受CDK4/6抑制剂治疗人群中均可降低疾病进展风险。Capivasertib作为最早进入Ⅲ期临床试验的AKT抑制剂之一,凭借其出色的疗效和安全性数据,在激素受体阳性HER2阴性晚期乳腺癌治疗中增添了浓墨重彩的一笔。
一项纳入了200例激素受体阳性HER2阴性晚期乳腺癌患者的多中心大样本回顾性研究[9]旨在评估经CDK4/6抑制剂治疗进展后化疗和内分泌治疗的获益。结果显示,对于前线CDK4/6抑制剂耐药人群,后线选择化疗或内分泌治疗,其差异无统计学意义(5.6个月 vs 4.6个月,P=0.669)。因此临床上对于这一类人群的后续治疗方案,还是应当综合考虑患者既往治疗方案、疾病负荷、患者自身意愿等因素后制订。
DESTINY-Breast04研究[10]是乳腺癌领域第一项聚焦于HER2低表达患者且获得阳性结果的 Ⅲ期临床试验。该研究中,激素受体阳性人群中既往CDK4/6抑制剂治疗进展的的患者约占70%。研究结果显示,激素受体阳性人群和总人群中,德曲妥珠单抗(T-DXd)治疗组的PFS和OS得到显著改善,差异有统计学意义。T-DXd临床使用安全性可控。因此,针对激素受体阳性HER2低表达的转移性乳腺癌患者,2023年CSCO乳腺癌诊疗指南[11]也将DB-04研究列为CDK4/6抑制剂治疗失败后的Ⅱ级推荐。
激素受体阳性晚期乳腺癌的治疗进展小结:
⑴ CDK4/6抑制剂联合内分泌治疗是激素受体阳性晚期乳腺癌的标准治疗。而对于临床上选择何种CDK4/6抑制剂,具体可结合相关临床研究的纳入人群、产品的适应证和不良反应以及患者自身情况等综合考虑。
⑵ 目前CDK4/6抑制剂治疗失败后有多种治疗模式。对于既往CDK4/6抑制剂治疗获益的患者可考虑换用另一种CDK4/6抑制剂治疗。对于既往内分泌治疗获益的患者可考虑内分泌治疗联合其他靶点的靶向治疗。而对于那些既往内分泌治疗未曾获益的患者,转向传统化疗以及选择ADC药物,也是CDK4/6抑制剂治疗失败后的可选方案。
⑶ 而对于HER2低表达患者,以T-DXd为代表的ADC类药物也应纳入后续治疗方案的考虑范围中。
2 HER2阳性晚期乳腺癌
以抗HER2为基础的靶向治疗一直是HER2阳性晚期乳腺癌的标准治疗模式[12]。抗HER2靶向药物从无到有,不断推陈出新并广泛应用于临床治疗中,使得越来越多的HER2阳性晚期乳腺癌患者实现长期生存。针对HER2阳性和HR阳性患者开展的PERTAIN研究[13]探索了在曲帕双靶方案基础上联合内分泌治疗的效果,结果显示,与单用曲妥珠单抗和AI相比,加用帕妥珠单抗可显著改善患者的中位PFS(median PFS,mPFS),差异有统计学意义(20.6个月 vs 15.8 个月,P=0.006)。这为一线使用曲妥珠单抗、帕妥珠单抗双靶向方案治疗HER2阳性晚期乳腺癌提供了新的证据。
2023年CSCO乳腺癌诊疗指南[11]对复发转移阶段的治疗推荐进行了更新,将吡咯替尼联合曲妥珠单抗的双靶联合化疗方案也纳入了除固有的曲帕双靶联合化疗方案外的一级推荐。这是基于在ESMO大会上PHILA研究[14]公布的结果。该研究结果显示,PyHT方案在HER2阳性晚期乳腺癌一线治疗的中位PFS达到24.3个月,显著优于TH方案(24.3个月 vs 10.4个月,P<0.001),因其也具有口服维持治疗的可能性,由此开创了HER2阳性晚期乳腺癌一线治疗的全新格局。该研究虽然证明了在曲妥珠单抗和紫杉类药物的基础上联合吡咯替尼方案的临床治疗优势,但是尚缺乏与曲帕双靶联合紫杉类药物(THP)方案疗效的直接对比。因此,对于曲妥珠单抗治疗敏感的晚期乳腺癌患者,THP和PyHT治疗方案应该同时成为一线治疗的选择。
当PHILA研究结果成为一线可选择方案,PHENIX研究和PHOEBE研究结果成为曲妥珠单抗治疗失败后的循证医学证据并应用于临床治疗时,大量人群会选择酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗,这必然会面临TKI治疗失败后靶向治疗选择的问题。目前国内外均缺乏治疗标准,国内临床治疗虽有多种选择,但还需更多高质量的临床研究进行疗效对比。作为新型抗HER2 ADC类药物代表的T-DXd,基于DESTINY-Breast03研究[15]的积极结果,也已获批上市,开启了HER2阳性晚期乳腺癌二线治疗的新纪元,但该研究中仅纳入16%的TKI经治人群,临床上仍缺乏更多的循证医学证据。一项由解放军总医院第五医学中心开展的真实世界研究,针对TKI治疗失败应用不同ADC类药物的疗效进行了探索。该研究结果显示,TKI治疗失败后,使用以T-DXd为主的新型抗HER2 ADC较T-DM1的mPFS延长(7.0 个月 vs 4.0 个月,P<0.001),在亚组分析中T-DXd疗效更是显著优于其他新型ADC和T-DM1组(13.0、7.0和4.0 个月,P<0.001)。该研究提示以T-DXd为主的新型ADC将成为TKI治疗失败后HER2阳性晚期乳腺癌的首选治疗策略,但后续仍需要开展更多的临床研究以进一步验证(图1)。
未来T-DXd不断增加的耐药性,将对ADC类药物在临床实践中的广泛使用构成严峻挑战,因此探索ADC类药物耐药机制和耐药后合理的方案选择已成为当务之急[16]。结合现有真实世界数据及专家意见,临床实践中还是应该坚持精确分层理念,结合患者的既往治疗进行选择,科学有序地制订全程治疗方案。
乳腺癌是导致脑转移性肿瘤的常见原因之一,又以HER2阳性乳腺癌发生率居高[17]。随着HER2阳性晚期乳腺癌患者生存期显著延长,脑转移发生率也呈上升趋势,因此脑转移患者的生存获益成为了热点问题。针对此类人群,CSCO乳腺癌诊疗指南[11]在Ⅰ级推荐中仍以局部治疗为主,但在Ⅱ级推荐中对于那些局部症状可控的HER2阳性患者,可在密切MRI随访下酌情考虑药物治疗。目前国内优选的方案还是吡咯替尼联合卡培他滨方案,其依据就是PERMEATE研究[18]。该研究对比了HER2阳性乳腺癌活动性脑转移吡咯替尼联合卡培他滨在放疗前或后使用的疗效与安全性,在2023年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上公布的最终结果显示,队列A (未经放疗的新发脑转移患者)与队列B(局部放疗后再进展的脑转移患者)总生存期(overall survival,OS)分别达36.0和31.5个月,这说明有效的药物治疗可以为患者带来更长的生存获益。而类似的全身治疗的研究结果的公布也引起了国内外对临床实践中脑转移患者局部治疗和全身治疗的策略排布的思考。一项单臂Ⅱ期临床研究[19]评估了脑转移患者放疗联合TKI的治疗效果和安全性。结果显示,颅脑局部放疗联合全身吡咯替尼和卡培他滨治疗可使HER2阳性晚期乳腺癌患者的1年中枢神经系统(central nervous system,CNS)的PFS率达74.9%,中位CNS-PFS达18.0个月,且安全性可控。除上述研究外,评估TKI联合T-DM1方案的HER2 CLIMB-02研究和探索T-DXd疗效的DESTINY-Breast系列研究也初见成效。因此,对乳腺癌脑转移的治疗还是应采取多学科诊疗模式,充分评估全身情况,综合考虑全身和局部治疗,以使患者从系统治疗方案中获益。
HER2阳性晚期乳腺癌治疗进展小结:
⑴ 对于曲妥珠单抗敏感的患者,在曲妥珠单抗基础上联合帕妥珠单抗或者吡咯替尼的双靶方案均为一线基本治疗模式。
⑵ 对于曲妥珠单抗治疗失败的患者后续治疗可考虑TKI或者ADC类药物,但应结合既往治疗模式综合考虑来选择后续治疗方案。
⑶ 对于TKI治疗失败后的患者,ADC已成为优选。
⑷ 乳腺癌脑转移患者的治疗应采取多学科诊疗模式,在充分评估全身情况的前提下,优先考虑针对脑转移的手术、放疗,同时也需合理兼顾全身治疗。
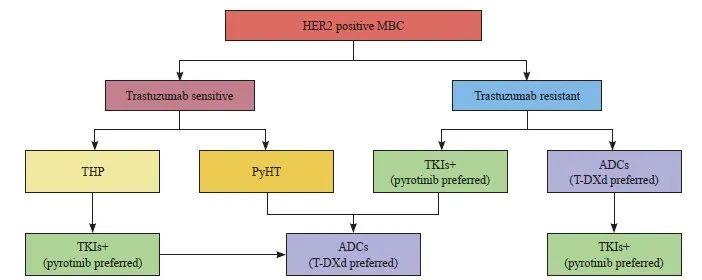
图1 HER2阳性晚期乳腺癌分层治疗策略
Fig. 1 Treatment strategy for HER2 positive advanced breast cancer
MBC: Metastatic breast cancer; T: Taxane; H: Trastuzumab and its biosimilars; P: Pertuzumab; Py: Pyrotinib; TKI + : TKI combined with chemotherapy or endocrine therapy.
3 晚期TNBC
既往化疗一直是TNBC患者的标准治疗选择。但随着对肿瘤免疫微环境的深入研究,寻找其精准治疗的靶点及更为获益的治疗方式成为目前亟待解决的问题。针对免疫检查点的免疫治疗药物和不同靶点的靶向治疗药物的出现,如程序性细胞死亡受体1(programmed death-1,PD-1) /程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂、靶向HER2或靶向人滋养细胞表面抗原-2(trophoblast cell surface antigen-2,Trop-2)抗体药物偶联物、抗血管生成药物等,正在改变TNBC的临床实践并展示出良好前景,为TNBC治疗提供了新思路。
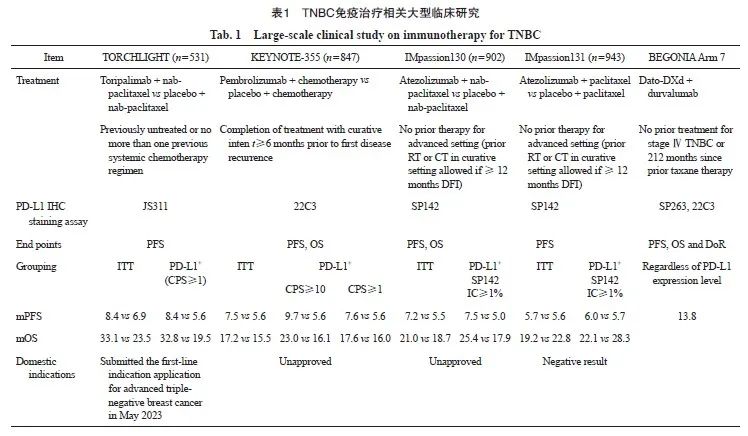
近年来有一些临床研究尝试探索TNBC免疫治疗。IMpassion130研究[20]的结果显示免疫治疗联合化疗一线治疗可显著延长PD-L1阳性晚期TNBC患者的总生存期,但随后验证性的IMpassion131 研究[21]取得的双阴性结果,让药物监管部门又撤销了该适应证。KEYNOTE-355研究[22]评估了帕博利珠单抗联合化疗对比化疗单药一线治疗PD-L1阳性晚期TNBC的疗效,虽取得了阳性结果,但同时揭示了基于PD-L1 CPS分层的疗效差异,即CPS≥10的患者获益最为显著。因此目前对于TNBC患者,如何预测PD-L1抑制剂疗效、筛选适宜人群,一直存在争议。而相较于上述研究,TORCHLIGHT研究[23]证明只要PD-L1阳性(即CPS≥1),患者就有从免疫治疗联合化疗方案中获益的可能。该研究分析了晚期TNBC患者特瑞普利单抗联合化疗对比安慰剂联合化疗的效果和安全性。其结果显示,与安慰剂组相比,特瑞普利单抗联合化疗方案可显著延长PD-L1阳性人群的中位无进展生存期(mPFS为8.4个月 vs 5.6个月,P<0.010 2),同时在PD-L1阳性和意向治疗人群(intent-to-treat,ITT)中均观察到明显的OS获益趋势。CPS的临界值从高到低,拓宽了免疫治疗应用人群,扩大了晚期患者的治疗选择,充实了免疫治疗在TNBC患者中应用的循证医学证据。但值得关注的是,国内尚无免疫检查点抑制剂获批用于晚期TNBC一线治疗,且如何增强免疫应答、制订个体化免疫治疗组合方案以及提高产品可及性仍待解决(表1)。
此外,随着Trop-2 ADC药物在晚期TNBC中崭露头角,如何通过免疫治疗联合ADC类药物以达到更好的疗效,破解现有的免疫治疗联合化疗方案的困境也成为未来研究方向之一。2023年ESMO大会上公布的BEGONIA研究[24]队列7的早期结果展示了Dato-DXd联合度伐利尤单抗用于一线治疗的高缓解率和可控的安全性,且无关PD-L1的表达情况。值得关注的是,BEGONIA研究正入组队列8的群体,将探索该方案在一线治疗PD-L1高表达晚期TNBC患者的疗效和安全性,我们也期待该研究在未来能产生影响临床实践的结果。
目前国内其他靶向ADC类药物的研究也如火如荼,并且一些也已亮相ESMO、ASCO大会,如针对B7-H4的新型DAR-6 ADC HS-20089,靶向Nectin-4 ADC 9MW2821,靶向HER2 ADC RC48,靶向Trop-2 ADC SKB264等,均在TNBC患者中展现出其不错的疗效且治疗安全可控。另外,关于HER3靶向ADC的临床试验也正在开展。ADC类药物研发已然成为晚期TNBC解救治疗的重点方向之一,期待未来涌现出更多ADC类药物,登上国际舞台。
探索基于分子分型的精准治疗新模式也取得了重大突破。复旦大学附属肿瘤邵志敏教授团队首先基于中国人群数据绘制了多组学图谱,并提出更为精细的“复旦分型”。随后,基于“复旦分型”开展的FUTURE系列研究也接连问世。2023年ASCO年会上发布的FUTURE-SUPER研究[25]是一项针对晚期TNBC患者一线治疗的随机对照伞形Ⅱ期临床试验,旨在评估基于分子亚型和基因组标志物的精准治疗在晚期TNBC患者一线治疗中的疗效。结果显示,精准治疗组的中位PFS获益显著(11.3个月 vs 5.8个月),其中免疫调节型即IM型(方案为白蛋白结合型紫杉醇联合卡瑞利珠单抗和法米替尼)是mPFS获益幅度最大的亚型(15.1 个月 vs 6.5 个月),后续高通量生物标志物分析也在推进中。4种亚型中基底样免疫抑制型(BLIS)对免疫治疗效果最差,预后也最差,该团队针对此型也开展了研究[26]。其成果揭示了代谢物鸟苷二磷酸甘露糖(GDP-M)诱导HRD(同源重组缺陷)进而激活抗肿瘤免疫的具体机制,同时也探讨了一种潜在治疗策略,即联合使用GDP-M、PARP抑制剂和抗PD-1免疫疗法来治疗HRD低评分的TNBC患者,深化了TNBC“精准治疗”的理念。
晚期TNBC治疗进展小结:
⑴ 化疗依然是目前TNBC的基本治疗方法。但随着精准医疗的发展,越来越多的患者可以选择在此基础上联合免疫治疗或者靶向治疗。
⑵ 在化疗联合免疫治疗方面,部分临床研究已经取得了阳性结果。但由于现有的临床研究中纳入人群不尽相同,其结果会存在差异。期待后续有更多临床研究来进一步探索。
⑶ 新型ADC类药物给TNBC患者带来更多的治疗选择。
4 总结与展望
综上所述,关键性临床研究可能改变晚期乳腺癌临床实践[27],未来更多可及的产品也将为患者带来更多选择。但目前还面临重重挑战:许多关乎耐药性和生物标志物的问题未得到答复,优化乳腺癌诊疗模式正在路上。临床实际中仍需贯彻“精准分类,精确分层”的理念,综合考虑诊疗指南、专家共识、研究证据级别、药物可及性、不良反应、安全性管理及患者意愿等因素,在充分评估治疗风险和获益的情况下,为患者提供科学合理的个体化治疗方案。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
张思源:论文初稿撰写,文献检索和总结;江泽飞:论文主题指导,文章审阅与修订。
[参考文献]
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30.
[2] 江泽飞, 许凤锐. 乳腺癌精准治疗:20年探索历程[J]. 中国实用外科杂志, 2020, 40(1): 83-88.
JIANG Z F, XU F R. Precise treatment of breast cancer: two decades of exploration[J]. Chin J Pract Surg, 2020, 40(1): 83-88.
[3] 袁 洋, 江泽飞. 再议乳腺癌内分泌治疗热点问题[J]. 中华医学杂志, 2023, 103(34): 2647-2651.
YUAN Y, JIANG Z F. Rediscussion on hot issues of endocrine therapy for breast cancer[J]. Natl Med J China, 2023, 103(34): 2647-2651.
[4] ZHANG P, ZHANG Q Y, TONG Z S, et al. Dalpiciclib plus letrozole or anastrozole versus placebo plus letrozole or anastrozole as first-line treatment in patients with hormone receptor-positive, HER2-negative advanced breast cancer (DAWNA-2): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2023, 24(6): 646-657.
[5] YUAN Y, ZHANG S H, WANG T, et al. Efficacy and safety of abemaciclib-based therapy versus tucidinostat-based therapy after progression on palbociclib in patients with HR+ HER2- metastatic breast cancer[J]. Transl Breast Cancer Res, 2023, 4: 10.
[6] ANDRAHENNADI S, SAMI A, MANNA, et al. Current landscape of targeted therapy in hormone receptor-positive and HER2-negative breast cancer[J]. Curr Oncol, 2021, 28(3): 1803-1822.
[7] ASHAI N, SWAIN S M. Post-CDK 4/6 inhibitor therapy: current agents and novel targets[J]. Cancers, 2023, 15(6): 1855.
[8] TURNER N C, OLIVEIRA M, HOWELL S J, et al. Capivasertib in hormone receptor-positive advanced breast cancer[J]. N Engl J Med, 2023, 388(22): 2058-2070.
[9] LI Y, LI W, GONG C C, et al. A multicenter analysis of treatment patterns and clinical outcomes of subsequent therapies after progression on palbociclib in HR+ /HER2- metastatic breast cancer[J]. Ther Adv Med Oncol, 2021, 13: 17588359211022890.
[10] MODI S N, JACOT W, YAMASHITA T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer[J]. N Engl J Med, 2022, 387(1): 9-20.
[11] 中国临床肿瘤学会指南工作委员会组织. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南-2023[M]. 北京: 人民卫生出版社, 2023.
[12] 冀辰辰, 李健斌, 江泽飞. HER2阳性乳腺癌分层治疗新策略[J]. 中国肿瘤临床, 2022, 49(22): 1147-1150.
JI C C, LI J B, JIANG Z F. New strategy for stratified treatment of HER2-positive breast cancer[J]. Chin J Clin Oncol, 2022, 49(22): 1147-1150.
[13] ARPINO G, DE LA HABA RODRÍGUEZ J, FERRERO J M, et al. Pertuzumab, trastuzumab, and an aromatase inhibitor for HER2-positive and hormone receptor-positive metastatic or locally advanced breast cancer: PERTAIN final analysis[J]. Clin Cancer Res, 2023, 29(8): 1468-1476.
[14] MA F, YAN M, LI W, et al. Pyrotinib versus placebo in combination with trastuzumab and docetaxel as first line treatment in patients with HER2 positive metastatic breast cancer (PHILA): randomised, double blind, multicentre, phase 3 trial[J]. BMJ, 2023, 383: e076065.
[15] HURVITZ S A, HEGG R, CHUNG W P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial[J]. Lancet, 2023, 401(10371): 105-117.
[16] LI J B, JIANG Z F. Antibody drug conjugates in breast cancer in China: highlights, challenges, and prospects[J]. Cancer, 2023. Online ahead of print.
[17] DARLIX A, LOUVEL G, FRAISSE J, et al. Impact of breast cancer molecular subtypes on the incidence, kinetics and prognosis of central nervous system metastases in a large multicentre real-life cohort[J]. Br J Cancer, 2019, 121(12): 991-1000.
[18] YAN M, OUYANG Q C, SUN T, et al. Pyrotinib plus capecitabine for patients with human epidermal growth factor receptor 2-positive breast cancer and brain metastases (PERMEATE): a multicentre, single-arm, two-cohort, phase 2 trial[J]. Lancet Oncol, 2022, 23(3): 353-361.
[19] YANG Z Z, MENG J, MEI X, et al. Brain radiotherapy with pyrotinib and capecitabine in patients with ERBB2 positive advanced breast cancer and brain metastases: a non-randomized phase 2 trial[J]. JAMA Oncol, 2024: e235791.
[20] SCHMID P, RUGO H S, ADAMS S, et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2020, 21(1): 44-59.
[21] MILES D, GLIGOROV J, ANDRÉ F, et al. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase Ⅲ trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer[J]. Ann Oncol, 2021, 32(8): 994-1004.
[22] CORTES J, CESCON D W, RUGO H S, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial[J]. Lancet, 2020, 396(10265): 1817-1828.
[23] JIANG Z F, OUYANG Q C, SUN T, et al. Toripalimab plus nab-paclitaxel in metastatic or recurrent triple-negative breast cancer: a randomized phase 3 trial[J]. Nat Med, 2024, 30(1): 249-256.
[24] SCHMID P, WYSOCKI P J, MA C X, et al. Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic triplenegative breast cancer (a/mTNBC): updated results from BEGONIA, a phase Ⅰb/Ⅱ study[J]. Ann Oncol, 2023, 34: S337.
[25] FAN L, WANG Z H, MA L X, et al. Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial[J]. Lancet Oncol, 2024, 25(2): 184-197.
[26] DING J H, XIAO Y, YANG F, et al. Guanosine diphosphatemannose suppresses homologous recombination repair and potentiates antitumor immunity in triple-negative breast cancer[J]. Sci Transl Med, 2024, 16(728): eadg7740.
[27] 张会强, 江泽飞. 2022年改变晚期乳腺癌临床实践的重要研究[J]. 中国癌症杂志, 2023, 33(2): 110-116.
ZHANG H Q, JIANG Z F. Key clinical studies on changing clinical practice of advanced breast cancer in 2022[J]. China Oncol, 2023, 33(2): 110-116.
HR+HER2-晚期乳腺癌CDK4/6i失败后治疗模式新探索
![]() 0
2022-08-23
点击查看
0
2022-08-23
点击查看

“越是发达地区乳腺癌发病率越高?”乳腺专家齐聚曜影,共话乳腺癌防治现状
![]() 0
2022-11-08
点击查看
0
2022-11-08
点击查看

Lancet子刊:好消息!徐兵河团队发现激素受体阳性、HER2阴性晚期乳腺癌新的潜在一线治疗方法
![]() 0
2023-05-14
点击查看
0
2023-05-14
点击查看
academic radiology:如何实现乳腺癌脑转移患者的无创HER2状态预测?
![]() 0
2023-05-26
点击查看
0
2023-05-26
点击查看

JAMA Oncology:不同种族/民族的晚期乳腺癌人群可归因风险
![]() 0
2023-12-18
点击查看
0
2023-12-18
点击查看

Eur J Radiol:如何利用影像学工具准确预测乳腺癌腋窝淋巴结转移
![]() 0
2024-02-06
点击查看
0
2024-02-06
点击查看
