抑郁症正在成为仅次于癌症的人类第二大杀手;截至目前,全球预计有3.5亿人患病。抑郁症由遗传环境因素共同致病,其发病机制复杂且个体差异大。2025年2月18日,北京大学第六医院、IDG麦戈文脑科学研究所岳伟华课题组在Nature Communications期刊发表题为“Genome-wide interaction association analysis identifies interactive effects of childhood maltreatment and kynurenine pathway on depression”的研究论文,首次通过全基因组遗传环境交互关联分析揭示了童年期不良逆境与犬尿氨酸通路IDO2基因的协同作用对抑郁症发生发展的关键影响,为精准诊疗带来新希望。北京大学第六医院博士后孙瑶瑶博士为该论文第一作者,北京大学第六医院岳伟华教授为末位通讯,北京大学基础医学院毕文健研究员、清华大学万科公共卫生与健康学院陈润森副教授为共同通讯作者。

童年期不良逆境,主要指18岁以前个体所经历的躯体与情感虐待和忽视,是抑郁症最重要的环境危险因素之一;但并非所有经历童年期逆境的个体均发展为抑郁。传统研究基于“候选基因”策略发现童年期逆境对个体的影响受遗传调控,即存在遗传环境交互作用(G×E或G-by-E)。然而,尽管学界广泛认同抑郁症致病机制中遗传环境互作模式的存在,但基于先验发现的互作模式在新样本中往往难以被复制。全基因组时代亟需无偏识别可重复验证的遗传环境互作新模式。
该研究使用由毕文健课题组开发的适用于大型生物样本库且高效率的全基因组遗传环境交互关联分析新算法SPAGE(DOI: 10.1016/j.ajhg.2019.10.008),在英国生物样本库(UK Biobank)中开展全基因组遗传环境交互关联研究(GWEIS),率先发现了与童年期逆境互作的全基因组显著易感基因IDO2:携带风险等位基因的个体在经历童年期逆境暴露后抑郁风险显著增加,定位于犬尿氨酸通路;共定位分析揭示该基因的低甲基化介导了童年期逆境所致的高抑郁风险;影像学分析将该遗传环境互作模式关联的脑结构改变定位到左脑缘上回厚度变薄,并且这种脑结构改变在成年人和儿童中均得到验证。为了明确这种遗传环境互作模式是否可以在其他样本中复现,课题组利用美国青少年脑认知发育队列(ABCD)进行独立验证,发现这种遗传环境互作模式可以显著预测两年后儿童的新发抑郁,前扣带回皮层增厚受阻在其中发挥显著的中介作用。课题组进一步在抗抑郁治疗队列中也成功验证了这种互作模式,发现:携带风险基因的个体在经历童年期逆境暴露后,不仅抑郁风险显著增加,且在抗抑郁治疗中反应更差。
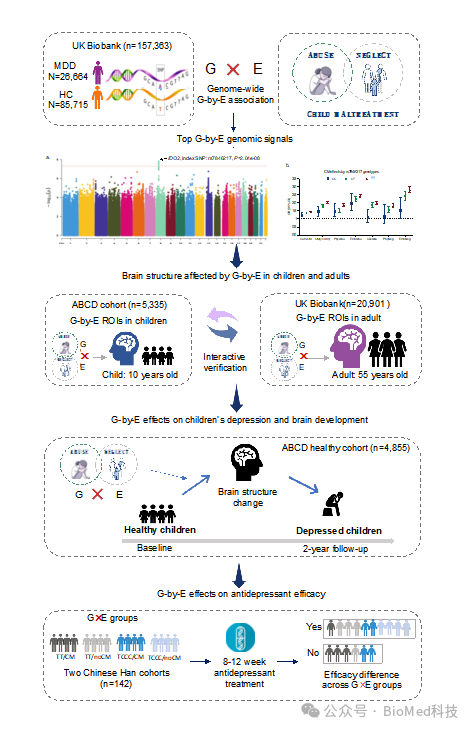
研究框架图
该研究首次通过全基因组遗传环境互作关联分析无偏识别了与童年期逆境互作的易感基因,构建了"基因-表观遗传-脑发育-临床转归"的全链条证据体系,为理解抑郁症的遗传环境互作模式提供了新范式。
参考文献
Sun, YY, ... Chen, RS#, Bi, WJ #, & Yue, WH#. Genome-wide interaction association analysis identifies interactive effects of childhood maltreatment and kynurenine pathway on depression. Nat Commun, 16, 1748 (2025).
原文链接:
https://doi.org/10.1038/s41467-025-57066-4