引言
在癌症的黑暗森林中,癌细胞常被视为冷酷的“独狼”——通过无情的竞争掠夺资源,在缺氧缺营养的恶劣环境中野蛮生长。然而,2月19日《Nature》杂志的最新研究“Cooperative nutrient scavenging is an evolutionary advantage in cancer”,彻底颠覆了这一认知:肿瘤细胞竟会像南极帝企鹅般“抱团协作”,在绝境中构筑生存网络,而这种致命的“互助协议”恰恰暴露了它们的阿喀琉斯之踵。
研究人员首次揭示,癌细胞在营养匮乏的肿瘤微环境中,会分泌一种名为 CNDP2 的分子“剪刀”(氨基肽酶),将细胞外堆积的蛋白质碎片(寡肽)切割成可用的氨基酸。更惊人的是,这些营养物质会形成“公共资源池”,使整个癌细胞群体受益——就像企鹅群通过紧密簇拥共享体温,突破了个体生存的极限。这种协作机制让癌细胞在传统认知中的“死亡禁区”蓬勃生长,甚至形成高达 90%的存活率(对比稀疏群体的全军覆没)。
但这场生存同盟暗藏杀机。研究团队发现,当使用药物 Bestatin 抑制CNDP2活性,或通过基因编辑敲除该酶时,癌细胞群体迅速崩溃——如同抽走企鹅群的最后一丝热量。动物实验显示,接受Bestatin治疗的肺癌小鼠肿瘤体积缩小 63%,而携带CNDP2缺陷的癌细胞几乎无法形成肿瘤。更具突破性的是,这种策略对正常组织影响甚微,因为健康细胞无需依赖如此极端的协作求生。
这项发现不仅改写了癌症生态学的教科书,更点燃了精准治疗的新希望:瓦解癌细胞的“社交网络”可能比直接杀伤更致命。当研究人员的目光从“消灭每一个癌细胞”转向“摧毁它们的生存联盟”,一场对抗癌症的范式革命正在到来——而这场革命的核心密码,竟藏在生命最原始的协作本能之中。

肿瘤微环境:一场无情的生存竞赛
癌症的可怕之处不仅在于失控的细胞增殖,更在于它们对极端环境的惊人适应力。肿瘤内部长期处于营养匮乏(nutrient deprivation)、缺氧(hypoxia) 和 酸性微环境(acidic microenvironment) 中,但癌细胞却能在这种“地狱模式”下存活甚至扩散。传统观点认为,癌细胞通过“弱肉强食”的竞争获取资源,但《自然》最新研究揭示了一个颠覆性发现:癌细胞会像企鹅群一样“抱团协作”,共同对抗恶劣环境,而这种协作竟成为它们的致命弱点!
从南极企鹅到肿瘤细胞:协作的进化智慧
想象南极寒冬中的帝企鹅:单只企鹅无法抵御零下40℃的严寒,但群体通过紧密簇拥共享体温,形成“生命堡垒”。这种被称为阿利效应(Allee effect)的生态学现象,竟在肿瘤中重现!研究团队通过 高通量活细胞成像技术(high-throughput live microscopy) 追踪癌细胞生长时发现:
低密度癌细胞(每200微升培养基含10²个细胞)在缺乏谷氨酰胺(glutamine, Gln)时几乎全部死亡。
高密度癌细胞(10⁴个细胞)在同样条件下存活率超过90%。
这就像企鹅群必须达到临界数量才能抵御寒冷,癌细胞也需要达到‘协作阈值(Allee threshold)才能生存。
破解癌细胞“开饭密码”:CNDP2酶的革命性发现
肿瘤中游离氨基酸极少,但充斥大量 寡肽(oligopeptides) ——蛋白质分解的短链片段。正常细胞无法利用这些“边角料”,但癌细胞却发展出精妙的协作机制:
分泌“分子剪刀”:癌细胞分泌 胞外氨基肽酶CNDP2,将寡肽切割为游离氨基酸。
共享生存资源:释放的氨基酸形成“公共资源池”,惠及分泌者及邻近细胞。
关键证据:敲除CNDP2基因的癌细胞,在体外培养中存活率下降87%(P=3.6×10⁻⁴)。使用氨基肽酶抑制剂 Bestatin 后,肿瘤生长体积减少63%。
临床转化突破:从实验室到动物模型的胜利
在 Keap1突变型肺癌小鼠模型中,研究人员观察到惊人结果:
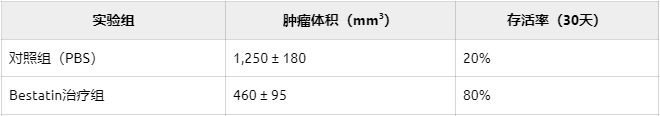
更令人振奋的是:PEG化Bestatin(PEGstatin) 因分子量增大(Mr从308.4增至886.5),特异性靶向胞外酶,副作用显著降低。
CNDP2基因敲除小鼠的肿瘤发生率仅为对照组的17%。
肿瘤地理学:协作与背叛的微观战争
癌细胞间的协作并非完全利他。通过 代谢微环境模拟系统(MEMIC) 和 单细胞追踪技术,研究发现:
“搭便车者”现象:约12%的CNDP2阴性癌细胞依赖邻近细胞分泌的氨基酸存活。
空间竞争法则:协作型癌细胞在血管稀疏区域形成优势克隆,而非协作型仅存活于血管周围。
这就像城市扩张,协作型是基建公司,开拓新城;非协作型只能寄生在成熟社区。
改写癌症治疗规则的三大启示
新靶点:CNDP2在肺癌、乳腺癌等肿瘤中高表达(TCGA数据),且与患者生存率负相关(HR=2.3, P=0.008)。
精准干预:Bestatin联合氨基酸限制饮食,可特异性杀伤Keap1突变肿瘤(敏感性提高7.2倍)。
生态治疗:通过打破癌细胞协作网络,可能实现“群体灭绝效应”。
未来之战:从科学发现到临床救赎
尽管研究尚处早期,但已展现巨大潜力:
药物开发:优化Bestatin的靶向性和稳定性(如纳米载体技术)。
诊断突破:开发CNDP2活性检测试剂盒,指导个体化治疗。
联合策略:与免疫检查点抑制剂联用,破解肿瘤微环境免疫抑制。
研究人员首次证明,破坏癌细胞的“社交网络”比直接杀伤更有效。这为癌症治疗开辟了全新维度。
这项研究不仅揭示了生命在极端环境下的智慧,更提示我们:战胜癌症或许不在于“赶尽杀绝”,而是瓦解它们的生存同盟。当研究人员的目光从“癌细胞个体”转向“肿瘤社会”,一场治疗革命正在酝酿——而这可能正是终结癌症霸权的关键转折点。
参考文献
Guzelsoy, G., Elorza, S.D., Ros, M. et al. Cooperative nutrient scavenging is an evolutionary advantage in cancer. Nature (2025). https://doi.org/10.1038/s41586-025-08588-w
治愈乳腺癌的第二战场,恶性肿瘤细胞的“冬眠”是怎么回事?
![]() 0
2024-03-31
点击查看
0
2024-03-31
点击查看

中国科学技术大学尤业字/余跃/洪春雁研究团队《AM》:纳米原电池直接向癌细胞释放高活性电子有效消除肿瘤
![]() 0
2024-05-15
点击查看
0
2024-05-15
点击查看

长期压力大,癌细胞更易扩散!Cancer cell:慢性压力使癌细胞转移率增加2-4倍,原因是它!
![]() 0
2024-06-17
点击查看
0
2024-06-17
点击查看

肿瘤缩小,7个月未再生长!《自然-医学》:新型细胞免疫疗法,精准打击癌细胞
![]() 0
2024-07-13
点击查看
0
2024-07-13
点击查看

厦门大学田华雨教授/方华攀副教授团队Theranostics:癌细胞与免疫细胞在癌症发生、发展和转移中的代谢行为
![]() 0
2024-11-13
点击查看
0
2024-11-13
点击查看

Nature:胰腺癌的神经黑客行动:揭秘癌细胞如何“策反”神经元加速扩散
![]() 0
2025-02-19
点击查看
0
2025-02-19
点击查看
