系统性红斑狼疮(SLE)是一种多器官、多系统受累的慢性、炎症性、自身免疫性疾病[1]。随着诊疗技术的不断提高以及生物制剂的使用,目前SLE患者的10年生存率已超过90%[2]。但与此同时,慢性肾功能不全、心脑血管疾病以及肌肉骨骼等慢性并发症的发病率也逐年升高。股骨头缺血性坏死(AVNF)是SLE肌肉骨骼病变中最值得关注的并发症之一[3],研究显示,4%~40%(平均约10%)的SLE患者可出现AVNF[1,4-7]。发展至终末期时,药物治疗、髓芯减压术往往难以取得满意的疗效,严重影响患者的生存质量,最终约6% 的SLE-AVNF患者符合全髋关节置换术(THA)指征并进行手术治疗[8]。
THA是SLE并发终末期AVNF的重要治疗手段,其在缓解疼痛、改善功能及患者生活质量方面已得到大量研究证实[5-6,9-11],预计到2030年,行THA的SLE-AVNF患者将比2005年增长174%[12]。然而,由于SLE患者通常多系统受累并长期使用免疫抑制剂,THA术后具有全身感染、切口愈合不良、SLE病情活动等潜在风险[2-5,11,13-14],且发生率高于一般患者[2,5-6]。既往研究发现,术后早期是下肢关节置换术后发生严重并发症的主要阶段[5,10,15-16],因此,对THA合并SLE的早期安全性研究具有重要意义。本研究旨在通过回顾性分析,探究SLE患者行THA术后30 d内的并发症发生情况,以期为临床诊疗提供参考和借鉴。
资料与方法
1.1 研究对象
本研究为回顾性队列研究,连续纳入2012年6月—2024年4月于北京协和医院骨科行THA患者的资料,根据手术患者是否伴有SLE分为SLE组和对照组。
SLE组纳入标准:(1)根据1997年美国风湿病学会制定的分类标准确诊为SLE;(2)因AVNF接受THA治疗;(3)术后30 d随访资料完整。
排除标准:(1)有恶性肿瘤疾病史;(2)术前30 d接受其他骨科手术;(3)急诊入院;(4)患有类风湿性关节炎、强直性脊柱炎、银屑病性关节炎等累及关节的风湿性疾病。
对照组纳入标准:因创伤、发育性髋关节发育不良、酒精性股骨头坏死等原因接受THA手术。
排除标准:(1)有恶性肿瘤疾病史;(2)术前30 d接受其他骨科手术;(3)急诊入院;(4)患有类风湿性关节炎、强直性脊柱炎、银屑病性关节炎等累及关节的风湿性疾病。
本研究已通过北京协和医院伦理审查委员会审批(审批号:K24C4121),并豁免患者知情同意。
1.2 围术期管理
1.2.1 术前
所有患者入院后完善血常规、肝/肾功能、血糖、电解质、凝血功能、红细胞沉降率、C反应蛋白、补体、抗双链DNA抗体、抗核抗体、尿常规、24 h尿蛋白等实验室检测以及髋关节X线等影像学检查。
对于SLE患者,术前由风湿免疫科医生会诊,通过SLE疾病活动度评分(SLEDAI)评估SLE活动情况。根据美国风湿病学会(ACR)/美国髋关节和膝关节外科协会指南[9],停用硫唑嘌呤、托法替布、环孢素、吗替麦考酚酯等免疫抑制剂及生物制剂,视病情保留或停用甲氨蝶呤、羟氯喹、他克莫司、来氟米特等免疫抑制剂,有激素使用史者将口服激素(如甲泼尼龙或泼尼松)调整为静脉滴注氢化可的松。
对于合并其他疾病的患者积极作相应处理,例如,合并心脏病的患者完善心电图和超声心动图检查,合并脑血管疾病的患者完善磁共振血管成像检查。术前由麻醉科医生根据美国麻醉医师协会(ASA)分级评估患者状态,确保患者可耐受手术。
1.2.2 术中
在确认患者信息无误后,通过静脉滴注给予头孢呋辛。全身麻醉后,患者取侧卧位并固定骨盆。对术区进行常规消毒、铺巾和皮肤保护。采用髋部后外侧切口,依次切开、分离皮肤、皮下组织及髂肌后群,显露关节囊后予以切开,进行手法脱位。测量后截断股骨颈并取出股骨头。切除病变滑膜、增生的关节囊、髋臼盂唇、臼缘骨赘及纤维组织,使用两枚克氏针辅助固定,充分显露卵圆窝、髋臼底及骨性臼缘。依次锉磨髋臼,将金属髋臼杯以适当的前倾角和外展角植入髋臼进行试模。确保髋臼杯固定牢固后,安装陶瓷内衬并固定牢靠。屈曲、内收并内旋髋关节,充分显露股骨颈截骨面,在偏后外侧开髓。通髓腔后,依次使用近端髓腔锉扩髓,安放股骨颈试模并测量颈长。复位后测试髋关节的张力、活动度、稳定性和下肢长度。结果满意后,植入同型号股骨柄假体并打牢,随后安装同型号股骨头假体,复位髋关节,再次测试髋关节的活动度、稳定性、张力及下肢长度。结果满意后,用大量生理盐水冲洗伤口,并用含阿米卡星的生理盐水冲洗关节腔后吸净液体,彻底止血,再用氨甲环酸盐水浸泡创面。缝合重建髂肌后群,逐层缝合关闭切口。术中持续进行自体血回输,手术结束时不常规放置引流管。
1.2.3 术后
术后第1、3、5天常规行血常规、红细胞沉降率、C反应蛋白、肝/肾功能、凝血等实验室检测并观察切口愈合情况,血红蛋白低于70 g/L的患者行同种异体红细胞输注治疗。术后常规预防性使用抗生素3 d,口服抗凝药利伐沙班、镇痛药塞来昔布/艾瑞昔布2周。对于SLE患者,遵风湿免疫科会诊意见,术后1~3 d将静脉滴注氢化可的松调整为术前口服激素方案,术后1~2周视SLE活动程度、有无感染征象、切口愈合程度等情况恢复免疫抑制剂。术后第1天即鼓励患者拄拐下床活动,嘱咐患者站立、行走时注意肢体位置,谨防脱位和跌倒。
1.3 观察指标
以主要并发症(局部并发症和系统并发症)以及同种异体红细胞输注情况作为结局指标。局部并发症包括切口不良事件、假体周围感染、假体松动、假体周围骨折等。系统并发症包括深静脉血栓形成、肺血栓栓塞症、急性心血管事件、脑血管事件、肺炎、肾功能损伤、肝功能损伤、泌尿系统感染、SLE病情活动等。
1.4 偏倚控制
本研究在研究设计、数据处理过程中采取以下方法控制偏倚:首先,依据明确的纳入和排除标准筛选研究对象;其次,通过倾向性评分匹配研究对象,以最小化混杂因素的影响;最后,数值型数据由一名研究者独立录入,并由另一名研究者校对,影像学资料则由两名研究者共同评估并达成一致意见,确保所有指标的准确性和可靠性。
1.5 样本量估算
根据既往国内一项单中心研究[5],该研究具有良好的匹配度,SLE组术后主要并发症发生率为23%,而对照组为7%。采用PASS 2021软件进行样本量估算,设定显著性水平α=0.05,检验效能1-β=0.9,计算得出每组所需最低样本量为103例。
1.6 统计学处理
采用SPSS 26.0软件进行统计学分析。计量资料采用Shapiro-Wilk检验评估数据是否符合正态分布,年龄、体质量指数(BMI)等符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;SLEDAI评分、C反应蛋白、D-二聚体等符合偏态分布的计量资料以中位数(四分位数)表示,组间比较采用非参数检验。计数资料以频数(百分数)表示,组间比较采用卡方检验或Fisher确切概率法。采用倾向性评分法对SLE组和对照组患者进行性别、年龄、手术侧别1:1匹配,匹配容差设为0.02,比较两组主要并发症以及同种异体红细胞输注情况。双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 SLE组患者基本情况
根据纳入和排除标准,研究组共入选270例SLE患者,平均年龄(37.8±12.1)岁,SLE病程为8.7(4.0,12.0)年,SLEDAI评分为0.16(0,0)。围术期糖皮质激素使用率为77.04%(表1)。
表1 270例行THA术的SLE患者基本特征

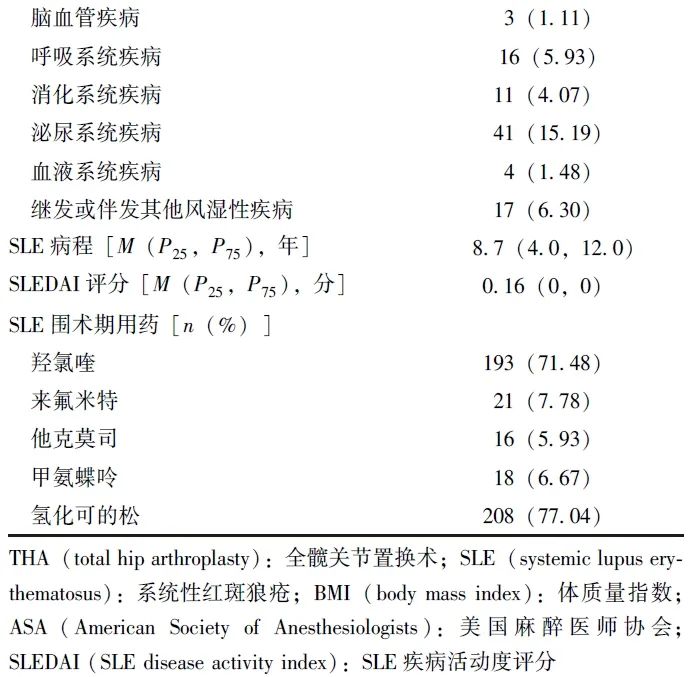
18例(6.67%)患者在术后30 d内出现主要急性并发症,其中2例(0.74%)患者发生上呼吸道感染;2例(0.74%,其中1例发生感染性休克)患者发生肺部感染;3例(1.11%)患者出现泌尿系感染;2例(0.74%)患者出现其他系统感染;1例(0.37%)患者应激性溃疡伴出血;5例(1.85%)患者发生切口愈合不良;1例(0.37%)患者发生切口感染;1例(0.37%)患者输注血小板后出现休克;1例(0.37%)患者出现SLE病情活动。所有患者经积极保守治疗后均好转出院。61例(22.59%)患者接受了同种异体红细胞输注。
2.2 倾向性评分后SLE组与对照组基线特征比较
根据纳入和排除标准,对照组共入选862例患者,经倾向性评分进行1:1匹配后,最终SLE组和对照组各163例患者纳入分析。基本特征方面,SLE组患者病程为9.8(4.0,14.0)年,SLEDAI评分为0.19(0,0),围术期糖皮质激素使用率为92.64%,BMI指标显著低于对照组(P<0.001)。
在内科合并症方面,SLE组骨质疏松、呼吸系统、消化系统、泌尿系统、血液系统和继发或伴发其他风湿性疾病伴发率明显高于对照组(P均<0.05),其中呼吸系统受累主要为间质性肺病、肺动脉高压、肺血栓栓塞症,泌尿系统受累主要为狼疮性肾炎,风湿性疾病主要包括干燥综合征和抗磷脂抗体综合征。
实验室检测显示,SLE组的术前血小板计数、淋巴细胞计数、血红蛋白水平、红细胞压积、白蛋白水平、血糖水平和活化部分凝血活酶时间均显著低于对照组,而C反应蛋白、红细胞沉降率和D-二聚体水平显著高于对照组(P均<0.05)。在手术相关指标方面,SLE组的ASA分级较高,手术时间较短,术中出血量较少(P均<0.05),详见表2。
表2 倾向性评分匹配后SLE组和对照组基线特征比较


2.3 SLE组和对照组主要并发症及同种异体红细胞输注情况
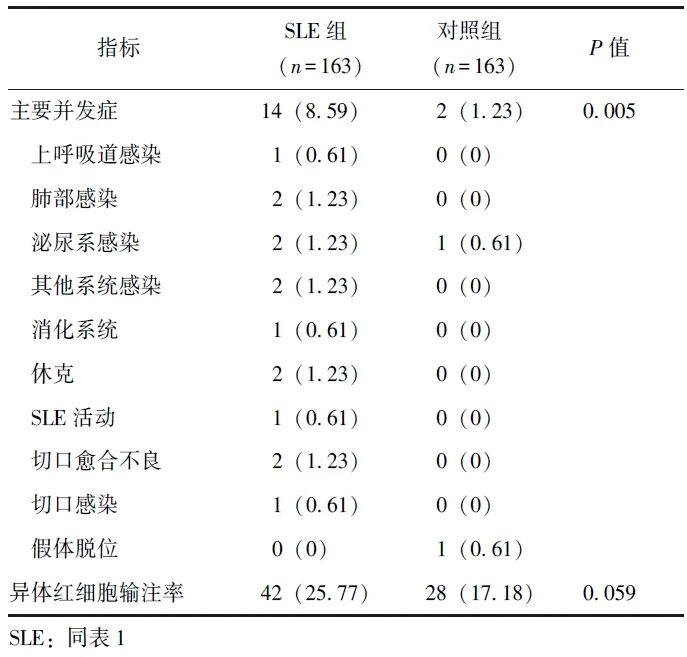
术后并发症方面,SLE组术后30 d内主要急性并发症发生率显著高于对照组(8.59%比1.23%,P=0.005),相对危险度为1.081(95% CI: 1.028~1.136)。SLE组中,14例(8.59%)患者在术后30 d内出现主要急性并发症,包括1例(0.61%)上呼吸道感染;2例(1.23%)肺部感染,其中1例(0.61%)伴感染性休克;2例(1.23%)泌尿系感染;2例(1.23%)其他系统感染;1例(0.61%)应激性溃疡伴出血;2例(1.23%)切口愈合不良;1例(0.61%)切口感染;1例(0.61%)因输注血小板出现过敏性休克;1例(0.61%) SLE病情活动。
相比之下,对照组中仅2例(1.23%)患者出现主要并发症,包括1例(0.61%)泌尿系感染和1例(0.61%)假体脱位。所有患者经积极保守治疗后均好转出院。此外,SLE组同种异体红细胞输注率与对照组差异无统计学意义(25.77%比17.18%,P=0.059)。详见表3。
表3 倾向性评分匹配后SLE组和对照组主要并发症及输血情况[n(%)]
3 讨论
本研究分析了270例行THA术的SLE患者临床资料,发现患者术前SLEDAI评分为0.16分,围术期糖皮质激素使用率为77.04%,说明行THA术的SLE患者术前病情相对稳定。采用倾向性评分匹配法,分析SLE患者在THA后30 d内主要急性并发症的发生率及其影响因素,结果显示,在匹配前,SLE组并发症发生率为6.67%,61例(22.59%)接受同种异体红细胞输注。
在性别、年龄、手术侧别匹配后,内科合并症方面,与对照组相比,SLE组在骨质疏松、呼吸系统、消化系统、泌尿系统、血液系统和继发或伴发其他风湿性疾病上存在显著差异,这符合SLE多器官受累的特征[16]。
术前实验室检测显示,SLE组的血小板计数、淋巴细胞计数、血红蛋白、红细胞压积、白蛋白、血糖和活化部分凝血酶时间指标均低于对照组,而C反应蛋白、红细胞沉降率和D-二聚体水平较高,提示SLE组患者存在血液系统抑制、营养不良、炎症和高凝状态。
手术相关指标方面,SLE组的ASA分级较高,但手术时间短,术中出血量少。并发症方面,SLE组术后30 d内主要急性并发症发生率显著高于对照组(8.59%比1.23%,P=0.005),差异具有统计学意义,相对危险度为1.081(95% CI: 1.028~1.136),而同种异体红细胞输注率与对照组无显著差异(25.8%比17.2%,P=0.059)。
近年大量研究显示,SLE患者由于其独特的病理生理特性,包括免疫功能紊乱、多系统受累以及长期激素和/或免疫抑制剂的使用,THA术后并发症的发生风险显著增加[1-3,5,9,16],如各系统并发症、感染、切口不良事件及同种异体输血等。本研究中,SLE组主要并发症以感染和切口不良事件为主,与既往报道一致。
此外,本研究还发现,SLE患者的术前红细胞压积、血红蛋白及白蛋白水平均显著低于对照组,提示其营养状态较差,这可能进一步增加术后感染的风险。切口不良事件在SLE患者中较为常见,包括切口延迟愈合和切口感染,可能与SLE患者长期使用激素导致的皮肤脆性及血管炎症相关[3,13]。本研究显示,SLE组切口愈合不良发生率为1.85%,低于既往报道的4.30%~8.88%[1,17]。
值得注意的是,SLE病情活动是SLE患者接受THA的特有并发症。手术应激、药物控制不佳、感染等因素可能导致SLE复发,本研究中表现为狼疮性肾炎加重和补体水平降低,但发生率显著低于既往报道的2.27%[18]。这些差异可能得益于严格的围术期管理,如合理调整糖皮质激素用量、停用部分免疫抑制剂[9,19]以及术中应用第二代头孢菌素预防感染。
SLE患者因病理性贫血和术中失血导致的输血需求是围术期关注的重点[2-3,6,16]。研究认为,SLE贫血主要与狼疮累及血液系统及肾功能不全导致促红细胞生成素生成减少有关[20]。此外,SLE患者可能由于血小板功能下降及抗凝血因子抗体的存在,因在围术期出血而引发贫血[1,21]。然而,本研究结果显示,尽管SLE组术前血红蛋白水平显著低于对照组,但两组术后输血率差异并无统计学意义。这可能与术中总体出血量较少,以及合理使用氨甲环酸和血液回收系统等有效措施有关。
本研究存在一定的局限性。首先,本研究为回顾性研究,样本量相对较小,可能存在选择偏倚。其次,未对SLE及其他合并症的活动情况及疾病分期情况作分层分析,影响了结果的全面性和准确性。最后,本研究匹配的SLE病例中,SLEDAI最高仅为4分,无法代表病情控制不佳的SLE患者,可能低估了SLE病情活动患者的术后风险。
综上,本研究显示SLE患者行THA术后30 d内并发症发生率为8.59%,显著高于非SLE患者,而同种异体红细胞输注率相当。为保证SLE患者THA手术安全性,应尽可能在术前将患者病情控制稳定,并遵循指南进行严格的围术期管理。
参考文献
[1]Cai Y R, Ding Z C, Rong X, et al. Does systemic lupus erythematosus increase the risk of complications from total hip arthroplasty?[J]. BMC Musculoskelet Disord, 2021, 22(1): 457.
[2]Viswanathan V K, Sakthivelnathan V, Menedal A, et al. How does systemic lupus erythematosus impact the peri-operative complication rates in primary hip arthroplasty? A national inpatient sample-based study[J]. Arch Orthop Trauma Surg, 2023, 143(4): 2209-2216.
[3]Kasturi S, Goodman S. Current perspectives on arthroplasty in systemic lupus erythematosus: rates, outcomes, and adverse events[J]. Curr Rheumatol Rep, 2016, 18(9): 59.
[4]Chen C H, Chen T H, Lin Y S, et al. The impact of systemic lupus erythematosus on the risk of infection after total hip arthroplasty: a nationwide population-based matched cohort study[J]. Arthritis Res Ther, 2020, 22(1): 214.
[5]Gu J M, Zhang S H, Chen L, et al. Performing a safe and effective total hip arthroplasty on patients with inactive or stably active systemic lupus erythematosus with osteonecrosis[J]. J Am Acad Orthop Surg, 2021, 29(10): 423-432.
[6]Merayo-Chalico J, Gónzalez-Contreras M, Ortíz-Hernández R, et al. Total hip arthroplasty outcomes: an 18-year experience in a single center: is systemic lupus erythematosus a potential risk factor for adverse outcomes?[J]. J Arthroplasty, 2017, 32(11): 3462-3467.
[7]Mertelsmann-Voss C, Lyman S, Pan T J, et al. Arthroplasty rates are increased among US patients with systemic lupus erythematosus: 1991—2005[J]. J Rheumatol, 2014, 41(5): 867-874.
[8]Chen D Q, Cancienne J M, Werner B C, et al. Is osteonecrosis due to systemic lupus erythematosus associated with increased risk of complications following total hip arthroplasty?[J]. Int Orthop, 2018, 42(7): 1485-1490.
[9]Goodman S M, Springer B D, Chen A F, et al. 2022 American College of Rheumatology/American Association of Hip and Knee Surgeons guideline for the perioperative manage-ment of antirheumatic medication in patients with rheumatic diseases undergoing elective total hip or total knee arthroplasty[J]. Arthritis Care Res (Hoboken), 2022, 74(9): 1399-1408.
[10]Belmont P J, Goodman G P, Hamilton W, et al. Morbidity and mortality in the thirty-day period following total hip arthroplasty: risk factors and incidence[J]. J Arthroplasty, 2014, 29(10): 2025-2030.
[11]Kang Y, Zhang Z J, Zhao X Y, et al. Total hip arthroplasty for vascular necrosis of the femoral head in patients with systemic lupus erythematosus: a midterm follow-up study of 28 hips in 24 patients[J]. Eur J Orthop Surg Traumatol, 2013, 23(1): 73-79.
[12]Kurtz S, Ong K, Lau E, et al. Projections of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030[J]. J Bone Joint Surg Am, 2007, 89(4): 780-785.
[13]Schnaser E A, Browne J A, Padgett D E, et al. Periopera-tive complications in patients with inflammatory arthropathy undergoing total hip arthroplasty[J]. J Arthroplasty, 2016, 31(10): 2286-2290.
[14]Chen D Y, Xie J Y, Chen H H, et al. Infection in southern Chinese patients with systemic lupus erythematosus: spectrum, drug resistance, outcomes, and risk factors[J]. J Rheumatol, 2016, 43(9): 1650-1656.
[15]Johnson D J, Hartwell M J, Weiner J A, et al. Which postoperative day after total joint arthroplasty are catastrophic events most likely to occur?[J]. J Arthroplasty, 2019, 34(10): 2466-2472.
[16]Sodhi N, Anis H K, Coste M, et al. Thirty-day complica-tions in osteonecrosis patients following total hip arthroplasty[J]. J Arthroplasty, 2020, 35(8): 2136-2143.
[17]Anderson C G, Jang S J, Brilliant Z R, et al. Complication rate after primary total hip arthroplasty using the posterior approach and enabling technology: a consecutive series of 2,888 hips[J]. J Arthroplasty, 2023, 38(S7): S119-S123.e3.
[18]Issa K, Naziri Q, Rasquinha V J, et al. Outcomes of primary total hip arthroplasty in systemic lupus erythematosus with a proximally-coated cementless stem[J]. J Arthroplasty, 2013, 28(9): 1663-1666.
[19]Salt E, Wiggins A T, Rayens M K, et al. Moderating effects of immunosuppressive medications and risk factors for post-operative joint infection following total joint arthroplasty in patients with rheumatoid arthritis or osteoarthritis[J]. Semin Arthritis Rheum, 2017, 46(4): 423-429.
[20]Li Z, Du Y, Xiang S, et al. Risk factors of perioperative complications and transfusion following total hip arthroplasty in systemic lupus erythematosus patients[J]. Lupus, 2019, 28(9): 1134-1140.
[21]Meyerhoff J, Dorsch C A. Decreased platelet serotonin levels in systemic lupus erythematosus[J]. Arthritis Rheum, 1981, 24(12): 1495-1500.
Semin Arthritis Rheum:系统性红斑狼疮胃肠道表现的现有治疗证据的汇总分析
![]() 0
2024-12-15
点击查看
0
2024-12-15
点击查看

新更:系统性红斑狼疮损伤指数(SDI)
![]() 0
2025-01-03
点击查看
0
2025-01-03
点击查看

系统性红斑狼疮患者新发血小板减少症风险预测模型
![]() 0
2025-01-10
点击查看
0
2025-01-10
点击查看

European Radiology:定量心脏磁共振成像生物标志物在系统性红斑狼疮中的诊断和预后价值
![]() 0
2025-01-11
点击查看
0
2025-01-11
点击查看

罕见病专栏|系统性红斑狼疮伴微管聚集1例报告并文献复习
![]() 0
2025-01-18
点击查看
0
2025-01-18
点击查看

Rheumatology:贝利尤单抗在西班牙系统性红斑狼疮患者临床治疗中的疗效与安全性
![]() 0
2025-01-20
点击查看
0
2025-01-20
点击查看
