在1月下旬的《自然》杂志上,来自日本庆应义塾大学医学院的Kenya Honda博士带领团队发表研究,他们找到了11株肠道微生物,能够增加CD8+T细胞的水平,增强由它介导的抗肿瘤免疫反应,抑制肿瘤进展的效果与免疫检查点抑制剂持平,甚至更好!两者联合使用时,抗肿瘤效果更加优秀。

Kenya Honda博士
在过去的研究中,研究人员们大多关注的是CD4+T细胞,对肠道微生物与CD8+T细胞的相互作用了解的很少,但其实,微生物介导的CD8+T细胞的激活在宿主抵抗病原体感染和抗肿瘤免疫反应中也发挥着非常重要的作用。与主要发挥“辅助”作用的CD4+T细胞(辅助T细胞)不同,CD8+T细胞也叫作细胞毒性T细胞,可以直接杀死癌细胞和被病毒等感染的细胞。
在这次的研究中,研究人员首先招募了六名健康的志愿者,采集了他们的粪便样本,再分别移植给无菌小鼠。结果发现,小鼠们产生干扰素γ的CD8+T细胞(INFγ+CD8 T细胞)的水平相差不少,其中移植了第二名志愿者粪便样本的小鼠水平最高。
毫无疑问,接下来的工作就是要找到提高了INFγ+CD8 T细胞水平的具体肠道微生物了。经过抗生素处理、16S rRNA测序和一系列筛选,研究人员初步锁定了26株菌株,在它们中,通过不同的组合和实验分析,最终,有11株脱颖而出,它们与INFγ+CD8 T细胞水平呈最强的正相关关系。
不仅如此,研究人员还发现,这11株菌株组成了一个“联合体”(11-mix),它们共同发挥作用,其中,4株非拟杆菌目的细菌是联合体的“核心”(4-mix),另外7株拟杆菌目的细菌(7-mix)则扮演着“支持者”的角色。
11-mix就是我们要的!
找到了这11株菌株之后,研究人员开始着手证明它们抵抗病原菌和抗肿瘤的效果。他们将单核细胞增多性李斯特氏菌(Listeria monocytogenes,简称单增李斯特菌)分别喂给无菌小鼠、移植了11株菌株(11-mix)的小鼠和移植了26株菌株中其他10株(10-mix)的小鼠,单增李斯特菌是冷藏食品中一种主要的病原菌,感染后表现出单核细胞增多,会导致脑膜炎和败血症。
喂食后的第一天,小鼠们就开始萎靡不振,体重明显下降,但是从第二天开始,11-mix组小鼠的CD8+T细胞就夺回了主动权,它们的体重不再下降,而另外两组小鼠则越降越厉害。当通过抗体消除了CD8+T细胞之后,11-mix的保护作用也就消失了。
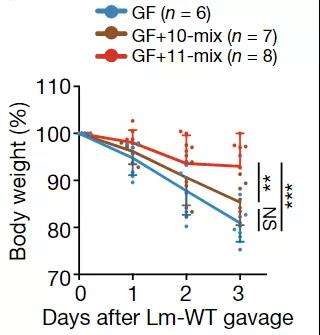
喂食单增李斯特菌后,小鼠体重随时间(天)下降的百分比,GF为无菌小鼠
在证明抗肿瘤效果的实验中,研究人员首先选择了结直肠癌细胞(MC38细胞),给无菌小鼠注射癌细胞后,为了全方位多角度地展示11-mix的优秀,研究人员将小鼠分为了6组,分别是什么都不做,任由肿瘤肆意生长的对照组;使用PD-1抗体治疗组;11-mix组;PD-1抗体+11-mix组;10-mix组和PD-1抗体+10-mix组。
这样一来,结果一方面体现出了,在不使用PD-1抗体的情况下,11-mix本身就有不错的抗肿瘤效果,甚至比单独使用PD-1抗体效果还要好!另一方面,与PD-1抗体联用之后,在20天的观察期内,肿瘤的大小更是几乎没有发生变化,而其他几组的增长曲线都快起飞了。
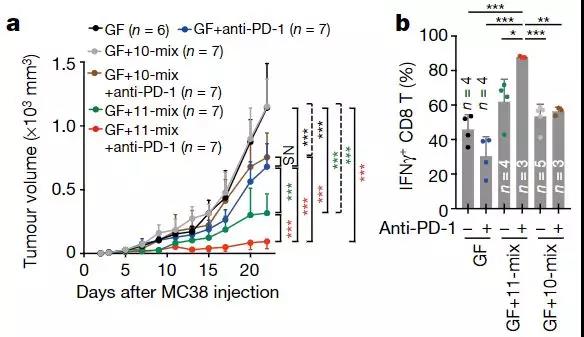
a:MC38细胞注射后,肿瘤体积随着时间(天)的变化,GF为无菌小鼠
b:6组小鼠TNFγ+CD8 T细胞水平的对比
类似的结果也表现在了本身携带肠道微生物组的无特定病原体(SPF)小鼠中,不过因为自身肠道微生物的存在,所以11-mix移植后的效果比无菌小鼠移植后的效果要差一些(但还是相当不错的)。研究人员将PD-1抗体换成了更老牌的免疫检查点抑制剂——CTLA-4抗体后,几个组间抗肿瘤效果的对比也没有发生明显改变。同样的治疗效果在黑色素瘤模型小鼠中也得到了验证。

d:MC38细胞注射后,SPF小鼠肿瘤体积随着时间(天)的变化
e:6组小鼠TNFγ+CD8 T细胞水平的对比
不过,斯坦福大学的研究人员提出,如果它们应用在临床上,还有一些潜在的隐患需要特别注意,例如,免疫检查点抑制剂的一大副作用是出现自身免疫反应,INFγ+CD8 T细胞水平的增加是否会加剧这种副作用?另外,细菌移植前需要使用抗生素对患者进行预处理,让细菌能够顺利地定植,这种处理可能会增加患者病原菌(如艰难梭菌)感染的风险。这些都还需要在未来的试验中进行验证,找到能够平衡疗效与风险的方法。
但总的来说,它仍然是一个“突破性”的进展,因为这是首次鉴定出的,一个可以增强免疫检查点抑制剂效果的人类肠道细菌“联合体”,它们为利用肠道微生物治疗癌症这个愿景提供了又一条可行的通路。
原始出处:Takeshi Tanoue, Satoru Morita, Damian R. Plichta, et al. A defined commensal consortium elicits CD8 T cells and anti-cancer immunity. Nature. 23 January 2019
10亿海外医疗骗局:抗癌神药是糖每粒2元,一盒40万
![]() 0
2019-01-03
点击查看
0
2019-01-03
点击查看

Nature Nanotechnology:DNA检测能够判断抗体的有效性
![]() 0
2019-01-17
点击查看
0
2019-01-17
点击查看

J Natl Cancer I:维E抗癌可不能乱吃!5万人20年的数据表明,有特定基因突变补充维生素E才能降低癌症风险,否则不降反升
![]() 0
2019-01-27
点击查看
0
2019-01-27
点击查看

美国癌症协会:2030年癌症控制策略
![]() 0
2019-02-12
点击查看
0
2019-02-12
点击查看
Nat Commun:开发靶向FZD/SMO抗癌药物新思路!
![]() 0
2019-02-14
点击查看
0
2019-02-14
点击查看

关注儿童癌症 我们可以做些什么?
![]() 0
2019-02-15
点击查看
0
2019-02-15
点击查看
