引言
在现代医学研究中,免疫系统的作用日益受到关注,特别是在与人体健康紧密相关的肠道环境中。肠道不仅是人体重要的消化器官,也是免疫系统活跃的战场。肠道免疫系统必须在维持对共生微生物的容忍和防御入侵病原体之间找到微妙的平衡。在这一过程中,调节性T细胞(Treg cells)扮演了不可或缺的角色。Treg细胞是一类具有免疫抑制功能的T细胞,能够维持免疫耐受和防止自身免疫疾病。然而,肠道环境的复杂性对Treg细胞的功能提出了特别的挑战。4月3日发表在Nature杂志上的研究“Immune microniches shape intestinal Treg function”,深入探讨了肠道中免疫微生态位对Treg细胞功能的影响。
研究团队利用活体成像(in vivo live imaging)、光激活导向的单细胞RNA测序(photo-activation-guided single-cell RNA sequencing)和空间转录组学(spatial transcriptomics)等先进技术,追踪了对肝螺杆菌(Helicobacter hepaticus)反应的T细胞在耐受和炎症条件下的时空历程。研究发现,虽然抗原刺激可以在组织中的任何地方发生,但固有层(lamina propria,LP)而非淋巴聚集体(embedded lymphoid aggregates)是支持效应性Treg细胞(effector Treg,eTreg)功能的关键微生态位。
此外,研究还详细揭示了在肝螺杆菌定植后,LP微生态位支持IL-10的最高表达。通过对不同细胞群体在LP和LA(lymphoid aggregates)中的比例、CD11c和SIRPα免疫荧光和DAPI染色、以及CD206免疫荧光等方面的详细分析,研究揭示了肠道Treg细胞功能形成的细胞和分子基础。
这项研究不仅深化了我们对肠道免疫环境中Treg细胞作用的理解,也为炎症性肠病等肠道疾病的治疗提供了新的视角。通过揭示微生态位如何塑造肠道Treg细胞的功能,这项研究为未来开发针对性的免疫调节疗法提供了基础。

Highlights
发现肠道固有层(lamina propria,LP)是影响效应T调节细胞(eTreg cells)功能的关键微生态位(microniche)。这一发现突破了对Treg细胞功能区域依赖性的传统认识。
通过活体成像、光激活引导的单细胞RNA测序(photo-activation-guided single-cell RNA sequencing)和空间转录组学(spatial transcriptomics)的应用,揭示了针对肝螺杆菌反应的T细胞在容忍和炎症状态下的时空动态。
揭示了CD206+巨噬细胞与eTreg细胞在LP中的相互作用,这种相互作用对于维持肠道的耐受性至关重要。
识别并验证了可能调控CD206+巨噬细胞与eTreg细胞相互作用的受体-配体对(receptor–ligand pairs),为开发新一代耐受性诱导疗法提供了线索。
利用T细胞受体(TCR)转基因小鼠作为模型,追踪特定抗原反应的T细胞,提供了关于Treg细胞在肠道组织微环境中如何获得并维持效应功能的深入了解。
这项研究不仅为理解肠道免疫耐受的机制提供了新的视角,也为治疗炎症性肠病等免疫相关疾病提供了可能的治疗靶点。
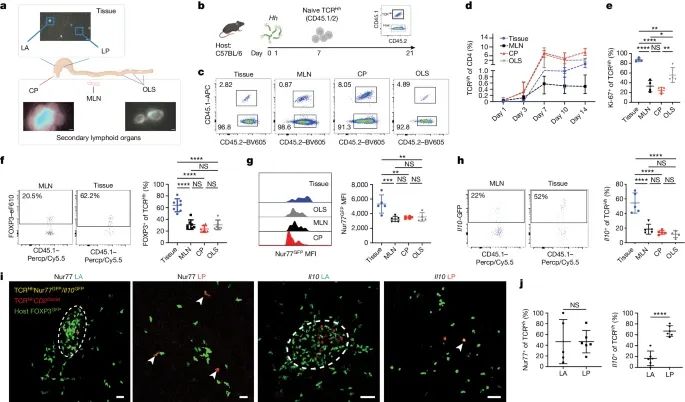
LP微环境在响应 Hh定植后,对 IL-10产生的支持作用。
a) 通过组织和淋巴结构的示意图以及 CD2 DsRed 小鼠中 CP(盲肠斑块)、有组织的淋巴结构和 LAs(淋巴聚集体)的代表性图像来展示小鼠肠道的解剖结构;
b) 将未经历过反应的 TCR Hh T 细胞转移至 Hh 定植的宿主中的示意图;
c) 在转移未经历过反应的 TCR Hh T 细胞后 14 天,在指定部位对 TCR Hh T 细胞进行的代表性荧光激活细胞分选(FACS)图谱;
d) 转移未经历过反应的 TCR Hh T 细胞后,在指定时间点,TCRHh 细胞在总 CD4 T 细胞中的频率;
e) 转移未经历过反应的 TCR Hh T 细胞后 14 天,在指定部位 Ki-67+ TCR Hh 细胞的频率;
f) 转移未经历过反应的 TCR Hh T 细胞后 14 天,代表性 FACS 图谱(左)及 TCR Hh Treg 细胞频率(右);
g) 转移未经历过反应的 TCR Hh T 细胞后 11 天,代表性直方图叠加(左)及 TCR Hh Nur77-GFP T 细胞的 GFP 平均荧光强度(MFI)(右);
h) 转移未经历过反应的 TCR Hh T 细胞后 11 天,代表性 FACS 图谱(左)及 TCR Hh T 细胞中 Il10+ 细胞的频率(右);
i) LA 和 LP 中的 TCRHh Nur77-GFP(左侧和中左)及 TCRHhIl10GFP(中右侧和右侧)T 细胞的代表性图像。TCR Hh Nur77-GFP 和 Il10-GFP 阳性细胞由白色箭头指示。
j) 在 LA 和 LP 中,TCR Hh T 细胞中 Nur77-GFP(左)和 Il10-GFP 阳性(右)细胞的频率。
这些数据通过多个独立实验的汇总,反映了 LP 微环境在激活 TCRHh T 细胞和促进其产生 IL-10 方面的关键作用,强调了肠道免疫耐受中 Treg 细胞功能的空间特异性。(Credit: Nature)
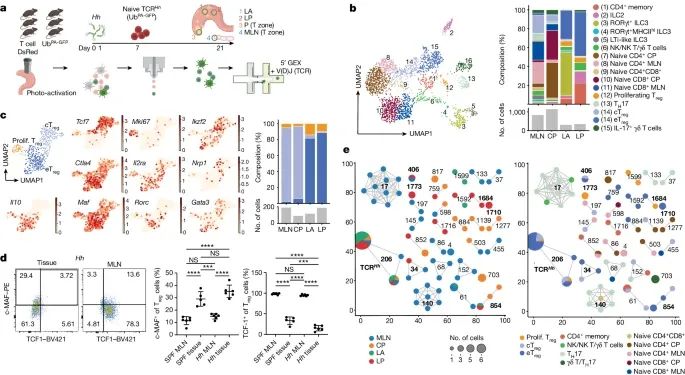
cTreg(中心调节性T细胞)和 eTreg(效应调节性T细胞)细胞群体在转录水平和空间分布上的区别。强调了 cTreg 和 eTreg 细胞在功能上和空间上的区分,说明了它们在免疫系统中的不同角色和特性。通过光激活、细胞排序和单细胞RNA测序等技术手段,能够详细描绘这些细胞群体的转录特征和在组织中的分布情况,从而提供了关于它们如何在维持免疫稳态和应对外界挑战中发挥作用的重要见解。
a) 通过示意图描述了 TCR Hh CD2 DsRed UbPA-GFP T 细胞转移到六个经过光激活的 CD2 DsRed UbPA-GFP 宿主中,随后进行细胞排序和单细胞RNA测序(scRNA-seq)的过程。图中提及了树突状细胞(DC)、淋巴(lymph)、巨噬细胞(Mac)、单核细胞(Mono)等免疫细胞类型。
b) 通过 UMAP可视化展示了所有位置上的 T 细胞和固有淋巴细胞(ILC)亚群。左侧是 T 细胞和 ILC 亚群的 UMAP 分布图,右侧展示了淋巴亚群的分布(上)和细胞数量(下),包括自然杀伤细胞(NK)。
c) UMAP 可视化显示了所有位置上的 Treg 细胞亚群(左上),并将选定基因的表达数据覆盖在 UMAP 图上(中间;颜色显示相对表达水平)。右侧展示了 Treg 细胞亚群的分布(上)和细胞数量(下)。
d) 左侧是 Hh 定植小鼠组织和 MLN(肠系膜淋巴结)中 Treg 细胞的 c-MAF 与 TCF1 的代表性 FACS(荧光激活细胞分选)图。中间和右侧分别显示了 SPF(无特定病原体)和 Hh 定植小鼠组织与 MLN 中 c-MAF+ 和 TCF1+ Treg 细胞的频率。
e) TCR Hh T 细胞和宿主克隆在不同位置(左侧)和细胞表型(右侧)的克隆型网络分析。每个完全连接的子网络代表一个“克隆型簇”,每个点代表具有相同受体的细胞。为了便于可视化,过滤掉了少于两个细胞的克隆型。(Credit: Nature)
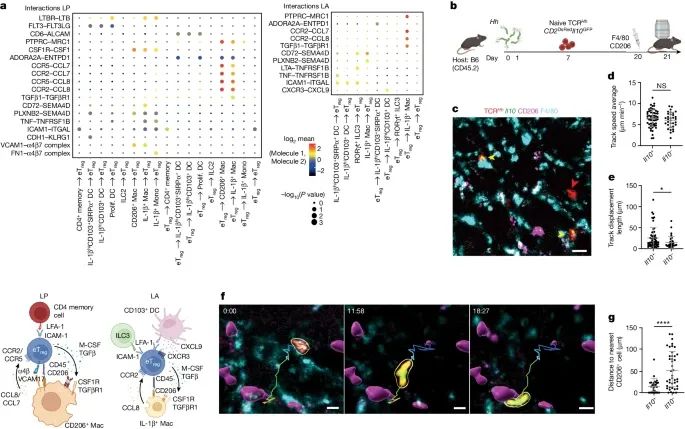
通过活体成像展示了在LP中,表达IL-10的 TCR Hh T 细胞与 CD206+ 巨噬细胞之间的相互作用。
a) 通过 CellPhoneDB 分析了 LP(左上)和LA(右上)中细胞间的受体-配体互作,这一分析限制于每个区域中超过 30 个细胞的细胞类型,并且仅考虑了 P 值小于 0.01 的唯一配对。MHCII 互作被排除在外。底部的示意图总结了最相关的细胞间互作。
b) 采用双光子活体成像技术,观察了转移至 Hh-定殖宿主体内并在体内用 CD206 和 F4/80 荧光抗体标记的 TCR Hh CD2-DsRed Il10-GFP T 细胞。
c) 供体 TCR Hh CD2-DsRed Il10-GFP T 细胞在 LP 中的代表性图像。箭头指示了不表达 IL-10 的 TCR Hh(红色)和表达 IL-10 的 TCR Hh(黄色)T 细胞。
d) LP 中 Il10+ 和 Il10- TCR Hh T 细胞的平均轨迹速度。
e) LP 中 Il10+ 和 Il10- TCR Hh T 细胞的轨迹位移长度。
f) 通过一系列视频静帧展示了一个 Il10+ TCR Hh T 细胞在 LP 中从一个 CD206+ 细胞移动到另一个 CD206+ 细胞。(标尺为 10 微米)
g) 部分测量了 LP 中 Il10+ 和 Il10- TCR Hh T 细胞与最近的 CD206+ 细胞之间的距离。
(Credit: Nature)
Strategies
该研究旨在探究免疫微环境如何塑造肠道调节性T细胞(Treg cells)的功能,尤其关注肠道微生物对Treg细胞功能的影响以及如何在炎症性疾病中重建免疫耐受。研究团队采用了一系列方法来追踪对肝螺杆菌(Helicobacter hepaticus,一种肠道病原体)具有反应性的T细胞在时间和空间中的响应,并揭示了肠道固有层(Lamina propria)作为支持效应性Treg (eTreg) 细胞功能的关键微环境。
首先,研究者使用了活体成像(in vivo live imaging)技术,通过这种方式,能够直观地观察到T细胞在肠道组织中的分布和活动。接着,他们利用光激活导向的单细胞RNA测序(photo-activation-guided single-cell RNA sequencing)和空间转录组学(spatial transcriptomics)来细致地分析T细胞在免疫微环境中的表达谱。这些方法结合起来,为研究提供了一个高分辨率的视角,可以观察到T细胞如何在不同的微环境中被激活和分化。
研究发现,尽管抗原刺激(antigen stimulation)可以在组织中的任何地方发生,但正是固有层而非嵌入的淋巴聚集体(lymphoid aggregates)成为了支持eTreg细胞功能的关键微环境。eTreg细胞一旦在其微环境中稳定下来,即使在炎症条件下,它们也能保持稳定,但炎症的爆发会打破这种隔离,导致CD103+树突状细胞(dendritic cells)在固有层中占据主导地位。
此外,研究还探究了CD206+巨噬细胞与eTreg细胞在固有层中的潜在耐受性互动,并鉴定了可能调控这种相互作用的受体-配体对(receptor–ligand pairs)。通过这些方法,研究揭示了固有层中耐受性的空间机制,并展示了了解局部相互作用如何有助于下一代诱导耐受性治疗的发展。
Behind the Scenes
TCR转基因细胞作为Hh定植宿主中的观察窗口
研究团队追踪了TCR转基因细胞(TCR-transgenic cells)在肠道中的自然历史,以此作为Treg cells获取和维持免疫调节功能的一个模型。通过在解剖微小环境中检查这些细胞,研究揭示了关键相互作用对于增强效应性调节性T细胞(eTreg cells)的抗原刺激和效应功能至关重要。研究发现,cTreg到eTreg的分化轨迹是通过TCR转基因细胞发现的,并且在内源性调节性T细胞中找到了镜像,这表明基于微环境内相互作用的环境印迹可以推动调节性T细胞的表型。即使在效应性调节性T细胞中,固有层(LP)而非淋巴聚集体(LA)是增强效应性调节性T细胞功能的地点,包括产生AREG、GZMB和IL-10的能力。
此外,固有层在其细胞组成上是独特的,支持稳态下的耐受。这一发现强调了肠道免疫微环境在调节T细胞响应中的重要作用,特别是在对微生物的反应中。TCR转基因细胞在此环境中的行为提供了洞察肠道免疫调节机制的重要视角,特别是它们是如何通过与微环境中的其他细胞类型相互作用来获得和维持其调节功能的。
所以,TCR转基因细胞作为Hh定植宿主中的观察窗口,揭示了肠道免疫微环境特别是固有层在塑造调节性T细胞功能中的关键作用。这些发现对于理解肠道免疫调节和潜在的免疫干预具有重要意义。
关键相互作用对增强eTreg细胞抗原刺激和效应功能的重要性
该研究通过跟踪TCR Hh模型中的微生物反应性调节性T细胞(Treg cells),探究了它们在肠道中获得和维持免疫调节功能的自然历史。研究揭示了解剖微小环境(immune microniches)中关键相互作用对于增强效应型调节性T细胞(eTreg cells,)的抗原刺激和效应功能至关重要。研究发现,关键相互作用能够增强eTreg细胞的抗原刺激和效应功能。
cTreg(中心Treg细胞,lymphoid-associated Treg cells)与eTreg(效应型Treg细胞,tissue resident Treg cells)之间的差异化轨迹表明,环境印迹的重写基于微环境内的相互作用,促进了Treg细胞表型的形成。这种差异化过程反映在TCR Hh T细胞和内源性Treg细胞中,显示出基于Gata3-Rorc二分法的环境重写。特别地,eTreg细胞,而不是cTreg细胞,是增强eTreg细胞功能的场所,包括产生AREG、GZMB和IL-10。
肠固有层(lamina propria, LP)以其独特的细胞组成,在维持稳态时支持耐受性。研究通过不同的实验方法和分析,如NICHE-seq数据与其他研究结果的整合,对细胞类型进行空间映射,进一步理解了LP的独特性和功能。
所以,关键相互作用在eTreg细胞的抗原刺激和效应功能中起着决定性作用,特别是在LP中,这些相互作用对于eTreg细胞功能的增强尤为重要。通过分析解剖微环境中的细胞相互作用,该研究揭示了eTreg细胞在免疫调节中的关键作用及其潜在的机制。
环境印记重写对Treg表型的影响
研究团队追踪了TCRHh模型中微生物反应性Treg细胞(microorganism-reactive Treg cells)随着时间的推移在肠道中如何获得并维持免疫调节功能。通过对解剖微环境(anatomical microniches)中的细胞进行研究,研究揭示了关键相互作用对于增强eTreg细胞抗原刺激和效应功能的重要性。cTreg到eTreg的HH分化轨迹利用TCRHh T细胞和内源性Treg细胞确认了环境印记(environmental imprinting)基于微环境内相互作用的重写对Treg表型的影响,将这种模式叠加在Gata3-Rorc二分法之上。研究发现,即使在eTreg细胞中,相比于淋巴聚集区(lymphoid aggregates, LAs),肠道粘膜固有层(lamina propria, LP)是eTreg细胞功能增强的地点,包括AREG、GZMB和IL-10的产生。
这一发现表明,尽管Treg细胞具有一定的表型和功能稳定性,它们的表型和功能特性仍然可以根据所处微环境的具体条件而有所变化。微环境因素,如局部细胞间的相互作用和局部细胞因子的存在,可以重写Treg细胞的环境印记,从而影响它们的分化和功能。这种现象突出了微环境对于维持肠道免疫稳态的重要作用,特别是在调节Treg细胞的抗原特异性反应和抑制功能方面。通过在特定的解剖微环境中精细调控Treg细胞的功能,免疫系统能够更加有效地维持对共生微生物的容忍状态,同时防御侵袭性病原体。
eTreg细胞在LP中的功能增强
eTreg细胞在LP中的增强功能归因于几个关键因素:
免疫微环境的特异性调控:eTreg细胞在LP的功能增强与其所处的免疫微环境紧密相关。LP作为一个独特的免疫微环境,支持在稳态条件下维持耐受(tolerance)状态。LP中的eTreg细胞通过特定的细胞间相互作用和细胞因子(cytokines)反应,获得对抗炎症和促进免疫耐受的能力。
关键细胞因子和细胞间相互作用的作用:LP中的eTreg细胞产生的IL-10和与巨噬细胞(macrophages)的特定相互作用,尤其是与CD206+巨噬细胞的交互,对于eTreg细胞功能的增强至关重要。这些相互作用有助于eTreg细胞在LP中维持高效的抗炎和调节功能。
微环境特异性克隆扩展:在LP微环境中,特定的eTreg细胞克隆(clonotypes)获得扩展,表明LP中的微环境有助于eTreg细胞的克隆选择和扩展。这种克隆性扩展可能增强了eTreg细胞针对特定抗原的应答能力。
微环境促进的表型转换:LP中的微环境还促进了eTreg细胞从传统的调节性T细胞(cTreg)向效应型调节性T细胞(eTreg)的表型转换。这种转换伴随着功能相关基因,如AREG、GZMB和IL-10的表达上调,从而增强了eTreg细胞的抑制功能。
LP的独特细胞构成与耐受性支持
LP(Lamina Propria)的特殊细胞构成,尤其是调节性T细胞(Regulatory T cells)、CD206+巨噬细胞和产生IL-1β的细胞等,构成了一个耐受性微环境(tolerogenic niche),有助于eTreg细胞的增殖,以控制病理变化。
在LP的这个微环境中,IL-10产生的Treg细胞是活跃的,可以与CD206+巨噬细胞进行连续的相互作用。这种相互作用不仅限于物理接触,还包括通过CCR2–CCL8、VCAM1–α4β7和CD45–CD206等分子的吸引、粘附以及通过TCR–MHC和IL-10–IL10R等分子的免疫激活和控制。这种细胞间的通信和相互作用,强化了LP的耐受性环境,有助于肠道免疫系统的平衡和健康。
然而,在炎症条件下,LP的这一耐受性微环境会被干扰,例如在结肠炎(colitis)中,原本局限在LA(淋巴聚集区,Lymphoid Aggregates)中的CD103+树突状细胞会被招募进入LP,指出LP组织在粘膜耐受性中的关键作用。这种环境的变化可能导致炎症反应的加剧和疾病的发展。
通过在LP和LA微环境中对调节性T细胞的详细研究,该研究揭示了微环境对肠道Treg功能的塑造作用,以及这些微环境在维持肠道免疫稳态和耐受性中的重要性。
潜在的局限性
模型选择:该研究主要在野生型小鼠和特定转基因小鼠模型中进行,这可能限制了发现的普遍适用性。人类和小鼠之间的免疫系统存在差异,因此,研究结果在转化到人类免疫调节和疾病治疗时可能会遇到挑战。
空间分辨率:尽管使用了单细胞RNA测序(single-cell RNA sequencing)和空间转录组学(spatial transcriptomics)等高级技术,这些技术在揭示细胞在组织中确切位置和微生境特异性交互作用方面的空间分辨率仍有限。更高分辨率的成像技术可能会揭示更详细的细胞定位和互动信息。
动态监测:虽然该研究追踪了T细胞对肝螺杆菌(Helicobacter hepaticus)反应的自然历史,但对免疫细胞动态行为的监测还不够全面。实时动态监测技术,可能会提供关于细胞如何随时间在不同微生境中移动和互动的更多见解。
人群多样性:研究主要聚焦于特定的模型和条件,可能未能充分考虑基因背景、年龄、性别和环境因素等因素对免疫反应的影响。未来研究中,扩大样本范围和多样性可能有助于发现更广泛的、适用于不同人群的规律。
疾病相关性:研究主要集中在肠道内免疫耐受的机制,对于特定炎症性疾病,如炎症性肠病(Inflammatory Bowel Disease, IBD),其发现的直接适用性和治疗潜力仍需进一步验证。
潜在的研究方向
更深入地了解免疫微环境中各种细胞的相互作用:该研究揭示了CD206+巨噬细胞与eTreg细胞在LP中的相互作用对于维持耐受性至关重要。未来的研究可以进一步探索不同类型的免疫细胞,如树突细胞(dendritic cells)、自然杀伤细胞(NK cells)和肠道上皮细胞,如何在不同的微环境中相互作用,以及这些相互作用对于肠道免疫稳态的影响。
细胞和分子层面的机制研究:通过应用单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和空间转录组学(spatial transcriptomics),该研究开始揭示了影响Treg细胞功能的分子机制。未来研究可以进一步深入,研究特定的信号传导途径、转录因子和细胞间通讯分子(如细胞因子和化学因子),以及这些分子如何在不同的免疫微环境中调节Treg细胞的功能。
肠道微生物群与免疫系统的相互作用:该研究使用了肝螺杆菌(Helicobacter hepaticus)作为研究模型,这种细菌能够与宿主免疫系统建立长期的共生关系。未来的研究可以探索不同的肠道微生物(包括有益菌和致病菌)是如何影响肠道免疫细胞,特别是Treg细胞的功能和分化的。
免疫微环境在疾病中的作用:研究提到,在炎症性肠病(inflammatory bowel disease, IBD)等炎症性疾病中,免疫微环境的破坏会导致eTreg细胞功能的损失。未来的研究可以探索如何通过调节免疫微环境中的细胞相互作用和分子机制来治疗或预防这些疾病。
新型耐受诱导疗法的开发:该研究最终目标是通过了解肠道内免疫微环境中的局部相互作用,为开发下一代耐受诱导疗法奠定基础。未来的研究可以在此基础上,探索如何通过调节特定的免疫细胞或分子途径来促进免疫耐受,为治疗自身免疫性疾病、过敏性疾病和移植排斥反应等提供新的治疗策略。
耐受性与免疫记忆的关系:该研究强调了eTreg细胞在维持肠道免疫稳态中的重要性,但肠道免疫系统如何在保持对有益微生物和食物抗原耐受性的同时,还能快速有效地响应病原体入侵,是一个重要的研究问题。未来的研究可以探讨Treg细胞与免疫记忆细胞(如记忆T细胞)之间的相互作用,以及这种相互作用如何影响免疫系统的平衡和病原体清除。
微环境特异性免疫调节策略:研究表明,不同的肠道区域(如LP和LA)在维持免疫平衡中扮演着不同的角色。未来的研究可以探索针对特定微环境的免疫调节策略,以更精确地控制免疫反应,减少全身性免疫抑制副作用的风险。
原文链接
Gu Y, Bartolomé-Casado R, Xu C, Bertocchi A, Janney A, Heuberger C, Pearson CF, Teichmann SA, Thornton EE, Powrie F. Immune microniches shape intestinal Treg function. Nature. 2024 Apr 3. doi: 10.1038/s41586-024-07251-0. Epub ahead of print. PMID: 38570678.
https://www.nature.com/articles/s41586-024-07251-0