肝细胞癌是全球癌症相关死亡的最常见原因之一。大多数患者在诊断时因晚期或转移性疾病或在具有治愈目的的局部干预后疾病复发而需要全身治疗。多激酶抑制剂,例如索拉非尼和乐伐替尼在全球范围内被用于治疗无法切除的肝细胞癌患者。 PD-1 或程序性细胞死亡配体 1 (PD-L1) 抑制剂与不同的多激酶、血管内皮生长因子 (VEGF) 或细胞毒性 T 淋巴细胞相关抗原 4 (CTLA-4) 抑制剂已在这种情况下进行了评估。其中,阿特珠单抗(抗 PD-L1)加贝伐单抗(抗 VEGF)是第一个显示总生存期改善的药物。 sorafenib尽管在不可切除的肝细胞癌方面取得了治疗进展,但仍需要对这一具有不同种族、民族和危险因素的全球多样化人群进行额外的治疗。
CTLA-4 和 PD-L1 抑制剂组合显示出与互补免疫刺激作用相关的附加抗肿瘤活性。 在一项 2 期试验(NCT02519348)中,单次高启动剂量的曲美木单抗(抗 CTLA-4)加 durvalumab(抗 PD-L1)、一种称为 T300+D 或 STRIDE(单曲 Tremelimumab 定期间隔 Durvalumab)的方案和 durvalumab 单药疗法在既往接受过索拉非尼治疗或不适合接受索拉非尼治疗的不可切除肝细胞癌患者中显示出临床活性和可控的安全性。 这项随机、开放标签、申办者盲、多中心、全球性 3 期 HIMALAYA 试验 (NCT03298451) 旨在评估 STRIDE 和 durvalumab 单药治疗与索拉非尼治疗之前未接受过全身治疗的不可切除肝细胞癌患者的疗效。
研究方法
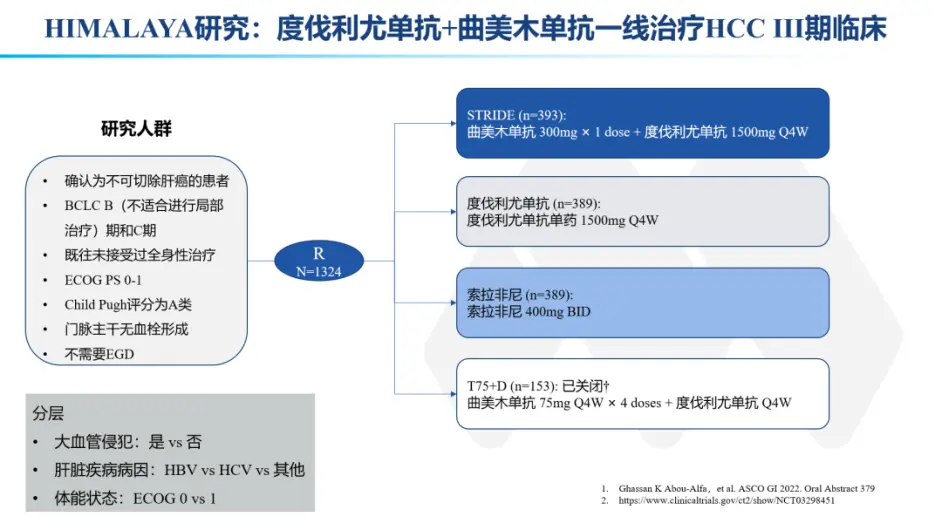
符合条件的患者年龄在 18 岁或以上,经组织学证实为肝细胞癌,既往未接受过全身治疗,不适合局部治疗。患者具有巴塞罗那诊所肝癌 B 期或 C 期,Child-Pugh 评分 A 级,东部肿瘤协作组 (ECOG) 体能状态评分为 0 或 1,并且根据实体瘤反应评估标准 1.1 版至少有一个可测量的病灶( RECIST v1.1).14 患者需要在筛查期间提供新鲜的活检样本(首选方法),或者如果获取新样本不可行,则需要提供筛查前 3 年内采集的档案样本。排除标准包括有临床意义的腹水(定义为需要非药物干预的腹水)、主要门静脉血栓形成或乙型和丙型肝炎病毒合并感染。
最初,有四个治疗组,患者以 1:1:1:1 的比例随机分配接受以下治疗:300 mg tremelimumab 单剂加上 1500 mg durvalumab 每 4 周(称为 STRIDE 的方案),1500 mg durvalumab 每4 周,每 4 周 75 mg tremelimumab 共 4 次剂量加上每 4 周 1500 mg durvalumab(称为 T75+D 的方案),或每天两次 400 mg 索拉非尼。当 HIMALAYA 试验启动时,支持性 2 期研究 22 试验评估 STRIDE、durvalumab 或曲美木单抗单药治疗和 T75+D 方案在主要是二线设置的不可切除肝细胞癌患者中正在进行中,旨在为 HIMALAYA 试验提供信息.来自研究 22 的预先计划分析的数据表明,尽管所有方案都有可接受的副作用和可控的安全性,但 T75+D 在疗效方面与 durvalumab 单药治疗没有显着区别。 因此,HIMALAYA的 T75+D 入组已关闭,并对方案进行了修改,以 1:1:1 的比例随机分配患者接受 STRIDE、durvalumab 或索拉非尼。本文报告了 T75+D 组的安全性数据。根据大血管侵犯(是或否)、肝病的病因(乙型或丙型肝炎病毒[但不是两者兼有]或其他/非病毒性)和 ECOG 表现状态 0(完全活跃,能够进行所有疾病前表现)对随机化进行分层无限制)或 1(限制体力活动,但可以走动并能够进行轻度或久坐性质的工作,例如轻度家务或办公室工作)。
在基线(随机化前 ≤28 天)每 8 (±1) 周使用 RECIST v1.1 通过计算机断层扫描或磁共振成像评估肿瘤,随机化后的前 48 周和之后每 12 (±1) 周,直到确认进展.患者报告的结果通过欧洲癌症研究和治疗组织 30 项生活质量问卷进行评估。15 全球健康状况的得分范围为 1 到 100,得分越高表明健康状况越好。从基线得分的绝对变化大于或等于 10 被认为具有临床意义。根据美国国家癌症研究所不良事件通用术语标准 4.03.16 版对不良事件进行分级,在第一次试验剂量之前、治疗期间和停止治疗后评估 durvalumab 和 tremelimumab 的抗药抗体。筛选时提供的肿瘤活检样本中的 PD-L1 表达由 VENTANA SP263 测定法确定,该测定法使用肿瘤细胞和肿瘤相关免疫细胞阳性评分联合方法。肿瘤面积阳性 (TAP) 评分计算为肿瘤细胞和免疫细胞在任何强度的 PD-L1 染色中所占肿瘤面积的比例。 PD-L1 状态定义为阳性(TAP ≥1%)或阴性(TAP <1%)。
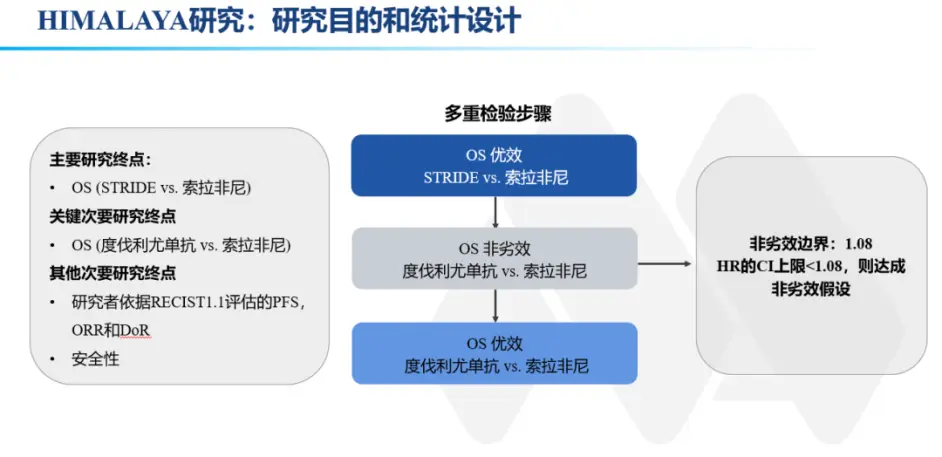
STRIDE 与索拉非尼的主要结果是总生存期,定义为从随机化日期到任何原因死亡的时间。 Durvalumab 与索拉非尼的总体生存率的非劣效性和优越性是关键的次要结局。 其他次要终点包括总生存率(18、24 和 36 个月)、无进展生存期、进展时间、客观缓解率、疾病控制率和使用 RECIST v1.1 进行的每个研究者评估的缓解持续时间,患者 - 报告的结果、安全性和抗药抗体。
结果
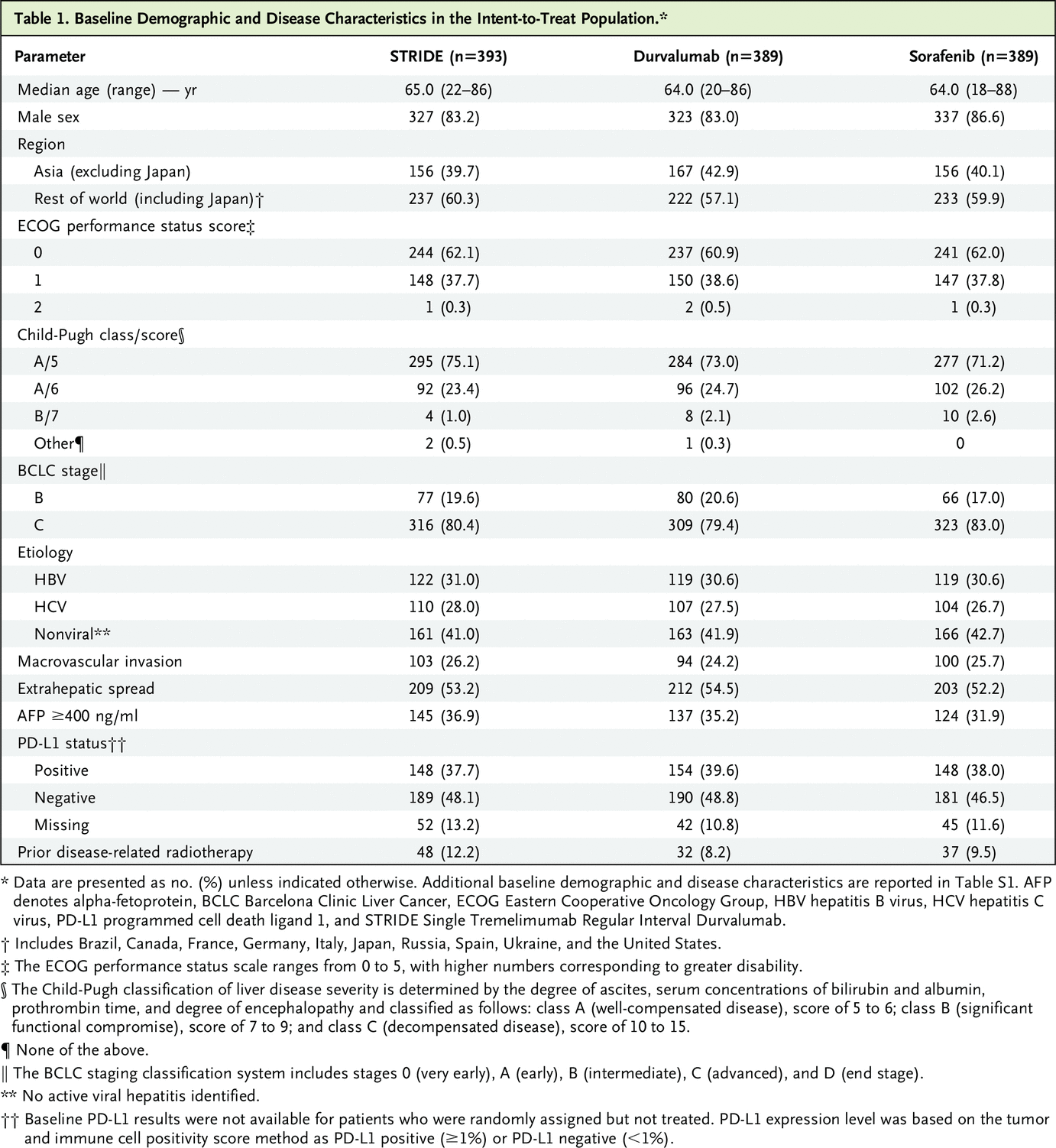
从 2017 年 10 月到 2019 年 6 月,在 16 个国家的 181 个地点对 1950 名患者进行了筛查,1171 名患者被随机分配接受 STRIDE(n=393)、durvalumab(n=389)或索拉非尼(n=389;图 S1) )。基线特征在处理之间通常是平衡的(表 1 和 S1)。表 S2 总结了 HIMALAYA 试验人群的代表性。
停止治疗后,STRIDE、durvalumab 和索拉非尼组分别有 40.7%、43.2% 和 45.0% 的患者接受了后续的二线抗癌治疗(表 S3)。在安全性分析人群中,STRIDE 组的 182 名患者(46.9%)、durvalumab 组的 188 名患者(48.5%)和索拉非尼组的 134 名患者(35.8%)在疾病进展后继续治疗至少一个周期(定义为索拉非尼 28 天内至少治疗 7 天)。随机分配到 STRIDE 的 30 名患者 (7.6%) 接受了 tremelimumab 加 durvalumab 治疗。
在数据截止时,STRIDE、durvalumab 和索拉非尼的中位(范围)随访时间分别为 33.18(31.74 至 34.53)、32.56(31.57 至 33.71)和 32.23(30.42 至 33.71)个月。
与索拉非尼优效分析
在数据截止时,STRIDE 组的 262 名患者(66.7%)和索拉非尼组的 293 名患者(75.3%)已经死亡(总生存风险比,0.78;96.02% CI,0.65 至 0.93;P=0.0035;图 1A) . STRIDE 的中位总生存期为 16.43 个月(95% CI,14.16 至 19.58),而索拉非尼为 13.77 个月(95% CI,12.25 至 16.13)。 STRIDE 和索拉非尼在 18 个月时的生存率为 48.7%(95% CI,43.6 至 53.5)和 41.5%(95% CI,36.5 至 46.4),40.5%(95% CI,35.6 至 45.3)和 32.6%(95 24 个月时的 % CI,27.9 至 37.4),36 个月时分别为 30.7%(95% CI,25.8 至 35.7)和 20.2%(95% CI,15.8 至 25.1)。
与索拉非尼非劣效分析
在数据截止时,durvalumab 组的 280 名患者(72.0%)和索拉非尼组的 293 名患者(75.3%)已经死亡(总生存风险比,0.86;95.67% CI,0.73 至 1.03;非劣效性界值的上限为 1.08 的 95.67% CI)。 由于满足非劣效性,还测试了 durvalumab 与索拉非尼的优势。 Durvalumab 没有表现出优于索拉非尼 (P=0.0674)。 Durvalumab 的中位总生存期为 16.56 个月(95% CI,14.06 至 19.12)。 Durvalumab 组的生存率在 18 个月时为 47.4%(95% CI,42.4 至 52.3),在 24 个月时为 39.6%(95% CI,34.8 至 44.5),在 24 个月时为 24.7%(95% CI,20.0 至 29.8) 36 个月。
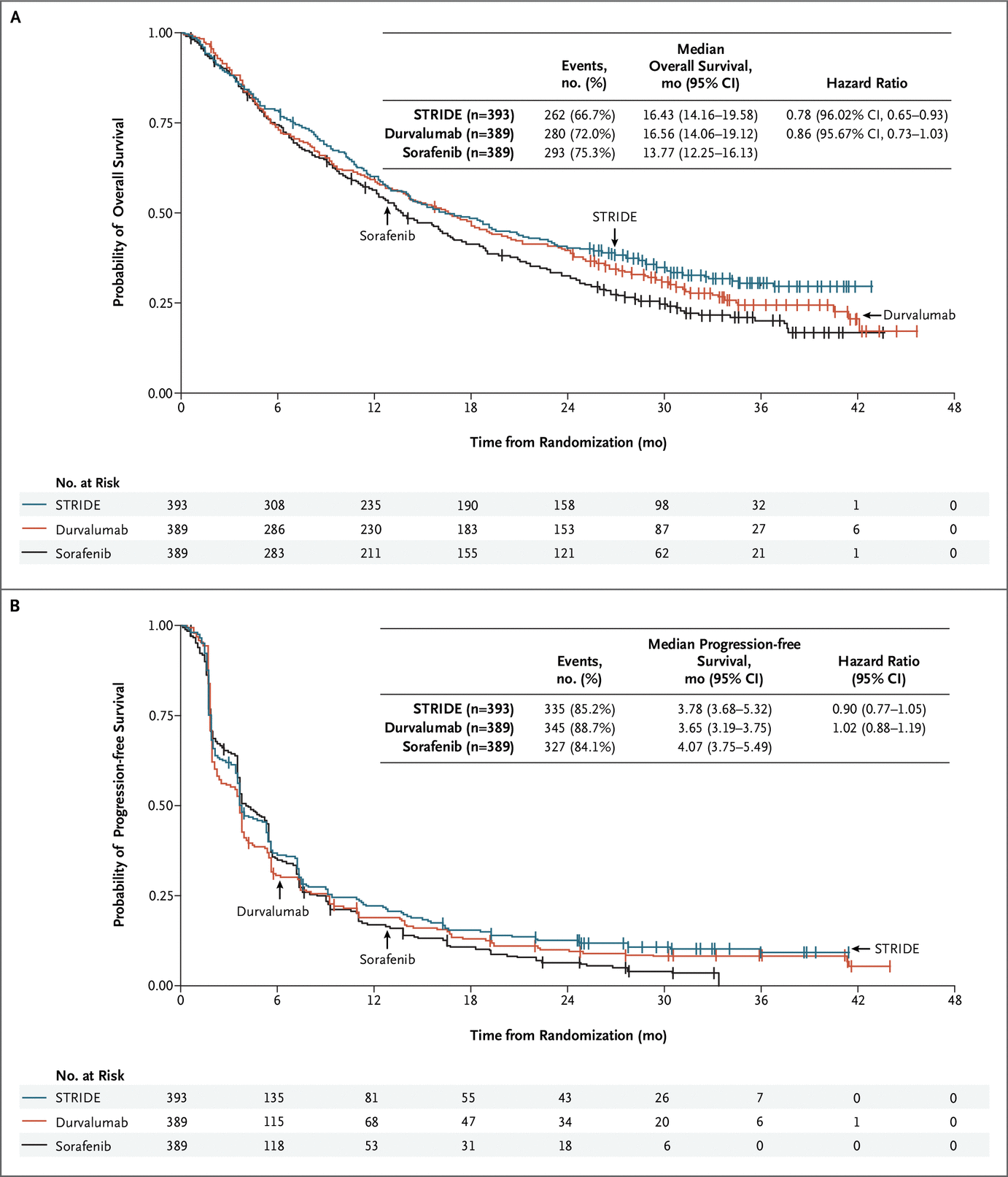
总生存期 Kaplan-Meier 曲线的延迟分离表明存在不成比例的可能性。 为了进一步表征观察到的延迟,进行了一项分析,计算了治疗 9 个月及治疗后时间的风险比的分段常数治疗效果。 STRIDE 与索拉非尼的风险比在 9 个月内为 0.87(95% CI,0.68 至 1.11),9 个月后为 0.70(95% CI,0.56 至 0.89)。 Durvalumab 与索拉非尼的风险比在 9 个月内为 0.98(95% CI,0.77 至 1.24),9 个月后为 0.77(95% CI,0.61 至 0.97)。 STRIDE 和 durvalumab 与索拉非尼的治疗效果在临床相关亚组中基本一致(图 S2)。
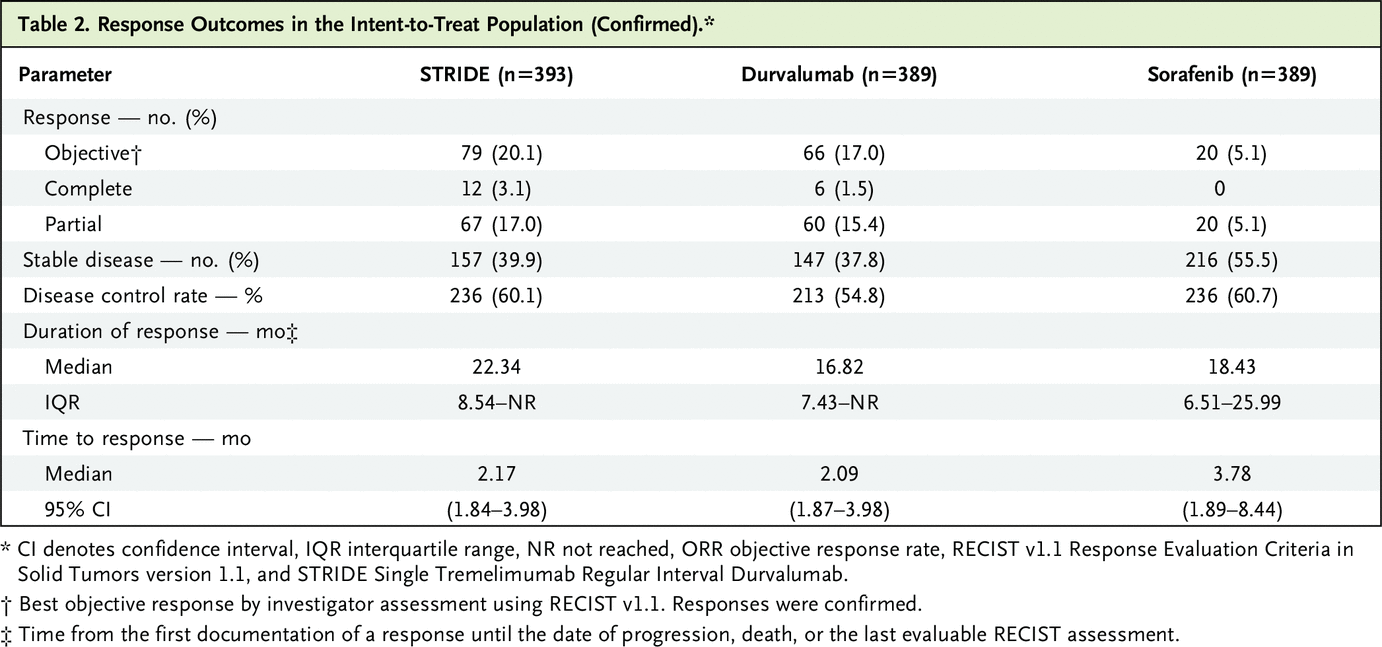
总体而言,STRIDE 组 335 名患者 (85.2%)、durvalumab 组 345 名 (88.7%) 和索拉非尼组 327 名 (84.1%) 患者进展或死亡。 STRIDE 与索拉非尼的无进展生存期风险比为 0.90(95% CI,0.77 至 1.05),durvalumab 与索拉非尼的风险比为 1.02(95% CI,0.88 至 1.19)(图 1B)。 STRIDE 组在数据截止时保持无进展的患者比例为 12.5%,durvalumab 组为 8.2%,索拉非尼组为 4.9%。 STRIDE 组的中位进展时间为 5.4 个月(95% CI,3.8 至 5.6),durvalumab 组为 3.8 个月(95% CI,3.7 至 5.4),5.6 个月(95% CI,5.1 至 5.8)在索拉非尼组。每次研究者评估确认的客观缓解率为 20.1%,STRIDE,17.0%,durvalumab,5.1%,索拉非尼(表 2)。在 3.1% 的患者中观察到确认的完全缓解,对于 STRIDE,1.5% 的 durvalumab 和 0% 的索拉非尼。 STRIDE 的中位(四分位距)缓解持续时间为 22.3 个月(8.5 至未达到),durvalumab 为 16.8 个月(7.4 至未达到),索拉非尼为 18.4 个月(6.5 至 26.0)。 STRIDE 组在 12 个月时保持反应的患者比例为 65.8%,durvalumab 组为 57.8%,索拉非尼组为 63.2%。表 S4 总结了包括未确认响应在内的响应结果。 STRIDE 患者报告的全球健康状况或生活质量恶化的中位时间为 7.5 个月,durvalumab 为 7.4 个月,索拉非尼为 5.7 个月(图 2)。
安全性分析
安全性分析包括接受至少一剂 STRIDE (n=388)、durvalumab (n=388)、索拉非尼 (n=374) 或 T75+D (n=152) 的 1302 名患者。 在 STRIDE、durvalumab 和 T75+D 组中,durvalumab 治疗的中位(范围)总持续时间分别为 5.5(0.4 至 42.7)、5.5(0.2 至 44.4)和 4.6(0.7 至 44.2)个月。 索拉非尼治疗的中位(范围)总持续时间为 4.1 个月(0.1 至 38.6)。 任何不良事件,无论归因如何,分别发生在 378 (97.4%)、345 (88.9%)、357 (95.5%) 和 145 (95.4%) 名接受 STRIDE、durvalumab、索拉非尼和 T75+D 的患者中(表 3)。 3 级或 4 级不良事件分别发生在 196 (50.5%)、144 (37.1%)、196 (52.4%) 和 60 (39.5%) 名接受 STRIDE、durvalumab、索拉非尼和 T75+D 的患者中。
结论
STRIDE 方案是单剂量的 tremelimumab 与 durvalumab 联用,其主要目标是在既往未接受过全身治疗的不可切除肝细胞癌患者中,与索拉非尼相比,总生存期有统计学意义的改善。 在这个成熟的数据集中,36 个月时 30.7% 的存活率和 Kaplan-Meier 分析中观察到的平台期是令人鼓舞的,尽管甚至需要更长期的数据。 发现 Durvalumab 单药治疗的总生存期不劣于索拉非尼。 与索拉非尼相比,STRIDE 和 durvalumab 的临床活性也得到了更高的客观缓解率和更长的生活质量恶化时间的支持。
与索拉非尼相比,STRIDE 方案在总生存期方面表现出统计学上的显着改善。 Durvalumab 单药治疗的总生存期不劣于索拉非尼。 STRIDE 方案和 durvalumab 单药治疗均显示出有利的获益-风险特征。
小编认为,在晚期HCC一线推荐方案中,可选的是T+A和D+T,从现有数据来看,虽然两者没有头对头比较,但数据差异性还是蛮大的,T+A组的中国亚组患者mOS数据甚至刷新到24m。再加上Treme在FDA尚未获得批准上市,也限制了D+T在真实世界中的应用。但随着HIMALAYA研究的成功,一旦D+T方案的阳性结果,获批没问题,在解决了Treme的上市问题后,真实世界中,晚期肝癌首选应该是 T+A 方案,存在贝伐珠单抗的治疗禁忌才有可能考虑 D+T方案。
而在晚期HCC二线上,原本处于一线推荐方案的索拉菲尼、仑伐替尼在真实世界中更可能在一线免疫联合方案失败后成为首选。而原本处于2线的卡博替尼、瑞戈非尼、雷莫芦单抗,则将成为3线方案。
而随着免疫为基础的联合方案成为诸多癌种的标准方案,在高度异质性的HCC领域,PD-1/PD-L1+VEGF/EGFR±CTLA-4等组合方案,将逐步成为主流。
原始出处:
Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. https://evidence.nejm.org/doi/full/10.1056/EVIDoa2100070
Clin Cancer Res:派姆单抗单药治疗初治晚期肝细胞癌
![]() 0
2022-05-05
点击查看
0
2022-05-05
点击查看
Clin Cancer Res:甲胎蛋白可作为肝细胞癌采用Atezolizuma+贝伐单抗治疗的预后生物标志物
![]() 0
2022-05-04
点击查看
0
2022-05-04
点击查看

CGH:恶病质在肝细胞癌患者中普遍存在并与更差的预后相关
![]() 0
2022-05-08
点击查看
0
2022-05-08
点击查看

中药及活性成分可以发挥抗肿瘤活性,抑制肝癌
![]() 0
2022-05-09
点击查看
0
2022-05-09
点击查看

J Hepatol:新型的儿童肝癌分子亚型已被科学家识别到!
![]() 0
2022-05-28
点击查看
0
2022-05-28
点击查看

ASCO 2022:肝细胞癌患者肝移植后 30 天再入院率的预测因素
![]() 0
2022-06-01
点击查看
0
2022-06-01
点击查看
