3型天然淋巴样细胞(Group 3 innate lymphoid cells,ILC3s)是一类主要位于肠道黏膜及相关淋巴组织的天然免疫细胞,它的发育和功能高度依赖于转录因子RORγt的表达。ILC3通过分泌多种细胞因子来参与抵御病原菌感染、促进损伤修复和维持肠道菌群的稳态。Wnt/β-catenin信号通路是维持肠道上皮更新和促进损伤修复的重要信号通路,该信号通路不仅能调控上皮细胞的增殖和分化,还能调控免疫细胞的发育和功能。肠炎肠癌患者通常存在肠道微环境Wnt/β-catenin信号通路的失调。已有研究表明,在这些患者中出现了因Wnt/β-catenin信号通路的异常激活而导致部分免疫细胞功能失调的现象。作为维持肠道稳态的重要参与者,ILC3是否也会受到该通路的影响,受到怎样的影响,这些问题仍然未知。
2024年4月1日,清华大学基础医学院郭晓欢课题组在Nature Communications期刊上在线发表了题为“Dysregulation of Wnt/β-catenin signaling contributes to intestinal inflammation through regulation of group 3 innate lymphoid cells”的研究论文。该研究基于对单细胞测序数据的分析,通过转基因小鼠疾病模型、RNA测序、染色质开放性测序等方法,揭示了Wnt/β-catenin信号通路对3型天然淋巴样细胞和肠道免疫功能的重要调控作用。

结果分析与阐述
在本论文中,研究人员首先对数据库中已有的炎症性肠病(inflammatory bowel disease,IBD)与结直肠癌(colorectal cancer,CRC)相关的单细胞RNA测序数据进行分析,结果显示相关肠道疾病患者病灶处ILC3中的Wnt/β-catenin信号通路呈现出显著的失调状态(图1a)。为探究该通路对ILC3可能的影响,研究人员从小鼠体内分选出ILC3并进行体外刺激,发现Wnt/β-catenin通路激活剂能够显著影响ILC3中转录因子RORγt的表达以及各项功能(图1b-c)。

图1 Wnt/β-catenin通路抑制ILC3中RORγt的表达
为进一步验证该通路对ILC3的影响,研究人员构建了RorccreCtnnb1ex3fl/wt转基因小鼠,在该小鼠中,高表达RORγt的ILC3中Wnt/β-catenin信号通路被激活。流式分析结果显示,Wnt/β-catenin信号通路的激活会导致ILC3的发育和功能出现显著缺陷(图2)。
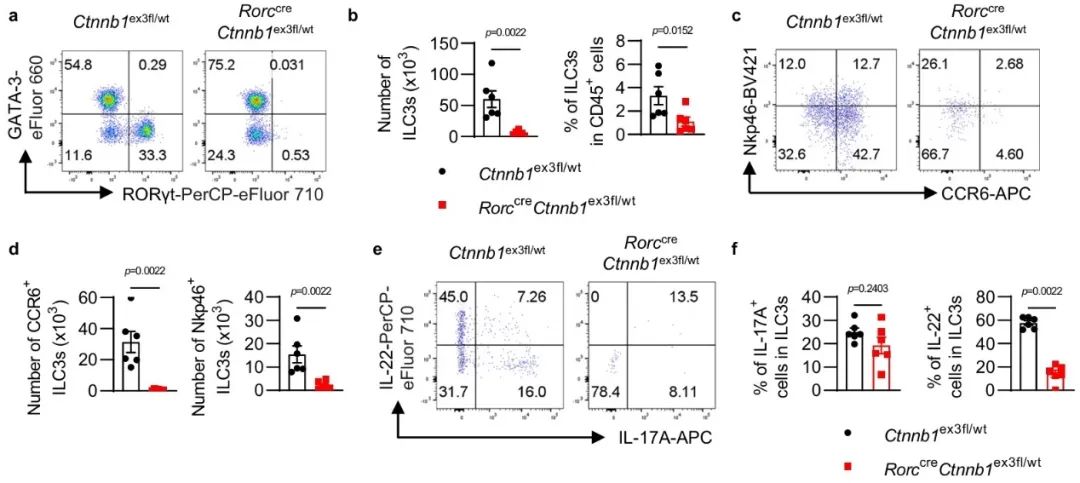
图2 Wnt/β-catenin通路失调抑制小鼠体内ILC3的缺陷
为了进一步探究Wnt/β-catenin信号通路对ILC3的影响,研究人员构建了ILC3的体外实验系统,并发现Wnt/β-catenin信号通路的激活不仅抑制骨髓前体细胞向ILC3的分化,还显著抑制ILC3的细胞活力、增殖能力及细胞因子的分泌(图3)。此外,尽管ILC与T细胞在发育和功能上存在诸多相似之处,但在本研究中,体内和体外实验结果都显示,与在T细胞中Wnt/β-catenin信号通路的激活会促进RORγt表达不同,在ILC3中Wnt/β-catenin信号通路的激活反而会抑制RORγt的表达。
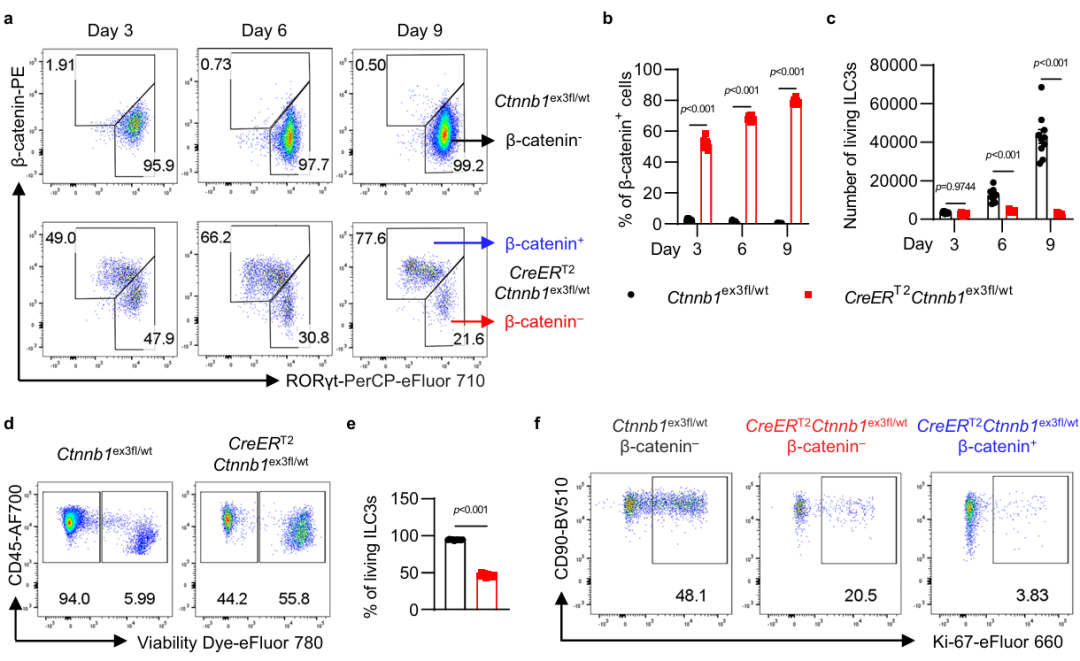
图3 Wnt/β-catenin通路失调抑制ILC3的存活和功能
鉴于ILC3在维持肠道稳态过程中发挥关键作用,研究人员在小鼠中构建了C.rodentium感染模型和DSS诱导的肠炎模型,并发现Wnt/β-catenin信号通路的激活会造成小鼠抵御致病菌感染和促进组织修复的能力严重缺失,因此加剧了小鼠肠炎的发生发展。通过给Wnt/β-catenin信号通路失调的小鼠补充正常的ILC3,研究人员发现小鼠的肠道损伤以及炎症症状得到明显缓解。以上证据说明,Wnt/β-catenin信号通路对3型天然淋巴样细胞和肠道免疫功能发挥着重要的调控作用。
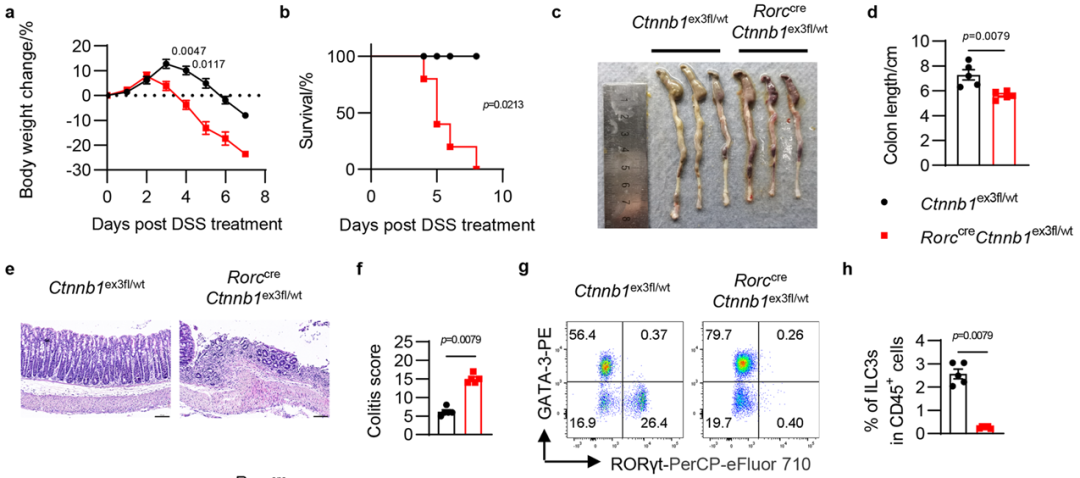
图4 Wnt/β-catenin通路失调抑制小鼠的肠道免疫功能
接着,通过运用RNA-seq、ATAC-seq和CUT&Tag等方法,研究人员发现,激活的Wnt/β-catenin通路不仅通过调控染色质开放性和组蛋白修饰抑制ILC3中Rorc的表达,还进一步调控转录组进而抑制与ILC3功能相关的基因表达。
有趣的是,在T细胞与ILC中,似乎存在着两种截然不同的RORγt调控机制。此前已有多篇文章报道,在T细胞中,Wnt/β-catenin信号通路直接通过TCF-1调控自身RORγt的表达。然而,ILC3中激活的Wnt/β-catenin信号通路无法直接通过TCF-1抑制RORγt的表达。通过多种体外实验手段,研究人员发现并验证了ILC3中激活的Wnt/β-catenin信号通路可通过抑制NFATc2和JunB的表达来抑制RORγt的表达,进而抑制ILC3的发育和功能,其中,JunB受到TCF-1的负调控。
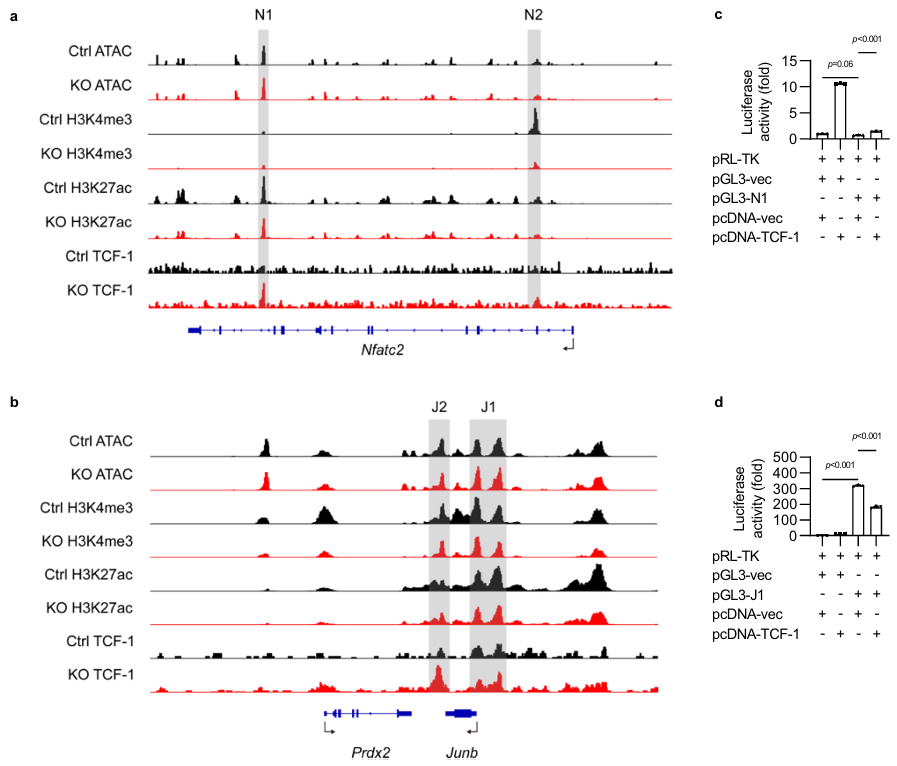
图5 Wnt/β-catenin通路通过抑制JunB以抑制RORγt表达
文章结论与讨论
在本文中,首先,研究者通过对数据库中肠道疾病患者的数据进行分析,发现Wnt/β-catenin信号通路在ILC3中的失调现象。紧接着,研究者分别在体内和体外发现了Wnt/β-catenin信号通路的激活导致ILC3的发育和功能的严重缺陷。ILC3的缺陷会进一步导致小鼠对病原菌的抵抗力减弱以及小鼠肠道损伤修复能力的缺失。最后,研究者创新性地揭示了ILC3内部独特的RORγt表达调控方式——当Wnt/β-catenin信号通路被激活后,ILC3主要通过抑制NFATc2和JunB的表达来抑制自身RORγt的表达;TCF-1不通过直接结合Rorc的启动子调控RORγt的表达,而是通过负调控JunB达到抑制RORγt表达的效果。此外,TCF-1为何在不同类型的免疫细胞中发挥着不同的作用?ILC3和T细胞中为何产生了不同的RORγt调控机制?以上科学问题仍待进一步的研究。
综上所述,本论文的研究成果不仅揭示了全新的RORγt的表达调控机制,也为相关肠道疾病的治疗提供了新的思路和理论依据。
作者简介
郭晓欢实验室博士后、原清华大学免疫学研究所博士生郝嘉成为本文的第一作者。清华大学医学院副教授、免疫学研究所研究员郭晓欢为本文的通讯作者。本研究得到了清华大学医学院蓝勋副教授和上海交通大学生命科学技术学院杨选明教授的重要支持。清华大学医学院博士生刘畅和顾智捷为本项研究做出了重要贡献。本研究得到了北京市自然科学基金项目、国家重点研发计划项目、国家自然科学基金项目、国家中医药管理局创新团队与人才培养计划项目等项目以及清华大学免疫学研究所、清华大学医学院、万科公共卫生学院、清华-北京生命科学中心等的支持。
原文链接:
https://www.nature.com/articles/s41467-024-45616-1
Stem Cell Rep:科学家发现戈谢病来源的iPSC神经前体细胞分化潜能缺陷的原因!
![]() 0
2018-02-05
点击查看
0
2018-02-05
点击查看

Cell Death Dis:miR-4476/APC/β-catenin/c-Jun正反馈环促进神经胶质瘤的发生发展
![]() 0
2020-05-12
点击查看
0
2020-05-12
点击查看
Cell Death Dis:FXR通过拮抗Wnt/β-catenin信号发挥抑癌作用
![]() 0
2020-09-01
点击查看
0
2020-09-01
点击查看

Blood:β-catenin-TCF/LEF信号通过上调G-CSF受体促进粒细胞分化
![]() 0
2020-09-02
点击查看
0
2020-09-02
点击查看

Br J Cancer:APC缺失通过介导Wnt/β-catenin/PKM2通路诱导结直肠癌细胞的Warburg效应
![]() 0
2020-10-24
点击查看
0
2020-10-24
点击查看

Int J Endocrinol:复方血栓通调节Wnt/β-catenin通路改善糖尿病心肌病
![]() 0
2022-10-20
点击查看
0
2022-10-20
点击查看
