由于免疫抑制肿瘤微环境及其产生有效免疫反应的能力有限,目前癌症疫苗面临挑战。为了解决上述局限性,南洋理工大学赵彦利教授和中科院长春应化所张洪杰院士、王樱蕙副研究员等人开发了3-(2-螺烷基)-4-甲氧基-4-(3-磷酰氧基)-苯基-1,2-二氧杂环丁烷(碱性磷酸酶底物)和XMD8-92(细胞外信号调节激酶5抑制剂)-共递送的铜四羟基苯醌(Cu-THBQ/AX)纳米金属-有机框架,以原位产生治疗性疫苗接种。一旦进行接种,Cu-THBQ/AX可产生光动力学效应,诱导焦亡、铜死亡和继发性坏死的同时,还可抑制巨噬细胞的胞葬作用,从而多方面联合有效地将肿瘤微环境从“冷”状态转换为“热”状态,使其成为有效的抗原库。这种转化成功地激活了抗肿瘤免疫反应,抑制了肿瘤的生长和转移。相关工作以“Metal–Organic Framework-Based Nanovaccine for Relieving Immunosuppressive Tumors via Hindering Efferocytosis of Macrophages and Promoting Pyroptosis and Cuproptosis of Cancer Cells”为题发表在ACS Nano。

【文章要点】
如图1所示,作者成功地设计了一种原位治疗疫苗,通过构建3-(2-螺烷氨基)-4-甲氧基-4-(3-磷酰氧基)-苯基-1,2-二氧杂环丁烷(AMPPD)和XMD8-92共递送的四羟基苯醌铜(Cu-THBQ/AX)金属-有机框架(MOF)来抑制免疫抑制的肿瘤。Cu-THBQ可分别通过半醌自由基催化和类Fenton反应催化O2和H2O2生成•O2–和•OH。此外,AMPPD还是碱性磷酸酶的化学发光底物,它可以对肿瘤细胞表面过表达的碱性磷酸酶(AP)产生强化学发光(CL),从而原位激活Cu-THBQ的I型光动力过程。
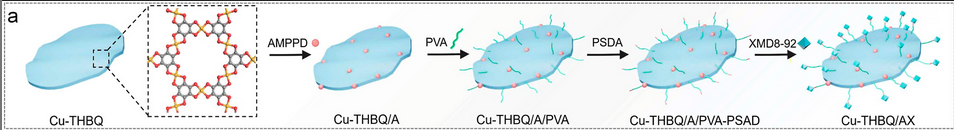
图1 Cu-THBQ/AX
因此,一旦进入早期内体,肿瘤细胞膜中过表达的碱性磷酸酶就会激活Cu THBQ/AX的原位I型光动力效应,产生•O2–。结合半醌自由基催化和类Fenton反应催化产生的为•O2–和•OH,早期内体中ROS的激增可通过激活磷脂酶C触发胱天蛋白酶-3介导的促炎性细胞焦亡。同时,Cu-THBQ/AX可影响铜转运ATP酶1(ATP7A)的功能,导致铜离子的积累,进而增加脂酰化蛋白二氢硫酰胺S-乙酰转移酶(DLAT)的低聚。•OH的产生也可以触发XMD8-92的释放,以有效抑制巨噬细胞的胞葬作用,从而将癌症细胞的免疫抑制性凋亡转化为促炎性继发性坏死(图2)。肿瘤中焦亡、铜死亡和继发性坏死的同时诱导成功地将“冷”肿瘤转变为“热”状态,诱导了长期的免疫记忆效应,并发挥了有效的抗肿瘤作用。

图2 纳米疫苗作用机制示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c01518
【Nat Med】肿瘤微环境影响CAR-T或移植治疗LBCL的疗效
![]() 0
2024-01-21
点击查看
0
2024-01-21
点击查看

四川大学高祥团队《ACS Nano》:肿瘤微环境活化纳米颗粒介导免疫基因治疗及M2巨噬细胞靶向抑制剂协同肿瘤免疫治疗
![]() 0
2024-01-31
点击查看
0
2024-01-31
点击查看

赵彦利教授/张洪杰院士最新JACS:单位点纳米酶可用于铜死亡和级联强化T细胞介导的抗癌免疫疗法
![]() 0
2024-02-08
点击查看
0
2024-02-08
点击查看

Genome Med:原佳沛/杨扬团队发表跨44种人类肿瘤的细胞类型特异性互作网络图谱
![]() 0
2024-03-21
点击查看
0
2024-03-21
点击查看

Genes&Diseases:Yunbao Pan/Guohong Liu教授团队总结肿瘤微环境中自然杀伤细胞的作用
![]() 0
2024-03-31
点击查看
0
2024-03-31
点击查看

Sci Immuno:中国科学技术大学崔国梁/马思聪团队合作发现鞘脂代谢产物促进肿瘤微环境中Treg细胞分化的作用机制
![]() 0
2024-04-28
点击查看
0
2024-04-28
点击查看
