近年来,炎症性肠病(IBD)已成为一种全球性疾病,尤其是在非洲和亚洲,并在全球范围内加速传播。IBD被定义为一种慢性肠道炎症,临床症状包括体重减轻、腹痛、直肠出血、腹泻和贫血,通常需要终身服药,更重要的是,IBD患者更容易患结肠癌。因此,IBD的预防和治疗是非常必要和重要的。但是由于对疾病发展的潜在机制了解不足,炎症性肠病的预防和治疗面临巨大困难。
近日,空军军医大学杨安钢和张瑞教授/新乡医学院尹会龙副教授等研究人员在Cellular & Molecular Immunology杂志上发表了题为Inhibition of METTL3 in macrophages provides protection against intestinal inflammation的研究论文。这项研究表明,m6A甲基转移酶METTL3在结肠炎的进展中起着至关重要的作用,并提示通过靶向METTL3减轻肠道炎症是治疗结肠炎的很好策略。

之前的研究表明,METTL3可以重编程巨噬细胞以抑制肿瘤进展。然而,巨噬细胞METTL3表达是否影响结肠炎发生尚不清楚。为了解决这一问题,作者首先分析了结肠组织巨噬细胞中METTL3的表达,发现与健康对照组相比, IBD患者巨噬细胞的METTL3表达显著增加。使用DSS诱导的结肠炎小鼠模型分析METTL3与结肠炎之间的关系,发现小鼠结肠炎巨噬细胞中METTL3的表达增加,这些结果表明,巨噬细胞中METTL3表达与局部结肠炎发生有关。为了确定巨噬细胞METTL3在结肠炎发展过程中的功能,作者利用在髓系细胞中特异敲除METTL3的小鼠开展研究,结果表明髓系细胞METTL3的缺失会减轻DSS诱导的结肠炎小鼠的症状(图1)。
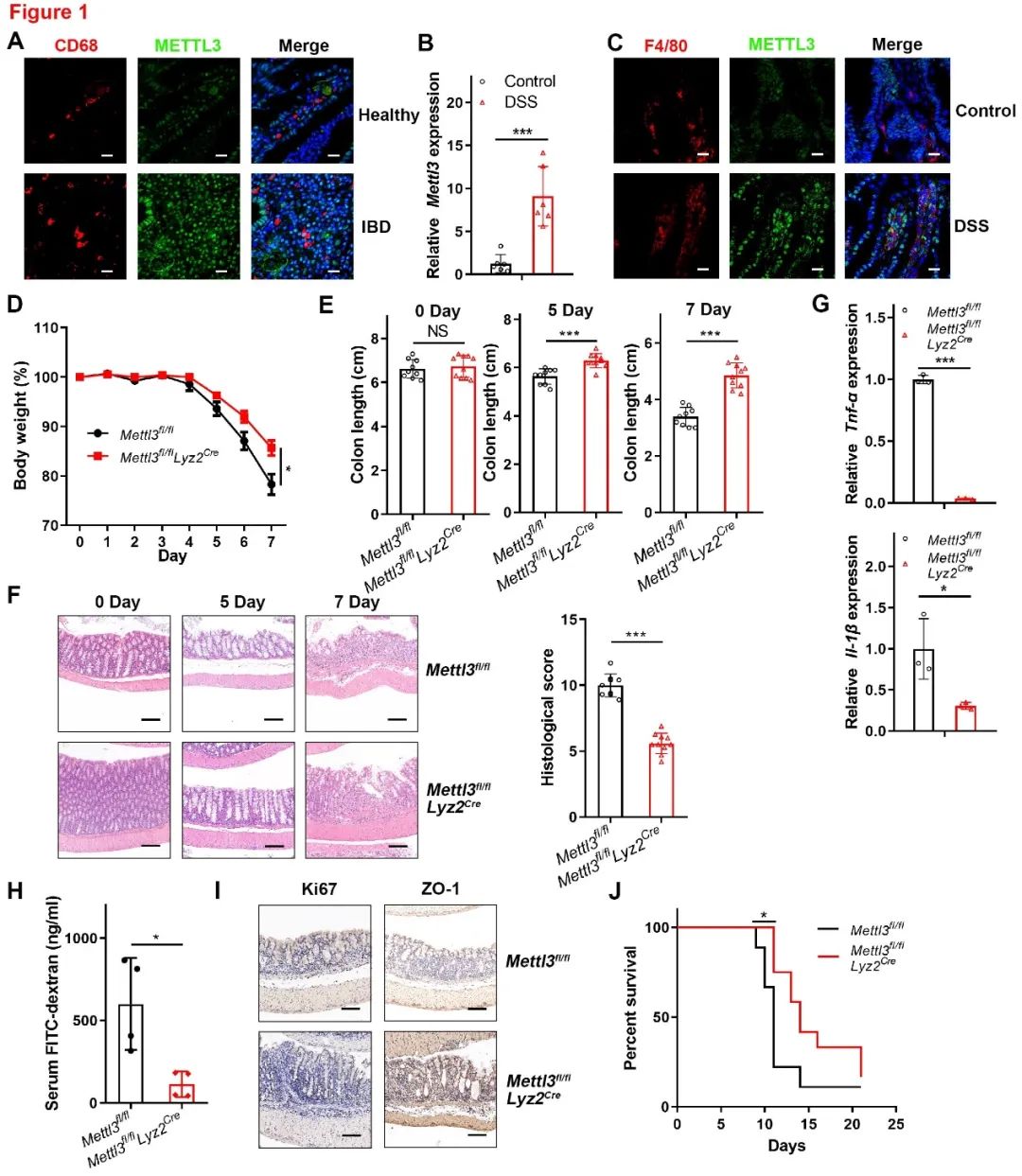
图1 METTL3敲除抑制DSS诱导的小鼠结肠炎发生
为了进一步确认髓系细胞METTL3介导结肠炎发病的作用,作者利用特异敲除METTL3的骨髓细胞对辐照的野生型(WT)小鼠进行重建,并分析重建后嵌合体小鼠肠炎发生的情况。结果表明缺乏METTL3的嵌合体小鼠的结肠炎临床症状得到明显改善,如体重减轻程度、结肠长度和总肠长度变长、以及组织学评分降低。这些数据表明,METTL3缺乏促进了小鼠对DSS诱导的急性结肠炎的抵抗。如果用氯磷酸盐剔除体内的巨噬细胞后,再观察结肠炎的进展,发现对照组与实验组之间的差别变小(图2)。综上所述,这些结果表明,巨噬细胞中METTL3敲除对结肠炎具有保护作用。
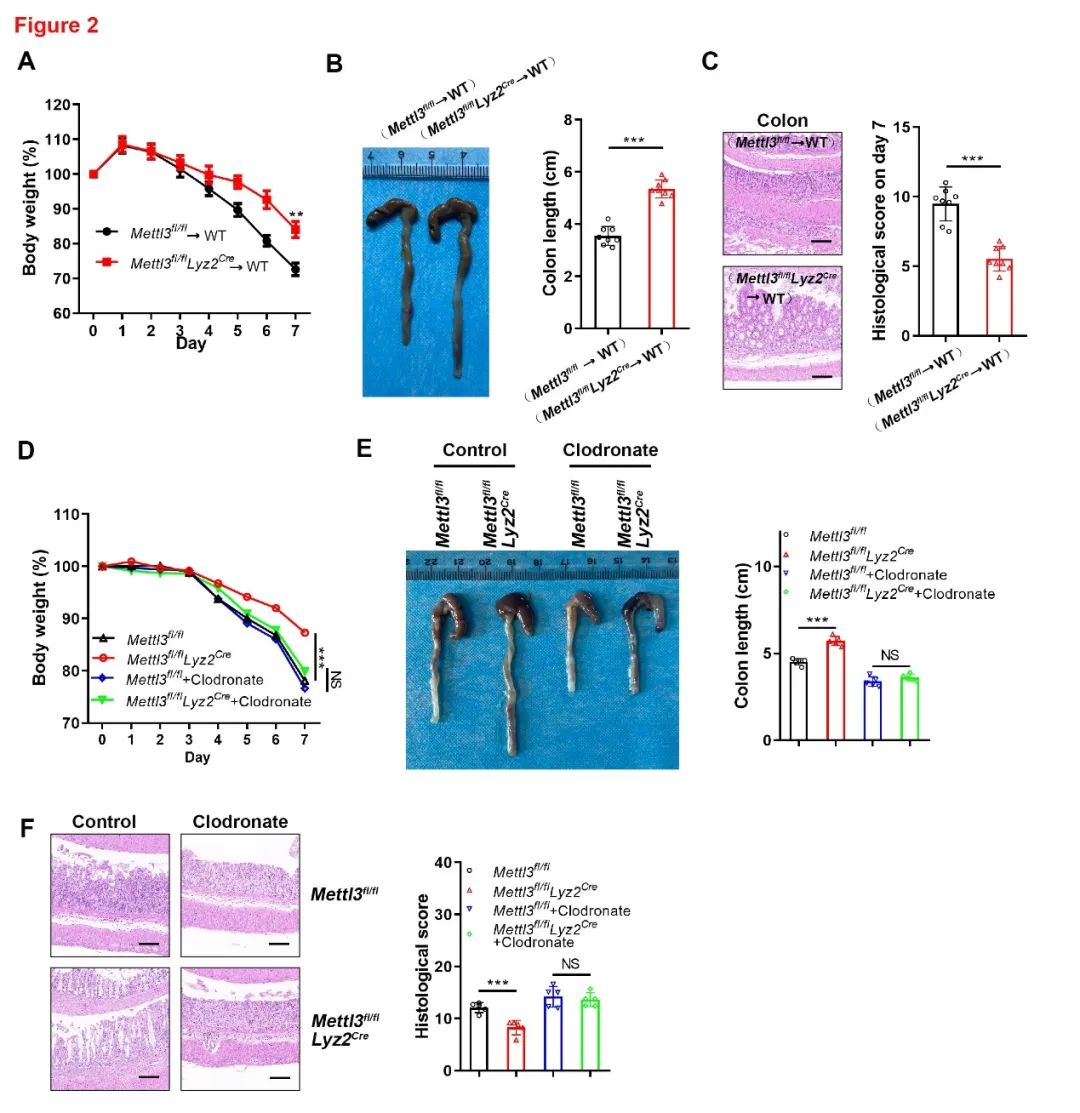
图2 巨噬细胞中的METTL3促进DSS诱导的结肠炎
为了研究METTL3在调节巨噬细胞介导的自身免疫炎症中的作用,作者分析小鼠结肠中免疫细胞的比例。发现敲除METTL3的小鼠结肠中浸润的CD4+IFN-γ+ Th1和CD4+IL-17+ Th17细胞的数量显著低于对照组小鼠。接下来,作者检测了BMDMs抑制T细胞的能力,当T细胞与敲除METTL3的BMDMs共培养时,观察到IFN-γ+ Th1和IL-17+ Th17细胞分化被强烈抑制(图3)。表明敲除METTL3的小鼠的免疫环境发生趋向于抗炎表型的变化。
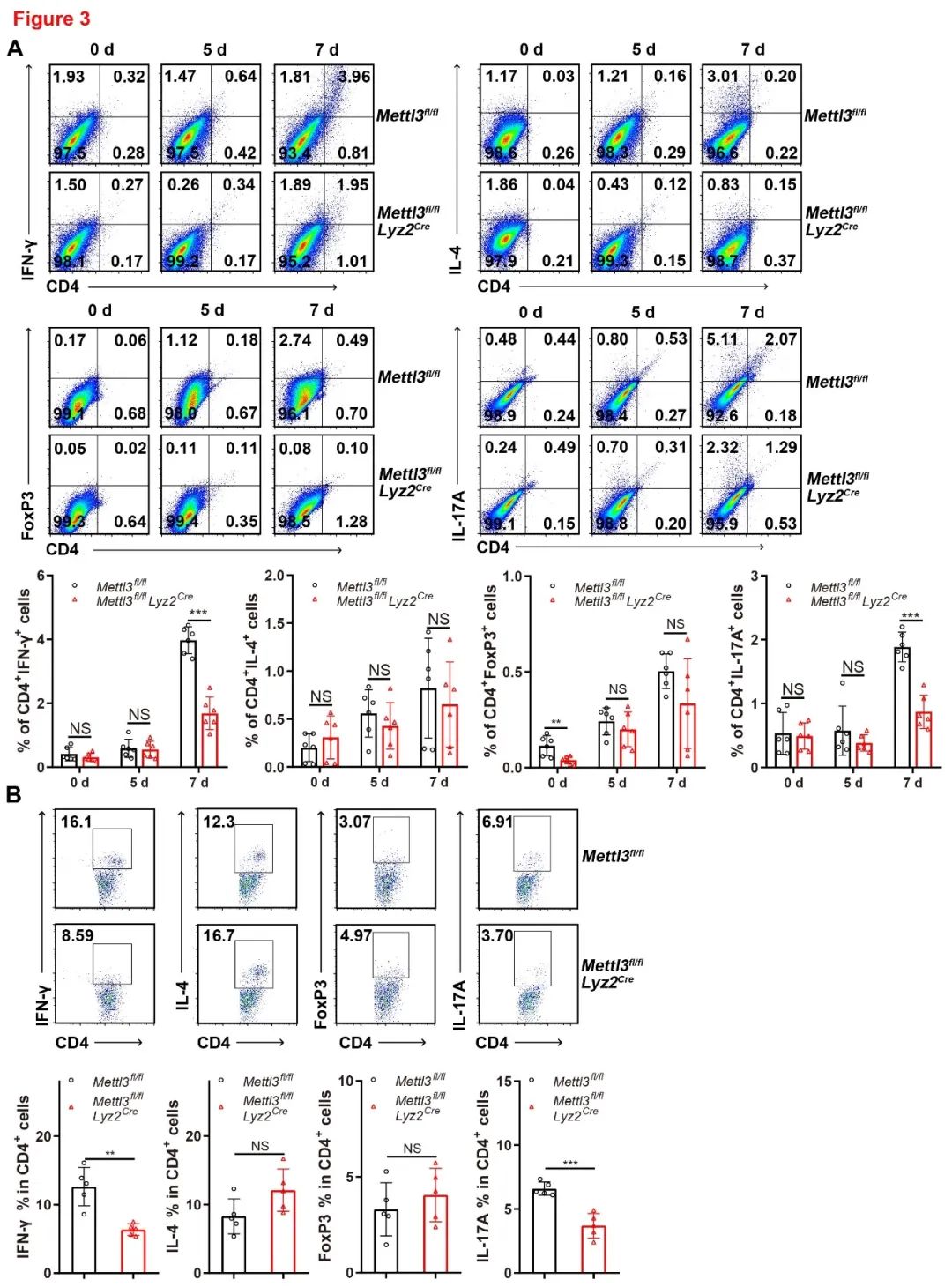
图3 METTL3敲除巨噬细胞抑制Th1分化
为了探索巨噬细胞METTL3如何在结肠炎中发挥功能,作者进行了RNA测序和蛋白质组学分析。RNA测序结果显示290个基因显著上调。蛋白质组学分析显示METTL3敲除细胞中有133种上调的蛋白质。通过交叉分析发现12个上调的基因可能是m6A靶基因。随后,在m6A-seq数据集中分析这些基因m6A峰的分布,发现Pgp和Spr转录物上的m6A修饰明显减少。接下来,作者检测METTL3敲除的BMDMs中Pgp和Spr的mRNA水平,发现Pgp的表达明显升高,蛋白印迹实验证实PGP蛋白水平与METTL3蛋白水平呈负相关。此外, 敲除METTL3的小鼠结肠浸润巨噬细胞中PGP的表达也显著增加。MeRIP-qPCR结果显示,m6A特异性抗体富集的Pgp mRNA在敲除METTL3的巨噬细胞中显著降低。这些结果表明Pgp是m6A的靶基因,接下来通过一系列实验发现PGP的表达是由YTHDF3介导的(图4)。
随后,使用基于RNA腺苷甲基化位点预测(SRAMP)网站和m6A-seq数据来分析Pgp mRNA中的m6A修饰位点。SRAMP数据库预测Pgp mRNA上有四个高度可信的m6A修饰位点,即686、872、971和2198位点,作者在不改变蛋白质序列的基础上构建相应的m6A位点突变体,结果表明m6A修饰位点971是调节Pgp表达的主要位点(图4)。这些结果表明METTL3缺乏增强了YTHDF3介导的PGP表达。
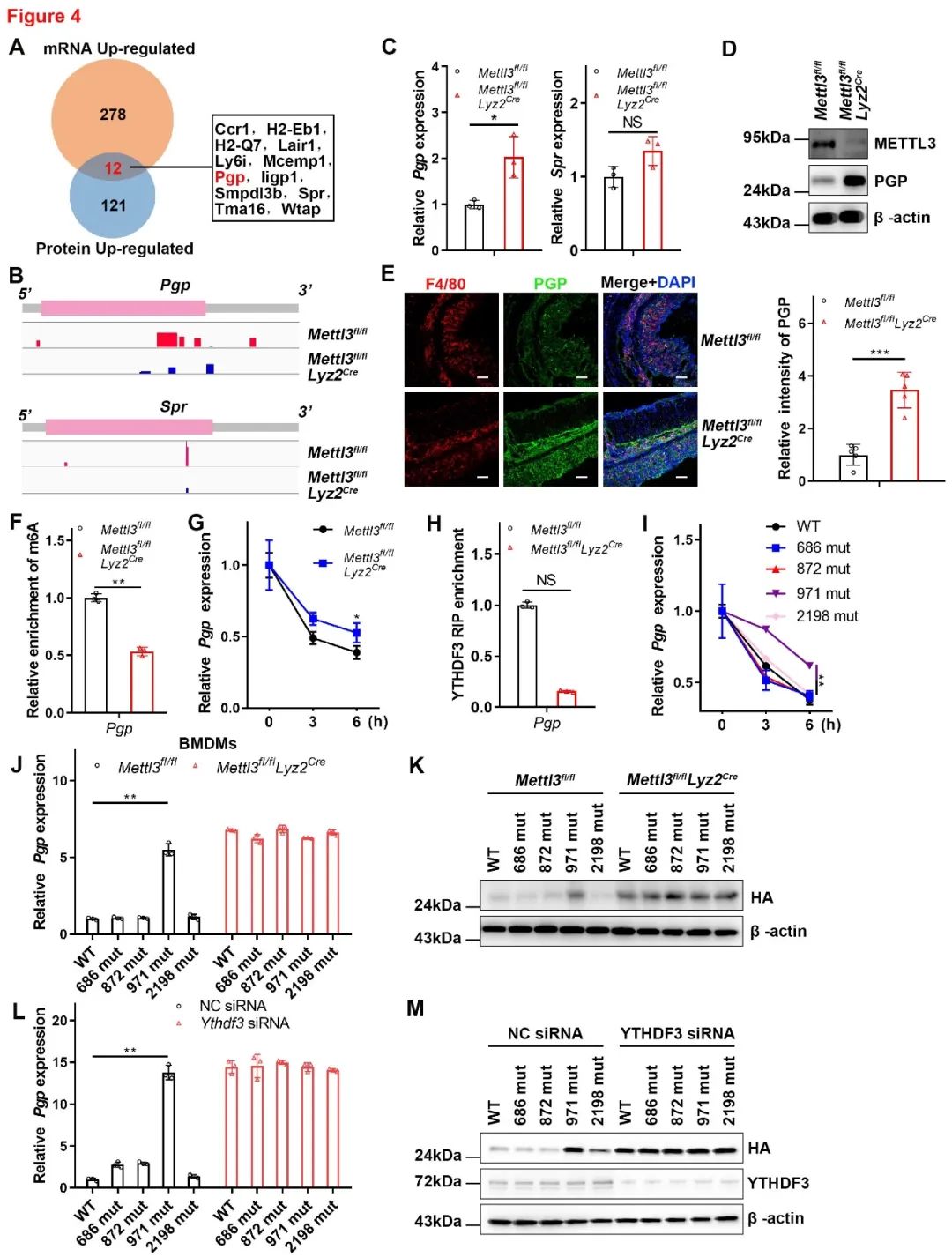
图4 METTL3以m6A-YTHDF3依赖的方式调节PGP表达
先前的研究表明,PGP可抑制磷酸戊糖途径(PPP)和糖酵解。接下来,作者分析并证明NADPH/NADP+比率在敲除METTL3的 BMDMs中增加,而乳酸水平没有变化。接下来,作者检测参与PPP和糖酵解基因的表达,结果显示,与对照相比,敲除METTL3的BMDMs中三个PPP相关基因的表达显著上调,而大多数糖酵解相关基因的表达没有改变。为了探索METTL3表达如何影响巨噬细胞中的葡萄糖代谢,作者使用LC–MS对糖酵解、PPP和三羧酸(TCA)循环代谢产物进行同位素追踪分析,分析显示敲除METTL3的 BMDMs TCA中间产物的表达量升高,但糖酵解中间产物的水平没有明显改变(图5)。这些结果表明,METTL3可能通过代谢重编程调节结肠炎。
为了研究PPP是否真正参与METTL3介导的结肠炎,我们用6PGD抑制剂6-氨基烟酰胺(6-AN)抑制关键的PPP酶6PGD,结果显示,用6-AN阻断PPP显著加重了结肠炎症状,并且敲除METTL3的实验组和对照组之间的差异消失。此外,6-AN加入后,敲除METTL3小鼠的结肠浸润CD4+IFN-γ+ Th1细胞的数量也显著增加(图5)。这些结果表明,METTL3调节葡萄糖代谢参与结肠炎发生。
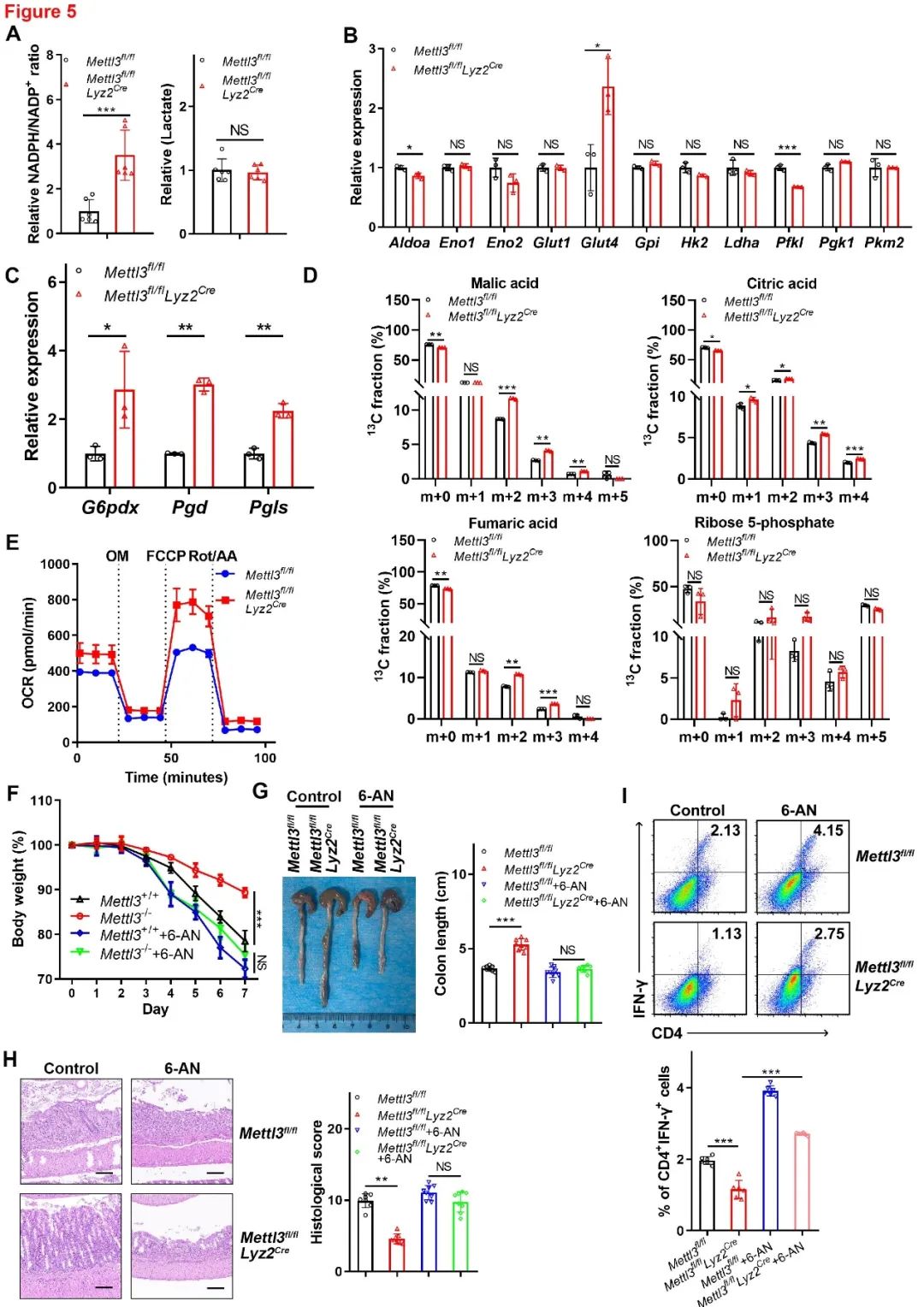
图5 METTL3靶向PPP影响结肠炎发生
为了寻找潜在的METTL3抑制剂,作者对Chemdiv2019数据库(1535478种类药物化合物)进行了基于结构的虚拟筛选,获得63个候选化合物,这些化合物与METTL3的催化结构区域的对接评分最高。通过m6A甲基化酶活性测定,评估这些化合物抑制METTL3的m6A甲基酶活性的功效,结果鉴定获得17种对METTL3的甲基化酶活性具有强大的抑制作用的化合物。随后重点研究了F039-0002和7460-0250这两种化合物,对接模型表明,F039-0002和7460-0250都与METTL3蛋白紧密结合,并结合在其催化结构位点上。此外,通过表面等离子体共振(SPR)证实F039-0002和7460-0250与METTL3蛋白可以直接结合。体外评估F039-0002和7460-0250对METTL3–METTL14催化活性的影响,结果显示出强烈的抑制效果,IC(50)值分别为40.00μM和16.27μM(图6)。这些数据表明F039-0002和7460-0250是METTL3的高效和特异性抑制剂。
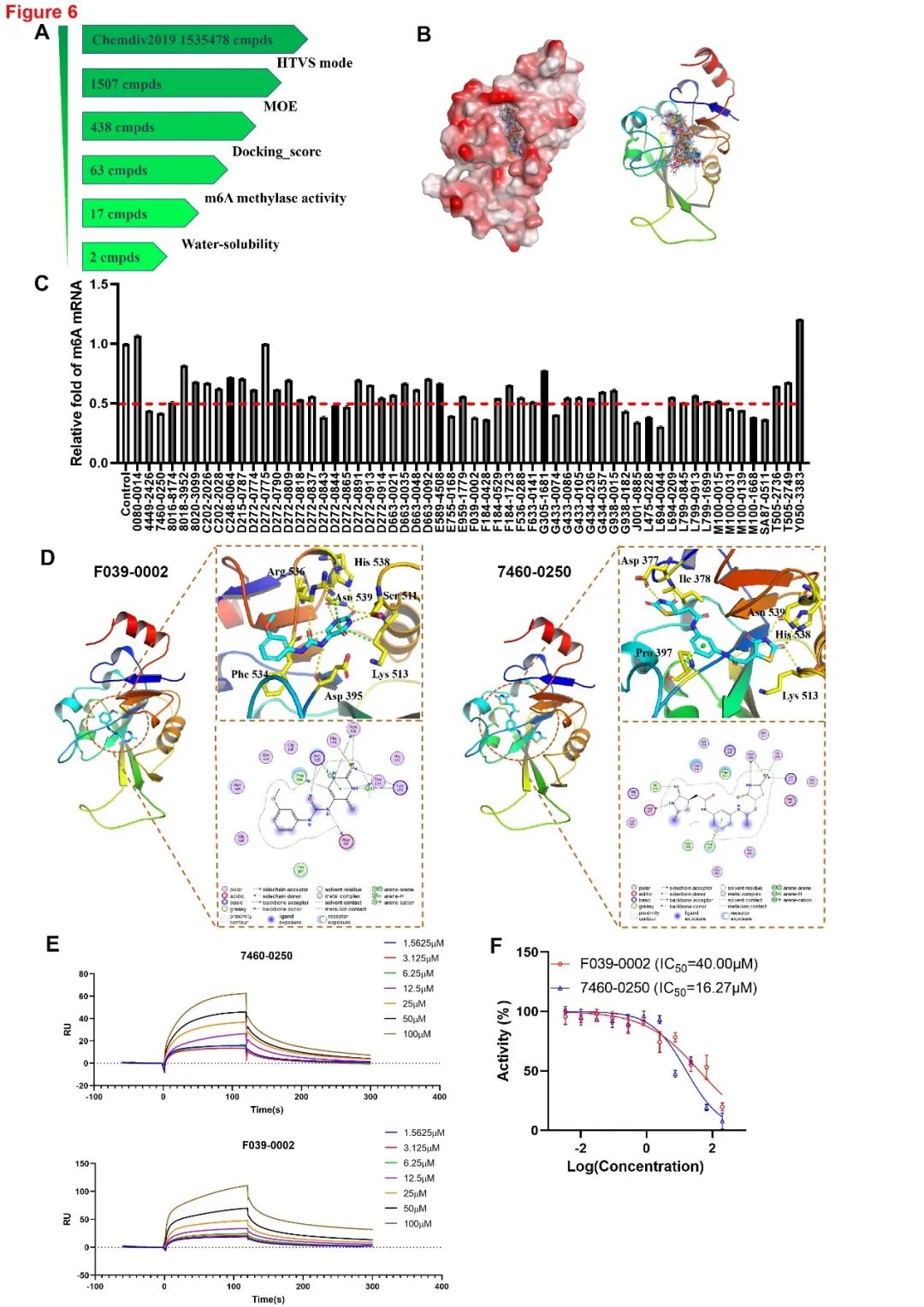
图6 基于结构的虚拟筛选和鉴定METTL3的抑制剂
接下来,作者使用DSS诱导的结肠炎小鼠模型来研究F039-0002或7460-0250对结肠炎的影响。结果显示,与对照相比,METTL3抑制剂显著抑制结肠炎进展。同时观察到PGP在F039-0002或7460-0250处理的BMDM中表达增加,进一步的流式细胞术分析显示,在F039-0002或7460-0250处理后,CD4+IFN-γ+ Th1和CD4+IL-17A+ Th17细胞的数量也明显减少(图7),与前面结果一致。
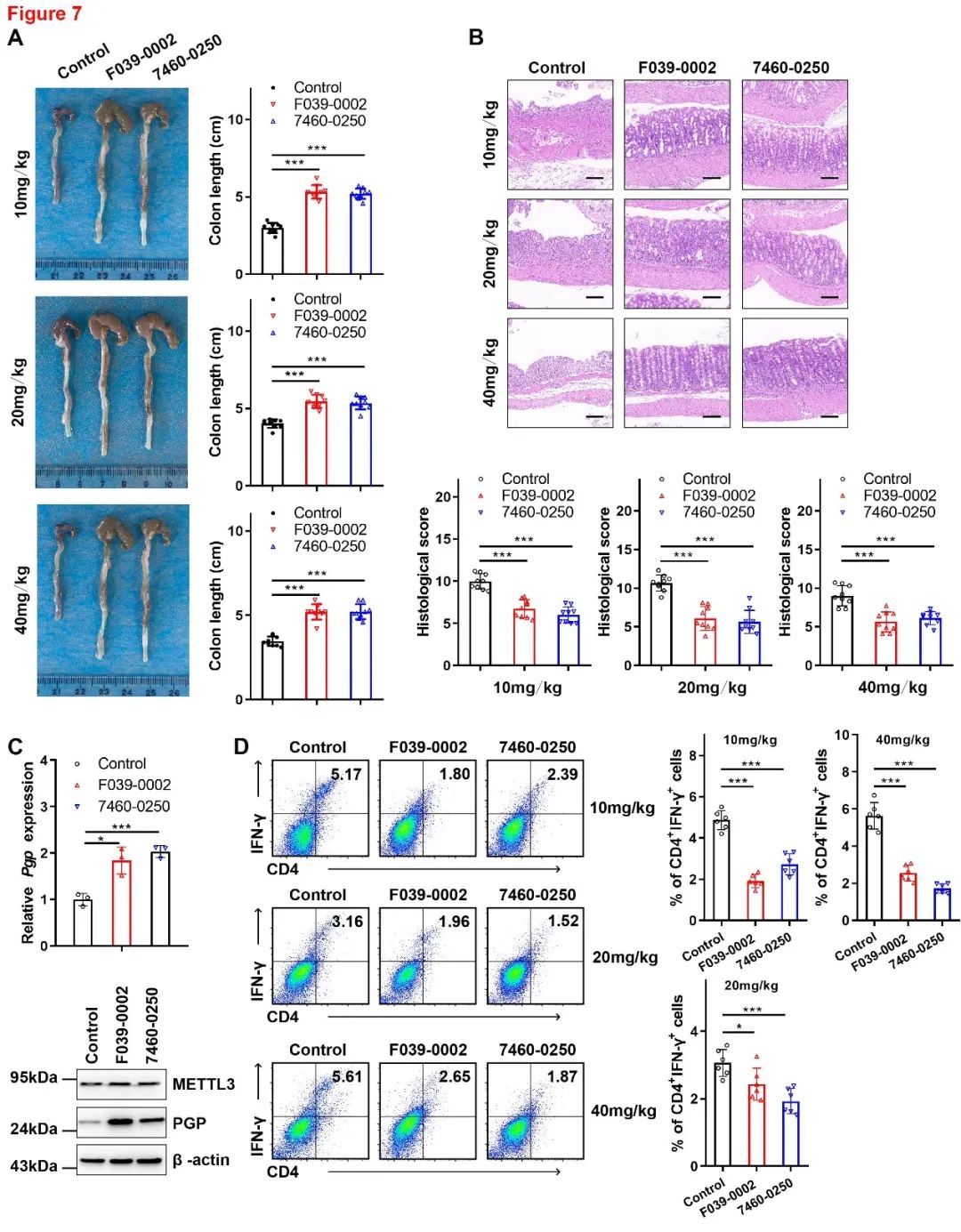
图7 METTL3抑制剂减弱DSS诱导的结肠炎症状
总之,这些结果表明,巨噬细胞中的METTL3敲除增强了YTHDF3介导的PGP表达,影响小鼠的葡萄糖代谢和Th1细胞浸润进而减轻结肠炎症状(图8)。此外,该研究还证实了METTL3抑制剂对小鼠结肠炎的治疗潜力(图8)。
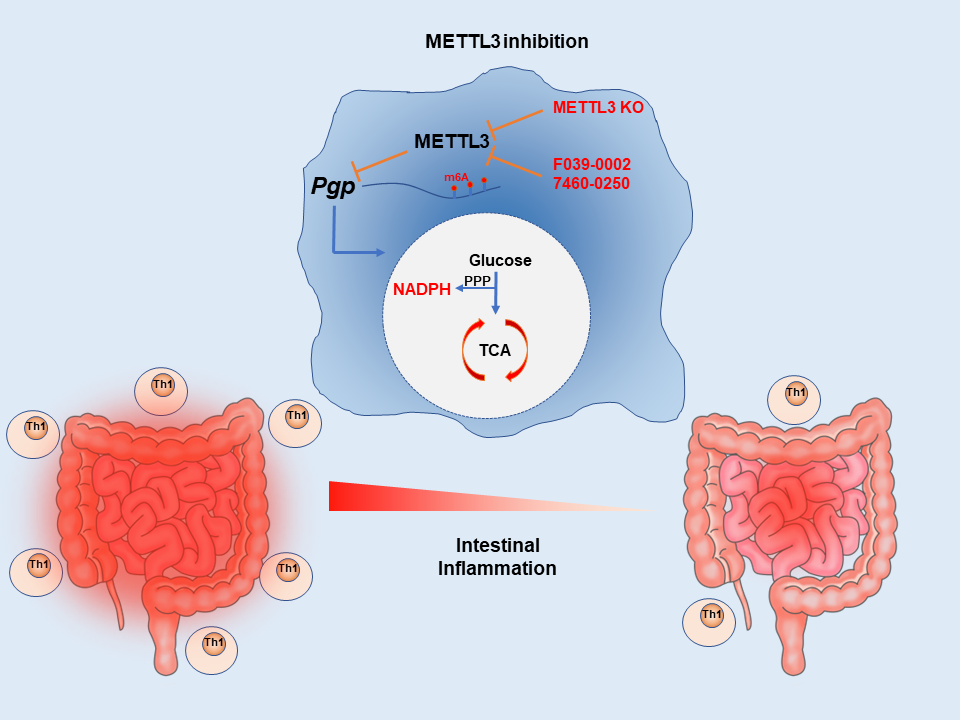
图8 示意图
文章结论与讨论,启发与展望
上述研究内容也是该课题组在揭示N6-methyladenosine对肿瘤相关巨噬细胞功能调控机制(Nature Communications, 2021), 发现N6-methyladenosine对肝糖原合成稳态调节生理学意义(Nature Communications, 2022),以及明确单核来源巨噬细胞中N6-methyladenosine修饰对AD等神经退行性疾病进程影响研究(PLOS Biology, 2023)的后续延续研究发现。
总之,本研究成果拓展METTL3在结肠炎发生调控领域的研究,也为后续临床免疫治疗和靶向m6A修饰治疗结肠炎的方案设计提供了理论基础。首次阐释METTL3介导巨噬细胞重编程参与结肠炎的进展,并且开发了两个METTL3的小分子抑制剂,有望应用到临床治疗结肠炎病人,给临床结肠炎病人提供巨大帮助,同时也极大推动该领域的发展。
空军军医大学基础医学院的杨安钢教授和张瑞教授为本论文的通讯作者。新乡医学院副教授尹会龙、研究生雎转和左文洁、空军军医大学张翔副教授为本文共同第一作者。
原文链接:
https://www.nature.com/articles/s41423-024-01156-8
J Ethnopharmacol:白头翁汤通过调节AMPK/mTOR介导的自噬来修复DSS诱导的结肠炎小鼠肠道屏障
![]() 0
2023-07-18
点击查看
0
2023-07-18
点击查看

JCC:肠道微生物群产生的苯乙酰谷氨酰胺与克罗恩病有关,可能通过血小板活化加重结肠炎
![]() 0
2023-09-02
点击查看
0
2023-09-02
点击查看
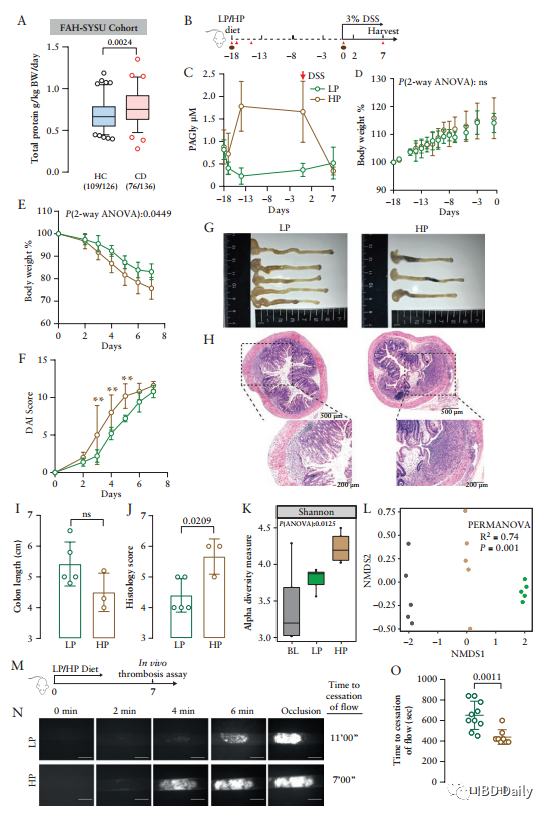
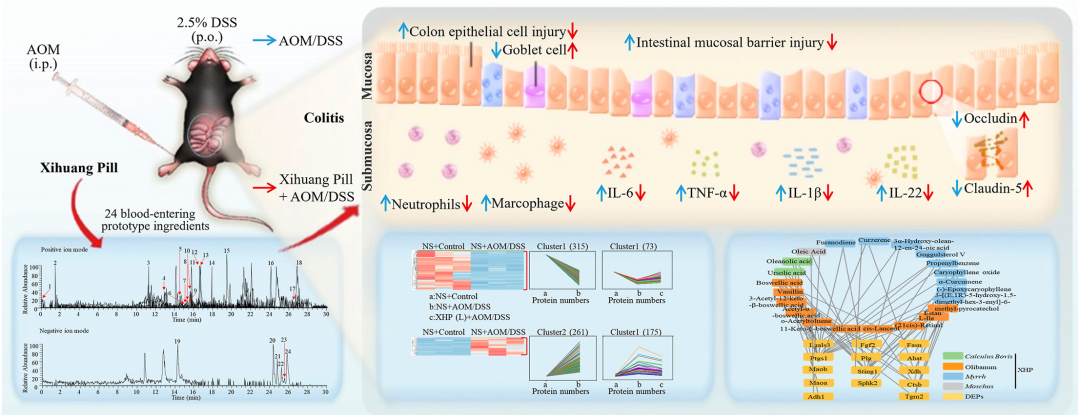
J Ethnopharmacol:西黄丸通过改善粘膜屏障损伤,抑制炎症细胞滤过,改善小鼠结肠炎
![]() 0
2023-11-23
点击查看
0
2023-11-23
点击查看
东北师范大学鲍永利教授团队:TSP50 通过调节 TGF-β 信号传导介导的肠粘膜屏障完整性维持来减轻 DSS 诱导的结肠炎
![]() 0
2024-01-17
点击查看
0
2024-01-17
点击查看
陆军军医大学最新《自然·通讯》:靶向递送Fc融合PD-L1,有效治疗急性和慢性结肠炎
![]() 0
2024-02-26
点击查看
0
2024-02-26
点击查看

PNAS:小分子抑制剂VS基因敲除?林合宁组揭示Sirt2抑制剂改善结肠炎的独特优势
![]() 0
2024-04-25
点击查看
0
2024-04-25
点击查看
