9月26日-28日,第四届中国细胞与基因治疗大会在天津隆重举行,本次年会将汇聚国内外众多专家学者和业界精英,通过分享最新的科研成果、临床实践经验和技术创新,共同探讨细胞与基因治疗领域的热点问题和前沿趋势。
在本次大会上,来自北京大学邓宏魁教授对“化学重编程技术及其在重大疾病治疗中的应用”进行了深度分享,本文梳理重点内容,以分享各位同道。

再生医学引领新的医学革命:为治疗重大疾病提供新手段
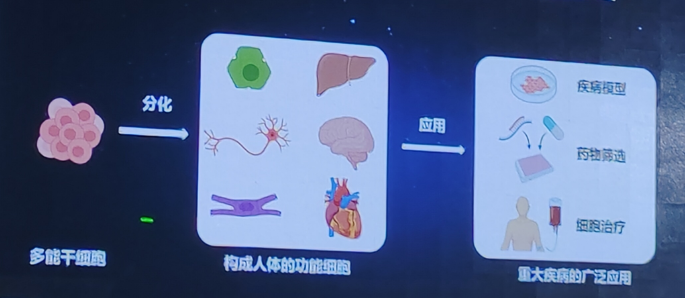
再生医学通过修复、替换或再生人体细胞、组织或器官来治疗疾病和损伤。这一领域的发展正在引领一场新的医学革命,为治疗重大疾病提供了前所未有的新手段。其中,多能干细胞技术是再生医学治疗重大疾病的基础。多能干细胞具有自我更新和分化成多种细胞类型的能力,这使得它们在组织修复、器官再生和疾病治疗中具有巨大的潜力。
多能干细胞能够分化产生构成人体的所有细胞类型,成人个体含有100余种细跑大类,共约30万亿个细胞。多能干细胞包括胚胎干细胞和诱导多能干细胞。胚胎干细胞是从早期胚胎(囊胚期)中分离而来,具有无限增殖能力和多向分化潜能,可以分化成所有类型的细胞。此外,诱导多能干细胞是通过将成体细胞(如皮肤细胞或血液细胞)重编程为多能状态而获得。诱导多能干细胞具有与胚胎干细胞相似的多向分化潜能,可以使用患者自身的细胞进行重编程,减少免疫排斥的风险。
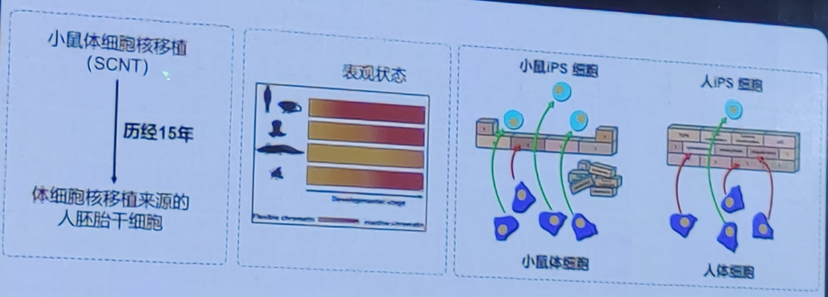
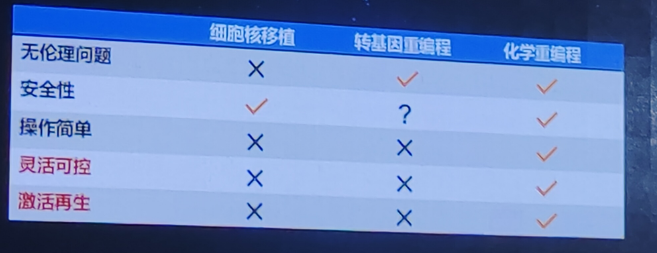
传统的细胞命运重编程方法包括细胞核移植,转录因子介导的体细胞重编程及卵母细胞介导的重编程。细胞核移植将一个体细胞的细胞核移植到一个去核的卵母细胞中,通过电刺激或化学刺激促使重组细胞启动胚胎发育程序,最终形成一个克隆胚胎。转录因子介导的体细胞重编程则是过引入特定的转录因子(如 Oct4、Sox2、Klf4 和 c-Myc,简称 OSKM),将成体细胞(如皮肤细胞或血液细胞)重编程为诱导多能干细胞。
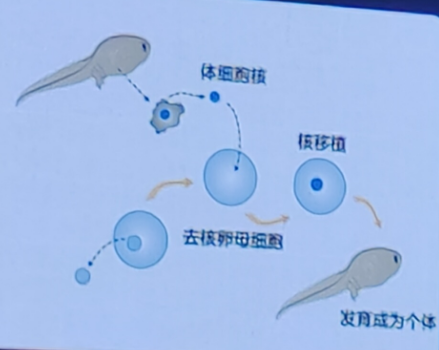
体细胞核移植技术
卵母细胞是天然的具有重编程能力的细胞。卵母细胞介导的重编程是一种通过将体细胞的细胞核移植到去核的卵母细胞中,利用卵母细胞中的细胞质因子重新编程体细胞核,使其恢复到全能状态的过程。这种方法最早在克隆动物研究中得到应用,特别是著名的克隆羊“多莉”的诞生。那么。能否不用卵母细胞,人为实现细胞的重编程?
诱导多潜能干细胞(iPS):化学重编程
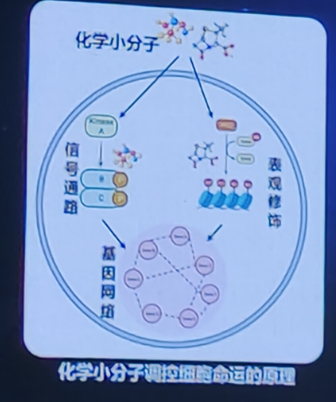
化学小分子可以重新激活细胞可塑性,提供外部刺激信号诱导细胞命运重编程。在原理和技术特点上超越了现有的细胞命运重编程手段。化学小分子具有以下特点:易于穿透细胞;不整合到基因组更安全;易于多靶点组合调控;作用可逆,时间浓度可控;可对细胞命运精准调控。
使用化学小分子将小鼠体细胞重编程为多潜能干细胞(CiPS细胞)。
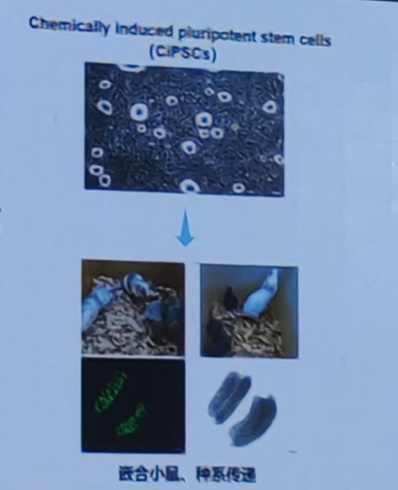
激活类似再生的程序是人体细胞化学重编程的一个独特特征。
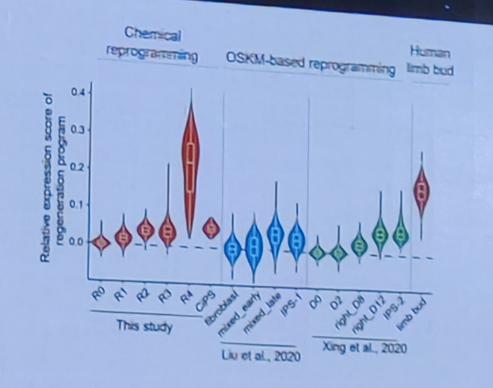
化学重编程诱导多能干细胞经历了全新的分子路径,在底层原理上完全不同于转基因重编程。
化学小分子诱导人体细胞重编程为多潜能干细胞(hciPs细胞)。
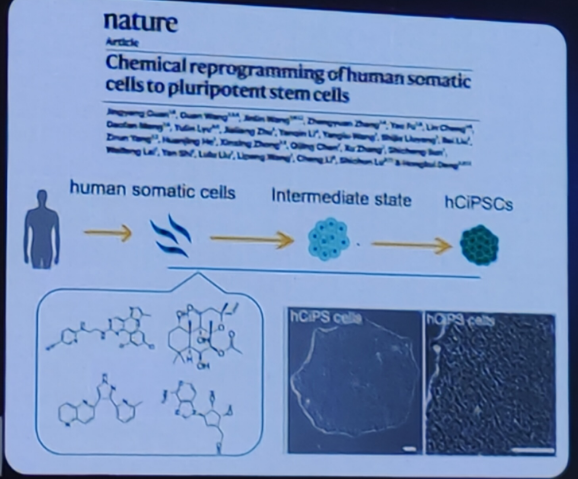
人体细胞具有更稳定表观遗传修饰状态和更低可塑性重编程难度更大。
此外,化学重编程早期阶段经历了类似再生过程中去分化的状态,具有高度可塑性的中间状态。
人化学重编程技术独特优势:激活人成体细胞的再生潜能
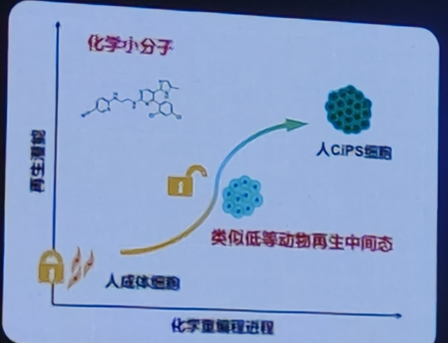
1)化学重编程早期激活类似低等动物再生的待征
2)发现了激活人体细胞再生潜能的关健信号
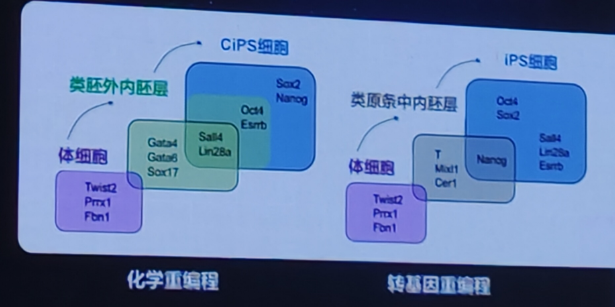
阐明了人体化学重编程的独特路径和机制
1)证明与传统多激能干细的诱导路经完全不同
2)存在与低等动物再生相似的独特再生中间态
3)发现炎症反应是化学重编程的重要障碍
4)为化学重编程激发人成体细胞再生潜能提供新途径建立第二代人体细胞化学重编程体系
1)30天内高效诱导,最短16天诱导
2)效率大幅提高,比转基因重编程高8-40倍
3)17个不同个体来源的细胞100%稳定透导
4)建立了符合临床应用标准的人CiPS细胞系
CiPS细胞的安全性优势:嵌合体小鼠存活率更高
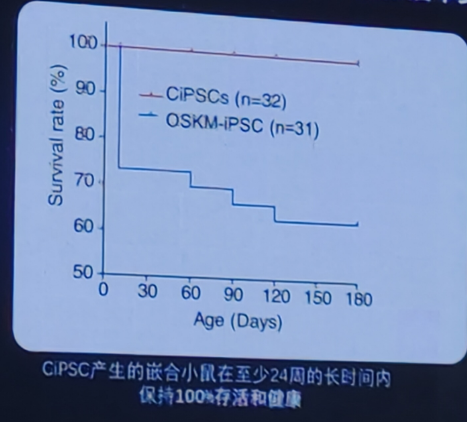
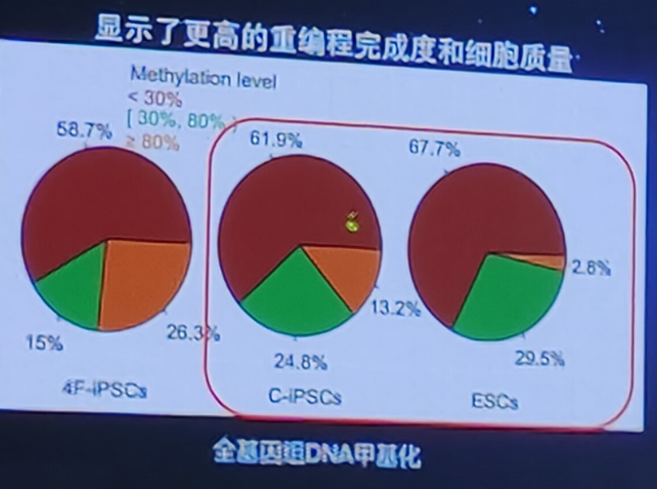
CiPS细胞具有更好的基因组稳定性和安全性
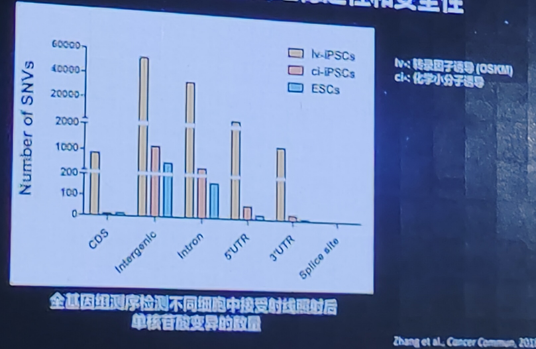
化学重编程技术具备独特的应用优势
CiPS细胞的安全性优势:整体表观遗传学状态更类似于自然的胚胎干细胞
糖尿病治疗新手段:胰岛移植
糖尿病是全球面临的最广泛、最严重的代谢性疾病之一。中国是目前世界上糖尿病患者最多的国家,预计2045年中国糖尿病患者达1亿7千万。糖尿病可进一步导致严重的并发症,例如视网膜病变,神经病变,糖尿病脑病,肾脏病变,心血管病变等。
糖尿病致病关键因素为血糖稳态失调。葡萄糖作为人体所有器官的主要供能原料,其体内稳态对健康和生存至关重要。健康人能够控制血糖波动,空腹时血糖能稳定在3.8-6.1mmou之间,进餐后血糖不会超过7.8mmol/L。
胰岛对于血糖稳态的维持至关重要。胰腺中散布着许许多多的细胞群,叫做胰岛胰腺中胰岛总数约有100~200万个。胰岛多种内分泌细胞共同维持血糖稳态:β细胞分泌胰岛素,降低血糖;α细胞分泌胰高血糖素,提升血糖;δ细胞分泌生长抑素,调控α细胞和β细胞的分泌。
胰岛移植有望解决胰岛素治疗的缺陷,但缺乏胰岛来源。多能干细胞制备的胰岛β细胞有望解决胰岛的来源问题。由于胰岛移植长期受限于供体不足,部分患者需要接受多次不同供体来源的胰岛移植才能实现胰岛素脱离。
通过建立分化各阶段细胞标志蛋白的荧光标记体系,实现了分化进程及效率的实时追踪,为分化方案的进一步优化提供了有力的工具。模拟体内胰岛发育过程,有望在体外实现多潜能干细胸向胰岛细胞的分化。人CiPS细胞来源的胰岛在糖尿病猴模型中具有显著治疗效果。
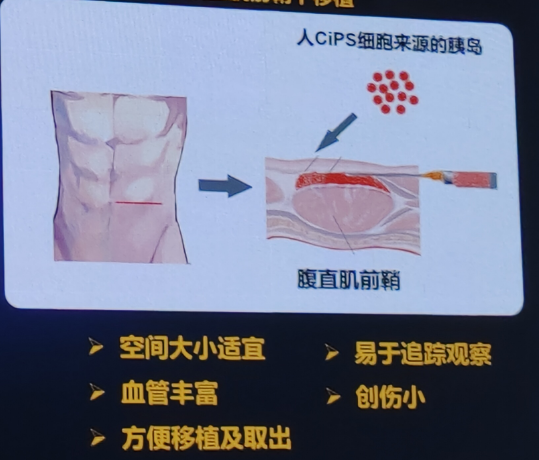
建立全新胰岛移植策略:腹直肌前鞘下移植
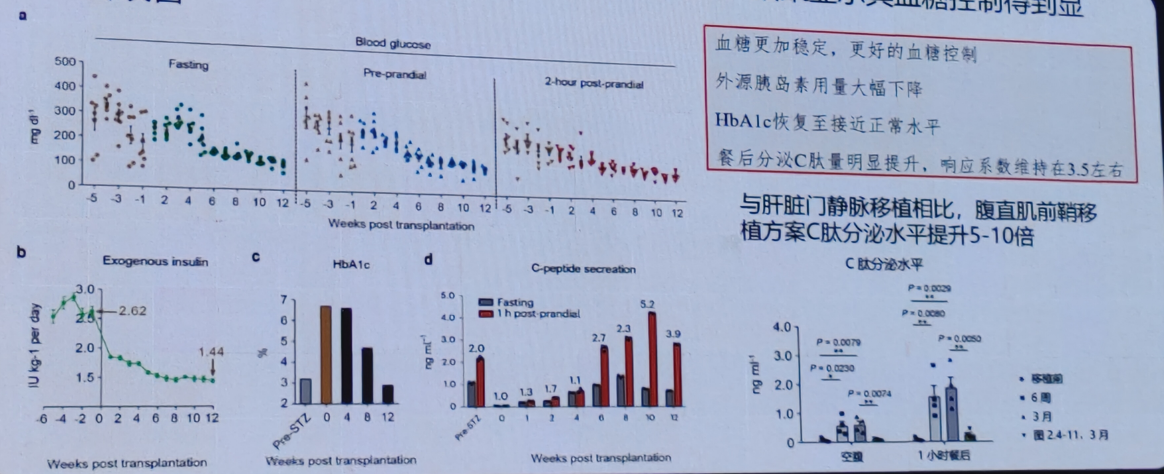
建立全新的胰岛移植策略,特别是将胰岛移植到腹直肌前鞘下的方法,为糖尿病的治疗提供了新的希望。传统胰岛移植通常采用门静脉途径,但这种方法存在一些局限性,如移植后早期胰岛死亡率高、血栓形成风险等。腹直肌前鞘下移植作为一种新的移植部位,具有潜在的优势。
1)腹直肌前鞘有效支持多能干细胞来源胰岛的体内存活
2)腹直肌前鞘下移植多能干细胞来源胰岛实现与原代胰岛相当的功能。
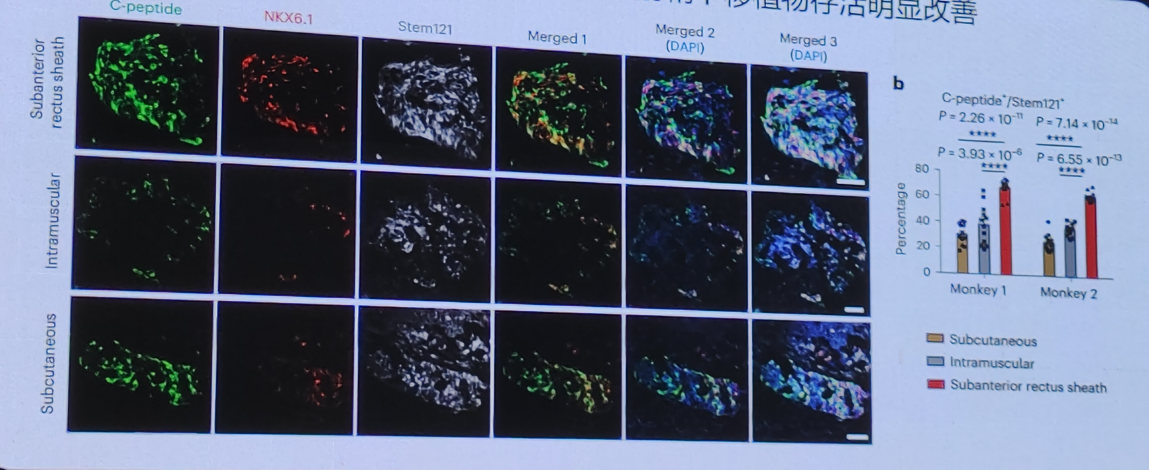
3)采用该移植策略在非人灵长类糖尿病模型测试,结果显示其血糖控制得到显著改善。
化学重编程技术制备的胰岛细胞移植治疗1型糖尿病的临床研究
在卫健委的支持下,天津市第一中心医院沈中阳教授团队开展了一项名为“自体多能干细胞来源的胰岛样细胞移植治疗1型糖尿病的探索性临床研究”。这项研究旨在评估自体多能干细胞来源的胰岛样细胞移植在1型糖尿病患者中的安全性和初步疗效。
初步结果显示,第一例患者移植后75天脱离胰岛素,糖化血红蛋白水平降低至正常范国。BETA-2评分显著提高,移植物功能良好。另外,OGTT试验显示,血糖维持稳定,C肽持续改善,空腹内源性C肽分泌显著改善。空腹血糖在移植后逐渐进入正常水平。
肿瘤标志物化验结果显示,未发现畸胎瘤特异性标志物(AFP、HCG)升高,未见其他肿瘤标志物异常。在本研究中,受试者均未发现肿瘤发生的证据(最长时间已观察1年)。