众所周知,在我们的整个生命周期中,长期存活的造血干细胞(Hematopoietic stem cell ,HSC)能够分化为几乎所有类型的血细胞和免疫细胞。几十亿个循环流通的血细胞并不会在体内长期地存活,都是有寿命的。

基于干细胞的“自我更新”特点,仅仅很少数量的造血干细胞就能产生人体一生当中所需的所有血细胞,堪称四两拨千斤。然而到目前为止,研究人员一直都无法在实验室中培养出足够数量的功能造血干细胞。造血干细胞的扩增,一直是干细胞领域的圣杯!
-01-
2023年2月22日,国际顶级期刊Nature 一篇论文中,来自东京大学和斯坦福大学的研究团队发表一篇题为 Chemically defined cytokine-free expansion of human haematopoietic stem cells 的文章,发明了一种化学成分明确且无细胞因子的培养体系,成功在实验室中长期稳定地培养出人源造血干细胞。
文章显示:研究者通过用化学小分子组合替换了重组干细胞因子(SCF)和促血小板生成素(TPO),开发了一种无细胞因子培养体系。这种培养体系支持脐血造血干细胞的体外大量扩增并能保持其功能性,同时也支持造血干细胞的克隆扩增,解决了造血干细胞在体外扩增培养的瓶颈。
培养体系的核心成分是:740Y-P(一种PI3K激活剂),UM171(一种HSPC扩增化合物)和丁酰胺(一种TPO受体激动剂),同时使用Soluplus(聚乙烯醇己内酰胺-聚乙烯醇-聚乙二醇接枝共聚物,即PCL-PVAc-PE)替代PVA。这个培养体系中不需要使用血清,不需要细胞因子,化学成分明确。对于这个新的造血干细胞培养体系,我们将其中几个关键问题一一做下解析:
-02-
解析一:化学成分明确的无细胞因子培养基
结合前期研究,重组干细胞因子(SCF)和促血小板生成素(TPO)、聚乙烯醇 (polyvinyl alcohol,PVA) 组合的培养基适合造血干细胞生长。在这种培养条件下,小鼠造血干/祖细胞(HSPCs)可迅速扩增,而人类造血干细胞的扩增很有限。而造成这种差异的原因是人类细胞中PI3K和AKT通路活性显著降低。
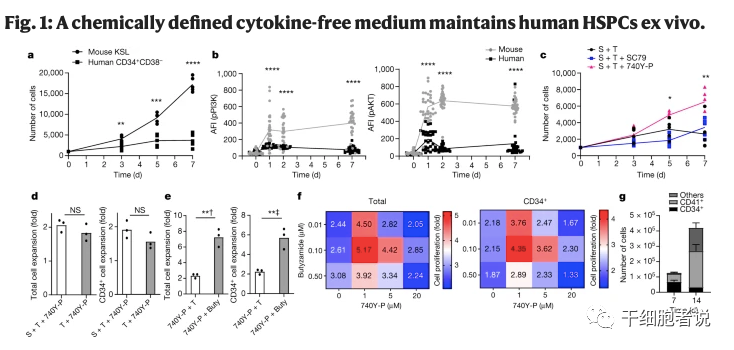
图1.一种化学成分明确的无细胞因子培养基能在体外维持人类HSPCs
使用化学激动剂740Y-P(PI3K激活剂)使PI3K磷酸化。研究发现不管有无SCF的存在,740Y-P都能促进HSPCs的增殖,这表明:SCF可以被740Y-P 所替代。同样,TPO可以被丁酰胺(TPO受体激动剂)取代。不过,2a无细胞因子培养基(由740Y-P和丁酰胺组成)只能短期支持人造血干细胞的扩增。
-03-
解析二:长期的体外造血干细胞培养
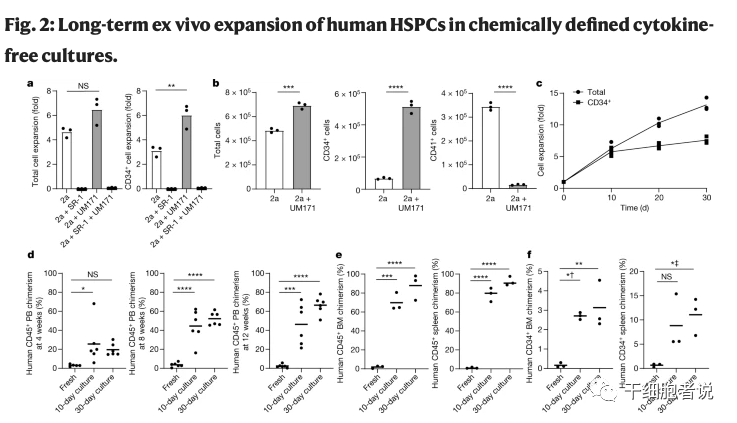
由UM171(70nM)、740Y-P(1μM)和丁酰胺(0.1μM)组成的三激活剂(3a)培养基是最适合造血干细胞生长的。在这种条件下,人造血干细胞连续培养到30天,可持续增殖14倍。将其进行异种移植16周和24周后发现,在小鼠外周血、骨髓、脾脏中观察到较高的细胞嵌合率(CD34+、CD45+)。结果表明:人造血干/祖细胞可以在3a培养基中稳定增长,可以在体外维持功能至少一个月。
-04-
解析三:己内酰胺聚合物改善造血干细胞的生长
在建立无细胞因子培养体系后,使用 Soluplus(即聚乙烯醇己内酰胺-聚乙烯醇-聚乙二醇接枝共聚物,PCL-PVAc-PE)替代PVA,并在培养30天后观察到总细胞的大约75倍扩增, CD34+细胞的55倍扩增。异种移植实验发现在小鼠外周血、骨髓和脾脏中,都观察到类似的、稳健的人类细胞嵌合。这表明:基于PCL-PVAc-PEG 的3a培养体系的细胞实现了体外大量扩增,具有体外功能并且可移植。
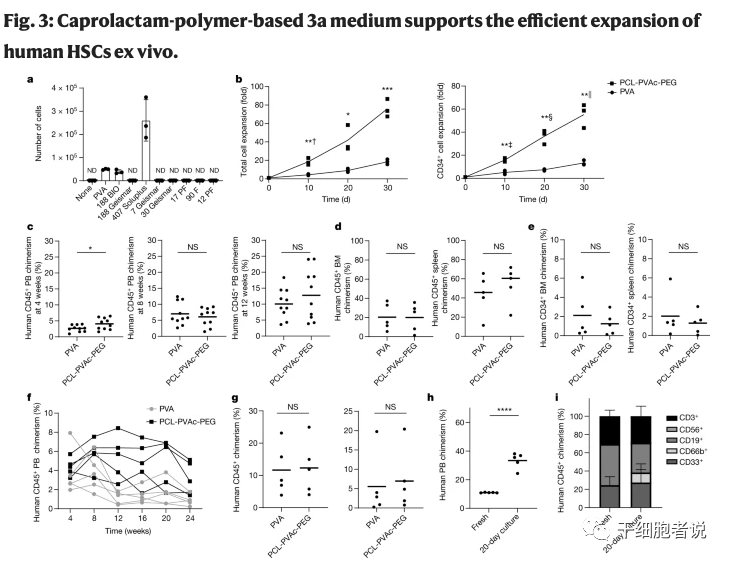 图3. 己内酰胺聚合物的3a培养基支持人类HSCs的体外高效扩增
图3. 己内酰胺聚合物的3a培养基支持人类HSCs的体外高效扩增
-05-
解析四:造血干细胞长期选择性扩增培养
通过流式细胞术对造血干细胞表面标记物进行分析。结果表明:经过3a培养体系长期培养后,CD34+EPCR+CD90+CD45RA−ITGA3+细胞在培养7天后显著富集,表明造血干细胞表型显著富集。经全外显子组测序结果表明,有7个可能导致氨基酸发生变化的突变,有4个剪接位点的突变,但与血液系统恶性肿瘤或克隆造血无关。结果表明:3a培养体系是安全的。
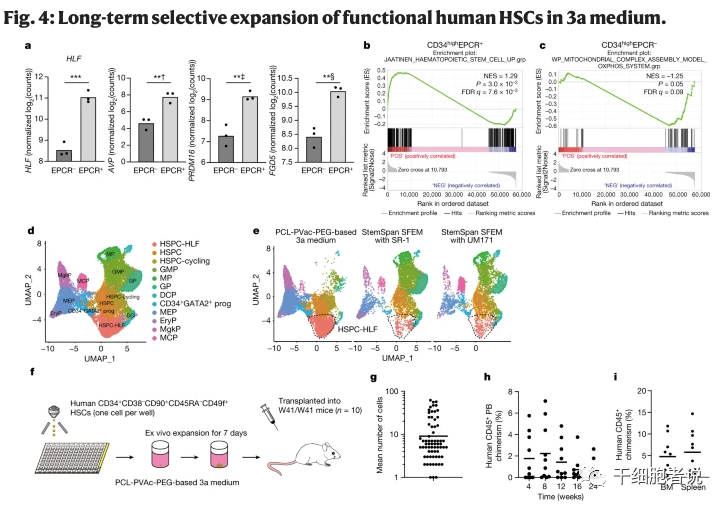
图4. 3a培养基长期选择性扩增功能性人类HSCs
造血干细胞培养存在异质性问题。研究团队发现PCL-PVAc-PEG的3a培养体系的造血干细胞中,HSPC-HLF细胞群、红细胞系和MgK祖细胞群比例更高,而单核细胞群和粒细胞祖细胞群则更少。结果表明,3a培养体系具有更低的异质性,更适合长期造血干细胞(Long-term HSCs , LT-HSCs)的选择性扩增。
最后,3a培养体系是否能支持克隆衍生的造血干细胞扩增培养。结果表明,50%的受试小鼠在24周后表现出了良好的外周血、骨髓和脾脏嵌合,骨髓和脾脏中有超过5%的多系人类CD45+嵌合率。结果表明,3a培养体系支持造血干细胞的克隆扩增。
-06-
研究结果显示,研究者通过用化学小分子组合(UM171+740Y-P+丁酰胺)替换了造血干细胞经典培养基中的重组干细胞因子(SCF)和促血小板生成素(TPO),开发出一种无细胞因子培养体系,该体系支持脐血造血干细胞的体外大量扩增并能保持其功能性,适合长期造血干细胞的选择性扩增,同时也支持造血干细胞的克隆扩增,解决了造血干细胞在体外扩增培养的瓶颈。
如果这套培养体系可以成功规模化培养临床级人源造血干细胞,它可能会为再生医学和基础研究做出巨大的贡献。
主要参考文献:
https://www.nature.com/articles/s41586-023-05739-9
Hiro Nakauchi教授,任职于美国斯坦福大学干细胞生物学和再生医学研究所,同时担任筑波大学免疫学教授、东京大学医学部干细胞治疗学教授。
Hiro Nakauchi教授证明了单个造血干细胞可以重建整个造血系统,他的工作目标是将基础研究中的发现转化为实际的医学应用。





 图3. 己内酰胺聚合物的3a培养基支持人类HSCs的体外高效扩增
图3. 己内酰胺聚合物的3a培养基支持人类HSCs的体外高效扩增
