[摘要] 背景与目的:收集以医院登记为基础的6 737例接受手术切除的胃癌患者的随访资料,分析其1、3和5年观察总生存(overall survival,OS)率和无病生存(disease-free survival,DFS)率,为中国的胃癌防控和政策制定提供真实世界研究证据。方法:纳入2015年1月1日—2020年12月31日在复旦大学附属肿瘤医院接受手术治疗的胃癌患者共6 737例,通过查阅患者病史了解患者的临床信息,并通过复诊病史、电话随访和死因数据链接等方式收集患者的生存随访资料,随访统计时间截至2023年11月30日。采用Kaplan-Meier法估计患者1、3和5年OS率和DFS率,并在不同年龄组、性别、治疗时期、肿瘤分期及病理学特征等亚组中分别描述。结果:接受手术切除的胃癌患者经中位50.99个月随访后,5年OS率和Ⅰ~Ⅲ期患者5年DFS率分别为70.37%和69.46%。Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期胃癌患者的5年OS率分别为94.32%、82.56%、51.01%和23.97%。不同年龄、部位、大体分型、Borrmann分型和Laurence分型的患者生存有显著差异。结论:肿瘤分期是影响胃癌患者生存的重要因素,应加强人群(尤其是高危人群)胃癌的筛查和早诊早治,进一步改善患者的生存。
[关键词] 胃癌;总生存率;无病生存率;医院登记
[Abstract] Background and purpose: Follow-up data of 6 737 patients undergoing surgery for gastric cancer were collected based on hospital registration, and the 1-, 3- and 5-years observed overall survival (OS) rates and disease-free survival (DFS) rates were analyzed to provide real-world research evidence for the prevention and control of gastric cancer and policy making in China. Methods: A total of 6 737 gastric cancer patients who underwent surgical treatment at Fudan University Shanghai Cancer center from 2015 to 2020 were included in this study. Clinical information and the follow-up endpoint data were collected through medical records review, telephone visits and death registry data linkage. The last follow-up date was November 30, 2023. Kaplan-Meier method was applied in evaluating the 1-, 3- and 5-year OS rate and DFS rate, and survival data were described by different subgroups including age group, gender, treatment period, tumor staging, and pathological characteristics. Results: With a median follow-up time of 50.99 months, the 5-year OS rate of surgically resected gastric cancer patients was 70.37%, and 5-year DFS rate in Ⅰ-Ⅲ stage cases was 69.46%. The 5-year OS rates of stage Ⅰ, Ⅱ, Ⅲ and Ⅳ were 94.32%, 82.56%, 51.01% and 23.97%, respectively. The differences in survival among patients with different age, tumor location, gross classification, Borrmann classification and Laurence classification were significant. Conclusion: Staging is an important factor directly affecting the survival of gastric cancer patients. Screening and early diagnosis and treatment in large population, especially high-risk group, should be strengthened to further improve the patients’ survival.
[Key words] Gastric Cancer; Overall survival; Disease-free survival; Hospital-based registry
胃癌是影响中国居民健康的常见肿瘤,在亚洲人群中尤为高发。2023年发布的中国恶性肿瘤最新数据[1]显示,2016年中国新发胃癌达39.65万例,胃癌死亡28.85万例,发病和死亡均位列所有恶性肿瘤的第3位。
恶性肿瘤患者的生存资料是用于评估恶性肿瘤防控、诊疗和康复水平的重要依据。与其他恶性肿瘤相比,以人群为基础的数据及医院登记的数据均显示胃癌患者预后相对较差,Concord-3项目[2]共纳入62个国家的生存数据,发现全球大多数国家(2010—2014年诊断的患者)的总体年龄别5年净生存率在20%~40%之间。中国国家癌症中心对全国17个癌症登记处以人群为基础的生存研究报告[3]显示,2003—2005年、2006—2008年、2009—2011年和2012—2015年诊断的胃癌患者5年相对生存率分别为27.4%、30.5%、31.8%和35.1%,胃癌患者生存率在过去几年来有一定的提高,但总体胃癌患者的生存仍处于较低水平。基于单中心胃癌专病数据库患者的生存分析[4]显示,2010—2016年3 431例胃癌患者的5年观察生存率为60%。另有1 991例2008—2021年胃癌住院患者的数据[5]显示,5年观察生存率为14.87%。
近年来中国不断普及癌症科普知识,全球胃癌筛查及治疗方法上也有较大的技术更新,尤其是胃癌免疫治疗和个体化精准治疗的出现,给胃癌治疗带来新的飞跃,但对胃癌生存的获益鲜有报道,本研究以医院肿瘤登记为基础,对2015年之后治疗的6 737例接受手术切除的胃癌患者的5年观察生存率进行分析,对不同特征的胃癌生存情况进行详细描述,为了解中国胃癌患者的生存情况提供来自真实世界的数据,反映中国经济发达地区的胃癌诊治水平,为中国的胃癌防控和政策制定提供科学依据。
1 资料和方法
1.1 研究对象
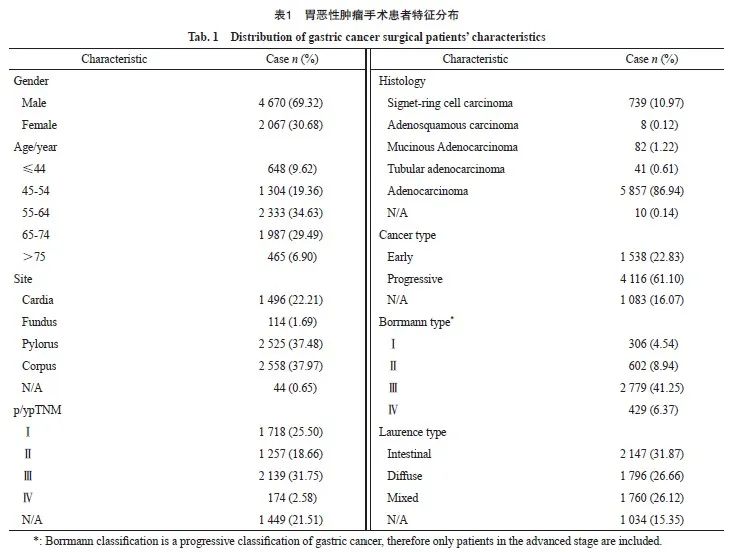
纳入标准包括:① 首次治疗日期在2015年1月1日—2020年12月31日的接受手术切除的胃癌患者,其中接受新辅助治疗的患者首次治疗时间为新辅助治疗开始时间,未行新辅助治疗的患者以复旦大学附属肿瘤医院首次胃癌手术时间为首次治疗时间;② 原发肿瘤部位在胃,即ICD-10编码为C16的患者;③ 病理学类型为腺癌、黏液腺癌、管状腺癌、腺鳞癌或印戒细胞癌的患者。
排除标准包括:① 未在复旦大学附属肿瘤医院行手术治疗的胃癌患者;② 仅行局部切除术未行根治手术的患者;③ 原发灶不在胃的恶性肿瘤患者(如乳腺癌、黑色素瘤、肝癌或原发不明恶性肿瘤侵犯胃等转移性胃癌);④ 胃息肉、胃溃疡、胃肠上皮化生等良性病变或癌前病变;⑤ 病理学类型为恶性黑色素瘤、间质瘤、淋巴瘤或神经内分泌癌的患者。
1.2 随访计划
随访计划详见《以医院登记为基础的20万例恶性肿瘤患者生存报告》[6],即患者出院满1年后进行首次随访,5年内每年1次,5年后每2年1次,直至死亡发生时终止随访。
通过被动和主动随访两种方式收集患者的生存结局资料,包括病史查阅、电话随访和死因数据链接。被动随访主要包括病史查阅和死因数据链接,病史查阅是从患者出院1年后开始,按随访计划规定的周期,查阅门诊及住院病历信息了解患者是否有疾病进展(包括局部复发、远处转移及第二原发恶性肿瘤等)事件,记录疾病进展发生时间和最近1次就诊时间;死因数据链接是指通过与相关省级疾病预防控制中心肿瘤登记系统或死因登记系统进行数据链接和匹配,获得患者死亡结局资料,包括死亡日期和死因。对于随访计划规定的周期内没有任何来院复诊记录的患者,通过电话进行主动随访,由经过培训的、专职随访人员根据病历记录的联系方式联系患者或家属,通过电话问询了解其疾病进展及生存情况,记录疾病进展发生时间及死亡日期和死因。随访信息收集截至时间为2023年11月30日。
1.3 资料收集
本研究收集的资料包括:① 患者基本信息,包括性别、年龄及首次治疗时间等。② 临床信息,包括肿瘤部位、Borrmann分型、Laurence分型、组织学分型及病理学分期等;Borrmann分型根据肿瘤在黏膜面的形态特征和胃壁内的浸润方式,分为Ⅰ型(隆起型、结节型、息肉型)、Ⅱ型(溃疡局限型)、Ⅲ型(溃疡浸润型)和 Ⅳ型(弥漫浸润型);Laurence分型根据胃癌的组织结构和生物学行为,分为肠型、弥漫型和混合型;以组织来源及其异型性为基础的国际分型,分为腺癌、管状腺癌、黏液腺癌、印戒细胞癌和腺鳞癌;病理学分期按国际抗癌联盟(Union for International Cancer Control,UICC) /美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版胃癌TNM分期标准[7]分类,pTNM分期分为Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期。③ 随访信息,包括疾病进展(包括局部复发、远处转移及第二原发恶性肿瘤等)事件及其发生时间、死因、死亡时间和末次随访时间。
1.4 统计学处理
统计指标均采用观察生存率,包括总生存(overall survival,OS)率和无病生存(disease-free survival,DFS)率。OS定义为从患者在复旦大学附属肿瘤医院首次治疗时间至生存终点事件全死因死亡的时间,截至统计时尚未发生终点事件及未知终点事件的患者,在末次随访时间点按删失处理。DFS定义为从患者在复旦大学附属肿瘤医院首次治疗时间至初次发生疾病进展(包括局部复发、远处转移及第二原发恶性肿瘤等)事件及全死因死亡在内的任一事件的时间,截止统计时尚未发生以上任一终点事件及未知终点事件的患者,在末次随访时间点按删失处理。
采用Kaplan-Meier法估计1、3及5年观察生存率及其95% CI,并根据不同年龄组、性别、治疗时期、肿瘤分期、病理学特征及组织学分级等亚组,分别描述不同特征患者的OS率和DFS率。使用SPSS 22.0软件对数据进行统计分析。检验水准采用双侧α=0.05,P<0.05为差异有统计学意义。
1.5 数据质量
截至2023年11月30日,所有患者随访期间死亡1 684例,占25.00%;44例失访,占6.53‰;6 636例接受过至少1次随访的患者,随访覆盖比例达到98.50%,所有患者的中位随访时长为50.99个月(范围为49.96~52.02个月),随访满5年者1 794例,占26.63%,估计5年内的患者生存率较为稳健。
2 结 果
在所有6 737例住院接受手术治疗的胃癌患者中,69.32%为男性,30.68%为女性,平均年龄为(59.48±11.18)岁。肿瘤部位中,22.21%的患者发生在贲门,37.48%发生在胃幽门窦,37.97%发生在胃体。从病理学分期来看,Ⅰ期、Ⅱ期和 Ⅲ期的患者分别占25.50%、18.66%和31.75%;组织学类型以腺癌为主,占86.94%,另有10.97%为印戒细胞癌。从大体分型看,22.83%为早期浅表型胃癌,61.10%为进展期胃癌。Borrman分型显示,大部分为Ⅲ型浸润溃疡型,占41.25%。Laurence分型显示,31.87%为肠型,26.66%为弥漫型,26.12%为混合型(表1)。
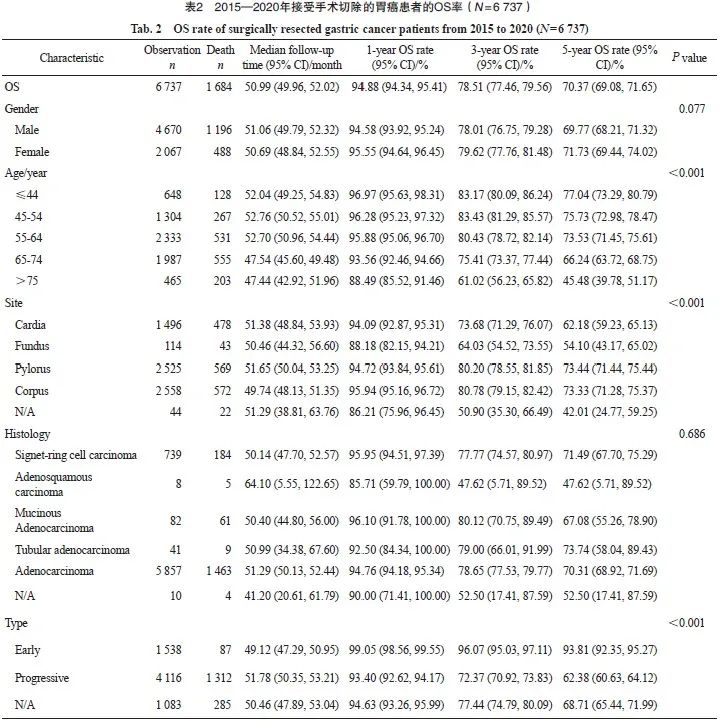
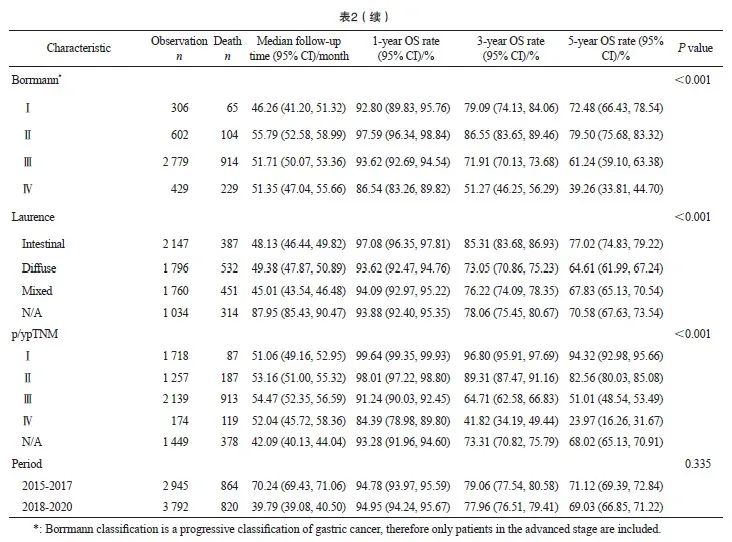
2015—2020年接受手术切除的胃癌患者的1、3和5年OS率分别为94.88%、78.51%和70.37%。男女性的OS率差异无统计学意义(P=0.077)。不同年龄、部位、大体分型、Borrmann分型、Laurence分型和分期的患者生存存在显著差异。5年OS率与年龄呈反比,年龄越大生存越差,75岁以上年龄组患者5年生存率显著低于其他年龄组。从部位来看,胃幽门窦和胃体的生存差异不显著,胃幽门窦和胃体的生存显著优于贲门和胃底。印戒细胞癌、腺癌、黏液腺癌和管状腺癌的生存差异不显著,早期浅表型的生存显著高于进展期,Laurence分型中肠型的生存优于弥散性,Borrmann分型Ⅰ型和Ⅱ型的5年OS差异不大(分别为72.48%和79.50%),但均显著高于Ⅲ型(61.24%)和Ⅳ型(39.26)。不同分期的患者生存状况差异明显,Ⅰ期、Ⅱ 期、Ⅲ期和Ⅳ期患者的5年OS率分别为94.32%、 82.56%、51.01%和23.97%。不同时期来看, 2015—2017年和2018—2020年两阶段的患者OS率差异无统计学意义(P=0.335,表2)。
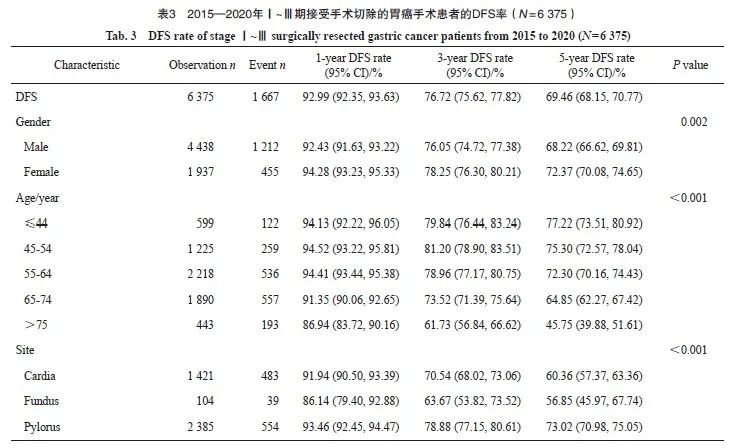
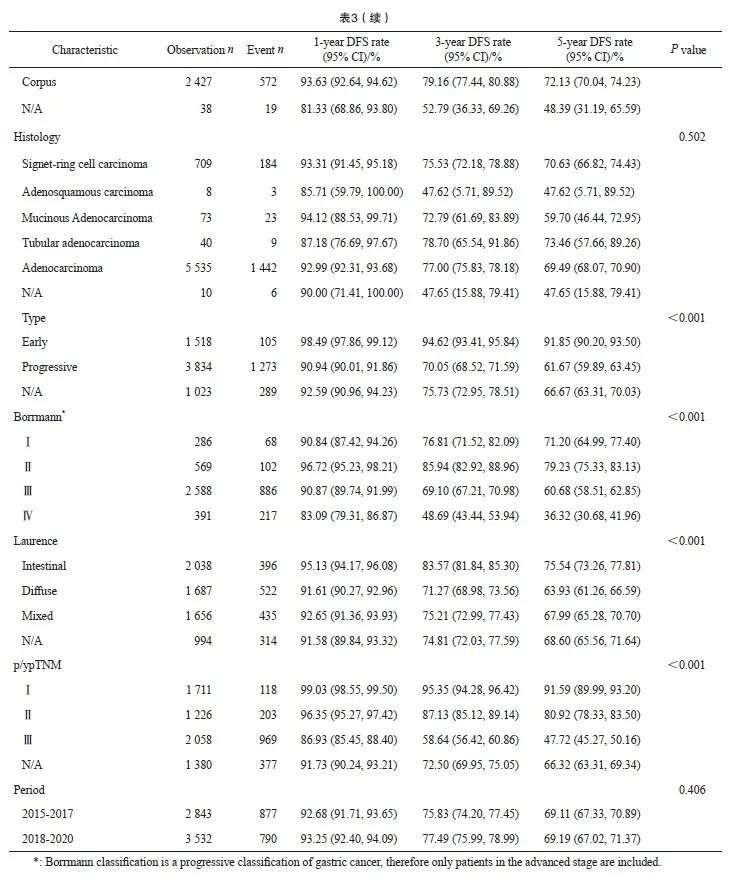
2015—2020年Ⅰ~Ⅲ期接受手术切除的胃癌患者的1、3和5年DFS率分别为92.99%、76.72%和69.46%。女性患者的5年DFS率为72.37%,高于男性的68.22%(P=0.002)。不同年龄、不同部位、大体类型、Bormann分型、Laurence分型和pTNM分期的患者生存存在显著差异,不同组织学分型和不同时期的胃癌患者生存未见显著差异。Ⅰ期、Ⅱ期和Ⅲ期患者5年DFS率分别为91.59%、80.92%和47.72%(表3)。
3 讨 论
本研究总结了以国内单中心医院登记为基础的6 737例接受手术切除的胃癌患者的生存结局,描绘了不同特征患者的5年OS率和DFS率,为中国胃癌患者的生存提供了真实世界数据,反映了中国经济发达地区近年来的胃癌防治效果和预后,是国内罕见的大规模胃癌长期随访且具有丰富临床信息的生存报告,为了解中国胃癌诊疗水平提供了可靠依据。
基于人群的肿瘤登记资料显示,全球胃癌患者的总体预后较差。美国国家癌症研究所(National Cancer Institute,NCI)的监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库的统计结果[8]显示,2012—2016年的5年总体年龄标准化相对生存率为40.6%。日本人群登记的胃癌5年OS率从1991年开始就一直维持在68.2%[9]。韩国中央癌症登记处的人群癌症数据库[10]显示,韩国2013—2019年的胃癌5年相对生存率为77.0%。上海肿瘤登记资料[11]显示,2002—2006年上海市胃癌患者的5年OS率为32.15%。本研究的数据是以医院为基础的登记数据,与人群登记的数据是存在较大差异的,结果显示,接受手术治疗的患者5年OS率为70.37%,与日本国家癌症登记中心登记的2001—2007年10万例接受手术切除的胃癌患者的数据一致(5年OS率为71.1%)[12]。日本和韩国的胃癌生存要显著高于全球其他地方,主要归因于人群胃癌筛查,日本从20世纪60年代就开始建立了基于健康保险的胃癌普查,推出政府主导的基于社区人群的胃癌筛查计划[13],而韩国也在2002年就开始进行全国性的胃癌筛查[14-15],推荐40~74岁居民每2年进行1次胃镜筛查。
从不同病理学分期的生存数据来看,美国SEER数据库登记的数据[8]显示,2012—2016年局部、区域和转移胃癌患者5年相对生存率分别为75.0%、38.0%和10.0%。韩国人群癌症数据库登记的数据[10]显示,2013—2019年局部、区域和转移患者的5年相对生存率分别为96.8%、 61.8%和5.2%。上海肿瘤登记数据[11]显示, 2002—2006年Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期胃癌患者的5年OS率分别为71.37%、56.65%、32.53%和13.91%。日本接受手术切除的患者2001—2007年 ⅠA期、ⅠB期、Ⅱ期、ⅢA期、ⅢB期和Ⅳ期的5年OS率分别为91.5%、83.6%、70.6%、53.6%、 34.8%和16.4%[12]。本研究数据显示,接受手术治疗的总体患者5年OS率为70.37%,Ⅰ期、Ⅱ 期、Ⅲ期和Ⅳ期患者的5年OS率分别为94.32%、 82.56%、51.01%和23.97%。医院登记数据中不同病理学分期的5年OS率均显著高于人群登记数据,提示胃癌患者通过规范治疗,可显著改善预后。不同分期的生存数据真实地反映了中国发达城市胃癌的防治水平和预后情况。
胃癌的生存与分期密切相关。本研究数据显示,接受手术治疗的Ⅰ期胃癌患者的5年OS率可达94.32%,而Ⅳ期患者即使有手术机会,5年OS率也仅为23.97%,人群登记中那些无法进行手术治疗的患者则预后更差。中国胃癌患者总体预后较差,主要原因是诊断时大部分患者都已是晚期[16]。因此,早期发现、早期诊断是延长胃癌患者生存最重要的手段。日本和韩国因开展人群筛查,大部分胃癌患者都可以早期发现、早期诊断和治疗,极大地提高了生存率。虽然中国胃癌发病率较高,但开展大规模的人群筛查仍有一定限制,如经济情况、地区差异、健康知晓度、卫生服务条件和卫生服务普及度等。然而,针对高危人群进行的精准筛查仍是行之有效的,可显著提高早期诊断率,降低死亡并改善预后,提高生存率。大量证据[17-22]表明,幽门螺杆菌感染、胃癌家族史、吸烟、饮酒、肥胖、高盐饮食、各种腌制(如咸鱼、腌肉和咸菜等)、煎炸和熏制食品等与胃癌风险增加有关。在一般人群中有效地甄别胃癌高危人群,并对高危人群建立社区筛查制度,是缩小中国与日本、韩国等国家胃癌生存差距、提高中国胃癌早期诊断率的有效方法。2022年,国家癌症中心制定了《中国胃癌筛查与早诊早治指南(2022,北京)》[23],为中国的胃癌早筛工作奠定了基础。2023年中国抗癌协会胃癌专业委员会及中国医师协会外科医师分会上消化道外科医师委员会联合发布了《中国人群胃癌风险管理公众指南(2023版)》[24],通过专家意见形成公众指南来指导个体精准化胃癌预防。未来,期望进一步加强胃癌的科普,提高公众对自身危险因素的识别,并有效践行高危人群的筛查计划,提高胃癌筛查覆盖率,改善胃癌患者预后并提高生存率。
本次研究中胃癌患者男女比例为7∶3,男女性的5年OS率分别为69.77%和71.73%(P=0.077),男女性的5年DFS率有显著差异(男性的5年DFS率为68.22%,女性为72.37%,P=0.002),提示男性发病较女性多,但预后却相对较差,可能与男性更倾向于不良生活方式和不良饮食有关。男性有更多的高危因素,如男性吸烟更多、饮酒更多。另有研究[25]表明,雌激素能降低胃癌的风险,女性绝经后胃癌风险增加,而绝经后女性雌激素替代治疗后胃癌发病和死亡风险都有所降低。欧洲一项前瞻性大规模人群队列研究[26]显示,卵巢切除术的女性胃癌发病风险增加了79%[风险比(hazard ratio,HR)=1.79,95% CI:1.15~2.78]。另有研究[27-28 ]发现,在胃癌组织中,雌激素受体(estrogen receptor,ER)α阳性率与胃癌淋巴结转移及浸润深度有关,抑制ERα可降低胃癌细胞扩散和侵袭。有研究[29]表明,ERα信号转导通路调控肿瘤细胞葡萄糖代谢和蛋白质水平,从而参与胃癌的发生。虽然动物实验、体外实验及流行病学研究[30]均提示高雌激素水平可能与胃癌低风险相关,雌激素水平差异可能是胃癌发病及生存差异的原因之一,但仍需进一步探索其作用机制,并通过大规模前瞻性队列研究加以验证,从而为胃癌的治疗提供新的思路。
本研究有一定局限性:首先,本研究并非以人群为基础数据,无法计算相对生存率,不宜与以人群为基础的流行病学数据进行直接比较;其次,本研究未纳入无法进行手术治疗的晚期胃癌患者,这部分患者预后更差;再次,2018—2020年诊断的患者随访时间未满5年,因此估计的5年生存率可能存在一定偏倚;最后,本研究为描述性研究,描述了不同临床或病理学特征的胃癌患者总的OS率与DFS率,并未对影响因素之间的混杂因素进行校正,因此对影响生存的因素的解释存在一定局限。目前关于中国胃癌生存的大规模研究较少,本研究报告了大样本量胃癌患者术后的生存数据,数据基于完善的病例死亡事件随访系统,主动和被动随访相结合,确保了随访数据的较高完整性和准确性。未来期望在本研究的基础上,探索胃癌手术后影响生存的危险因素,并对各个因素进行深入分析,为提高胃癌患者的生存质量、延长生存期提供证据和支持,并期望相关的研究成果能应用到临床实践,推动胃癌筛查等相关政策的制定和实施以及更多规范治疗的推广普及。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
沈洁:数据收集分析整理,文章撰写和修改;
王江立:数据分析构架指导,文章修改;
王泽洲,莫淼,周昌明,袁晶:数据收集,数据分析指导;
徐大志,郑莹:课题设计,文章修改指导。
[参考文献]
[1]ZHENG R S, ZHANG S W, ZENG H M, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[2]ALLEMANI C, MATSUDA T, DI CARLO V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075.
[3]ZENG H M, CHEN W Q, ZHENG R S, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567.
[4]梁文全, 郗洪庆, 乔 屾, 等. 基于单中心万例胃癌专病数据库的胃癌外科临床病理信息分析[J]. 中华胃肠外科杂志, 2020, 23(11): 1051-1058.
LIANG W Q, (CHI/XI) H Q, QIAO S, et al. Analysis of clinicopathologic characteristics of gastric cancer patients undergoing gastrectomy based on a single-center gastric cancer database with above 10 000 cases[J]. Chin J Gastrointest Surg, 2020, 23(11): 1051-1058.
[5]徐 辉, 吴志军, 张 澄, 等. 1991例以医院为基础的胃癌双向性队列研究患者生存分析[J]. 肿瘤学杂志, 2023, 29(10): 847-852.
XU H, WU Z J, ZHANG C, et al. Survival analysis of patients with gastric cancer: a hospital-based bidirectional cohort study[J]. J Chin Oncol, 2023, 29(10): 847-852.
[6]周昌明, 莫 淼, 袁 晶, 等. 以医院登记为基础的20万例恶性肿瘤患者生存报告[J]. 中国癌症杂志, 2020, 30(1): 11-24.
ZHOU C M, MO M, YUAN J, et al. Report on 200 thousand cancer patients’ survival from a hospital-based cancer registry database[J]. China Oncol, 2020, 30(1): 11-24.
[7] American Joint Committee on Cancer. AJCC Cancer Staging Manual[M]. 8th edition. Chicago: Springer, 2018.
[8] LI Y M, FENG A Z, ZHENG S, et al. Recent estimates and predictions of 5-year survival in patients with gastric cancer: a model-based period analysis[J]. Cancer Control, 2022, 29: 10732748221099227.
[9] J A P A N E S E G A S T R I C C A N C E R A S S O C I A T I O N REGISTRATION COMMITTEE, MARUYAMA K, KAMINISHI M, et al. Gastric cancer treated in 1991 in Japan: data analysis of nationwide registry[J]. Gastric Cancer, 2006, 9(2): 51-66.
[10] PARK S H, KANG M J, YUN E H, et al. Epidemiology of gastric cancer in Korea: trends in incidence and survival based on Korea central cancer registry data (1999-2019)[J]. J Gastric Cancer, 2022, 22(3): 160-168.
[11] 彭 鹏, 吴春晓, 龚杨明, 等. 上海人群胃癌生存率研究[J]. 中国癌症杂志, 2016, 26(5): 414-420.
PENG P, WU C X, GONG Y M, et al. Survival analysis of patients with gastric cancer in Shanghai[J]. China Oncol, 2016, 26(5): 414-420.
[12] KATAI H, ISHIKAWA T, AKAZAWA K, et al. Five-year survival analysis of surgically resected gastric cancer cases in Japan: a retrospective analysis of more than 100 000 patients from the nationwide registry of the Japanese Gastric Cancer Association (2001-2007)[J]. Gastric Cancer, 2018, 21(1): 144-154.
[13] OSHIMA A. A critical review of cancer screening programs in Japan[J]. Int J Technol Assess Health Care, 1994, 10(3): 346-358.
[14] HONG S R, LEE Y Y, LEE J, et al. Trends in cancer screening rates among Korean men and women: results of the Korean national cancer screening survey, 2004-2018[J]. Cancer Res Treat, 2021, 53(2): 330-338.
[15] KIM T H, KIM I H, KANG S J, et al. Korean practice guidelines for gastric cancer 2022: an evidence-based, multidisciplinary approach[J]. J Gastric Cancer, 2023, 23(1): 3-106.
[16] YANG L, ZHENG R S, WANG N, et al. Incidence and mortality of stomach cancer in China, 2014[J]. Chin J Cancer Res, 2018, 30(3): 291-298.
[17] LUO G F, ZHANG Y T, GUO P, et al. Global patterns and trends in stomach cancer incidence: age, period and birth cohort analysis[J]. Int J Cancer, 2017, 141(7): 1333-1344.
[18] PLUMMER M, FRANCESCHI S, VIGNAT J, et al. Global burden of gastric cancer attributable to Helicobacter pylori[J]. Int J Cancer, 2015, 136(2): 487-490.
[19] CHAN O O, WONG B. Risk factors for gastric cancer (updated on April 20, 2023)[EB/OL].(2023-04-20) [2023-12-21]. https://www.uptodate.com/contents/risk-factors-forgastric-cancer.
[20] YANG P, ZHOU Y, CHEN B, et al. Overweight, obesity and gastric cancer risk: results from a meta-analysis of cohort studies[J]. Eur J Cancer, 2009, 45(16): 2867-2873.
[21] SHIMAZU T, WAKAI K, TAMAKOSHI A, et al. Association of vegetable and fruit intake with gastric cancer risk among Japanese: a pooled analysis of four cohort studies[J]. Ann Oncol, 2014, 25(6): 1228-1233.
[22] THRIFT A P, WENKER T N, EL-SERAG H B. Global burden of gastric cancer: epidemiological trends, risk factors, screening and prevention[J]. Nat Rev Clin Oncol, 2023, 20(5): 338-349.
[23] 赫 捷, 陈万青, 李兆申, 等. 中国胃癌筛查与早诊早治指南(2022,北京)[J]. 中国肿瘤, 2022, 31(7): 488-527.
HE J, CHEN W Q, LI Z S, et al. China guideline for the screening, early detection and early treatment of gastric cancer(2022, Beijing)[J]. China Cancer, 2022, 31(7): 488-527.
[24] 中国抗癌协会胃癌专业委员会, 中国医师协会外科医师分会上消化道外科医师委员会, 中国人群健康风险管理协作组-胃癌专业组. 中国人群胃癌风险管理公众指南(2023版)[J]. 中华医学杂志, 2023, 103(36): 2837-2849.
The Gastric Cancer Professional Committee of the Chinese Anti-Cancer Association, The Upper Gastrointestinal Surgeons Committee of the Surgical Branch of the Chinese Medical Association, The Gastric Cancer Professional Group of the Chinese Population Health Risk Management Collaboration Group. Chinese guideline on risk management of gastric cancer in the general public (2023 edition)[J]. Natl Med J China, 2023, 103(36): 2837-2849.
[25] CAMARGO M C, GOTO Y, ZABALETA J, et al. Sex hormones, hormonal interventions, and gastric cancer risk: a meta-analysis[J]. Cancer Epidemiol Biomarkers Prev, 2012, 21(1): 20-38.
[26] DUELL E J, TRAVIER N, LUJAN-BARROSO L, et al. Menstrual and reproductive factors, exogenous hormone use, and gastric cancer risk in a cohort of women from the European prospective investigation into cancer and nutrition[J]. Am J Epidemiol, 2010, 172(12): 1384-1393.
[27] YOKOZAKI H, TAKEKURA N, TAKANASHI A, et al. Estrogen receptors in gastric adenocarcinoma: a retrospective immunohistochemical analysis[J]. Virchows Arch A Pathol Anat Histopathol, 1988, 413(4): 297-302.
[28] UR RAHMAN M S, CAO J. Estrogen receptors in gastric cancer: advances and perspectives[J]. World J Gastroenterol, 2016, 22(8): 2475-2482.
[29] FU Z Q, WANG X M, WANG Z Y, et al. Estrogen receptor- α36-mediated rapid estrogen signaling regulates 78 kDa glucose-regulated protein expression in gastric carcinoma cells[J]. Oncol Lett, 2018, 15(6): 10031-10036.
[30] 顾建华, 王少明, 魏文强. 性激素与胃癌发病风险的研究进展[J]. 中国肿瘤, 2020, 29(10): 768-776.
GU J H, WANG S M, WEI W Q. Progress in research on relationship between sex hormones and gastric cancer[J]. China Cancer, 2020, 29(10): 768-776.
J HEMATOL ONCOL: 可切除胃癌患者围术期与辅助化疗的对比研究(RESONANCE):一项随机、开放标签、III期临床试验
![]() 0
2024-04-11
点击查看
0
2024-04-11
点击查看
【专家述评】| 21世纪以来胃癌治疗进展及未来展望
![]() 0
2024-04-11
点击查看
0
2024-04-11
点击查看

病理规培图库 || 胃印戒细胞癌
![]() 0
2024-04-17
点击查看
0
2024-04-17
点击查看

【专家述评】| 胃癌外科治疗的新进展及发展趋势
![]() 0
2024-04-12
点击查看
0
2024-04-12
点击查看
邓婷教授:胃癌从预防到治疗的核心要点
![]() 0
2024-04-12
点击查看
0
2024-04-12
点击查看

AACR 2024:季加孚团队发现卡度尼利单抗能让胃癌总生存率高达57.3%
![]() 0
2024-04-14
点击查看
0
2024-04-14
点击查看
