2020年4月29日,Lancet在线发表了中国的最新研究成果 《Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial 》。研究通讯作者为中国工程院副院长、中国医学科学院北京协和医学院院校长王辰院士,中日友好医院曹彬教授。试验发现,与安慰剂相比,瑞德西韦治疗COVID-19重症患者,未带来临床改善时间、死亡率或病毒清除时间等获益。


原文链接:
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31022-9/fulltext
研究团队在湖北10家医院进行了这项随机、双盲、安慰剂对照的多中心试验。患者入组条件为入院后经实验室确诊的SARS-CoV-2感染患者(≥18岁),从发病到入组的时间间隔≤12天,血氧饱和度<94%或氧合指数(PaO2/FiO2)≤300 mm Hg,经影像学诊断为肺炎。
患者以2:1的比例被随机分配至瑞德西韦组(第1天200 mg,第2-10天100 mg,每日一次)或安慰剂对照组(剂量与瑞德西韦相同,共10天)。允许患者同时接受洛匹那韦–利托那韦,干扰素和皮质类固醇激素治疗。
主要研究终点是至临床改善时间 (time to clinical improvement),定义为从随机分组到6分临床状况等级量表评分改善2分或到出院的时间,以最先发生的结局为准。
2020年2月6日至2020年3月12日,237例患者符合入组标准(图1)。158例患者被随机分配到瑞德西韦治疗组,79例到安慰剂对照组。安慰剂组中的一名患者在随机分组后撤回了知情同意书,因此ITT分析最终纳入了158例试验组患者和78例对照组患者。
3月12日之后,武汉市疫情得到控制,已没有患者入组,根据研究方案中的试验终止标准,数据安全和监管委员会建议终止研究。研究实际样本量为236(研究计划样本量为453),统计功效从80%降至58%。
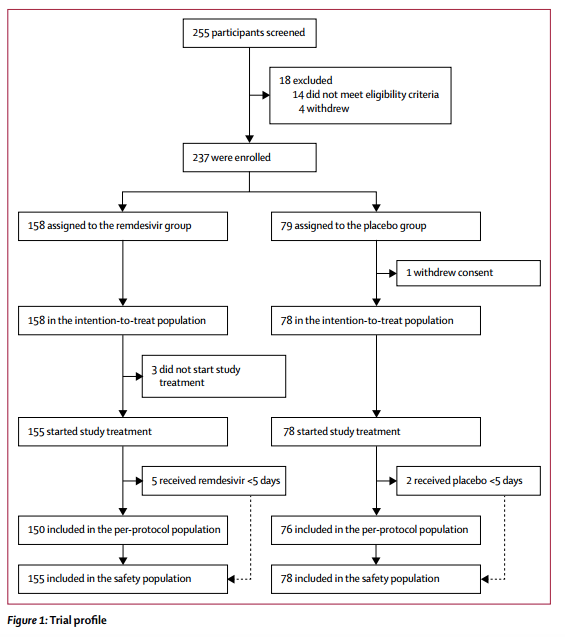
图1. 入组流程
患者的中位年龄为65岁(IQR 56-71);瑞德西韦组89位男性(56%)和69位女性(44%);安慰剂组51位男性(65%)和27位女性(35%)。最常见的合并症是高血压,其次是糖尿病和冠心病。基线时有42例(18%)患者同时服用洛匹那韦–利托那韦。
最终随访时间为2020年4月10日。ITT分析中,瑞德西韦组与对照组的至临床改善时间无明显差异(瑞德西韦组21.0天[IQR 13.0–28.0];对照组23.0天[15.0–28.0];HR 1.23 [95%CI 0.87-1.75];图2)。PP分析得出类似的结果(HR 1.27 [95%CI 0.89-1.80])。
在ITT人群中,对于发病10天内接受治疗的患者,虽然未达到统计学差异,但瑞德西韦组的至临床改善时间从数字上要比安慰剂组更快(瑞德西韦组18.0天[IQR 12.0–28.0];对照组23.0天[15.0–28.0];HR 1.52 [95%CI 0.95-2.43])。
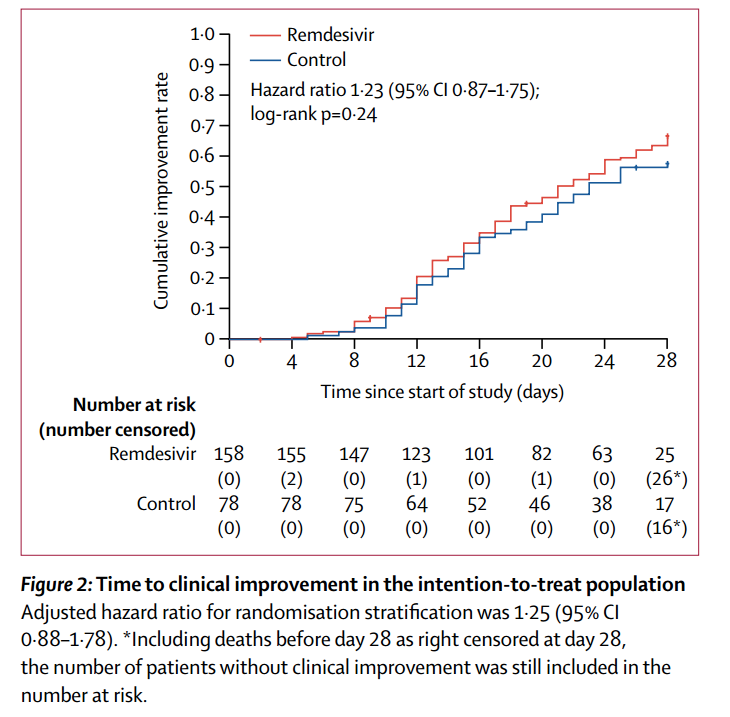
图2. ITT人群中至临床改善时间
两组的28天死亡率相似(瑞德西韦组死亡22例[14%],安慰剂组10例[13%];相差1.1%[95%CI –8.1 to 10.3])。发病10天内治疗的患者,两组的28天死亡率没有显著差异,但安慰剂组在数值上更高;相比之下,更晚用药的患者,两组也没有显著差异,但瑞德西韦组在数值上更高。两组在第14天和第28天的临床改善率也无统计学差异,从数值上瑞德西韦组高于安慰剂组。
瑞德西韦组有102例(66%,102/155)、对照组有50例(64%,50/78)患者发生不良事件。瑞德西韦组最常见的不良事件是便秘,低白蛋白血症,低钾血症,贫血,血小板减少和总胆红素升高;安慰剂组最常见的是低白蛋白血症,便秘,贫血,低钾血症,天冬氨酸转氨酶升高,血脂升高和总胆红素升高。
瑞德西韦组报告了28例(18%)、对照组报告了20例(26%)严重不良事件。瑞德西韦组因不良事件或严重不良事件而终止使用研究药物的患者多于安慰剂组(18 [12%] vs 4 [5%]),其中瑞德西韦组有7例(5%)是由于呼吸衰竭或急性呼吸窘迫综合征。现场调查人员认为,观察期内发生的所有死亡事件均与干预措施本身无关。
本试验发现,与安慰剂相比,瑞德西韦治疗COVID-19重症患者,未带来临床改善时间、死亡率或病毒清除时间等获益。
前段时间,NEJM发表了一项瑞德西韦同情用药的研究,与该研究相比,本试验的人群病情更轻,开始治疗时间更早,这种差异带来的预期是能发现瑞德西韦对本试验人群有更大的益处,但是结果并未达到这一预期。
因为武汉采取了严格的公共卫生措施,3月中旬新患者大幅减少,因此本研究未能纳入目标数量的患者,且由于床位紧张导致大多数患者在病程后期入组,因此无法充分评估更早使用瑞德西韦能否提供临床获益。
总结来说,本研究中使用的瑞德西韦给药方案可以耐受,但在危重COVID-19患者中并未观察到显著的临床或抗病毒作用。但是,本研究还无法排除该药在临床上的价值,因为某些临床参数确实有所降低。正在进行的更大样本量的研究将继续加深我们对瑞德西韦疗效的了解。
4月29日,吉利德公司官网发布了开放标签的3期SIMPLE试验的结果。该试验评估了COVID-19重症住院患者中,瑞德西韦治疗5天和10天的疗效。研究表明,5天疗程和10天疗程的疗效相当(注:该研究没有设置安慰剂对照组)。吉利德计划在未来几周内提交完整数据,以便在同行评审的期刊上发表。
吉利德当天发布了另一个声明,美国国家过敏和传染病研究所(NIAID)对瑞德西韦的研究显示出了疗效,指出该研究已达到主要研究终点。NIAID的官网新闻显示瑞德西韦可加速患者康复,该试验招募了1063名患者,瑞德西韦组患者的至康复时间为11天,安慰剂组患者为15天,瑞德西韦比安慰剂快31%(p<0.001)。
参考来源:
1.https://www.gilead.com/news-and-press/press-room/press-releases/2020/4/gilead-announces-results-from-phase-3-trial-of-investigational-antiviral-remdesivir-in-patients-with-severe-covid-19
2.https://www.niaid.nih.gov/news-events/nih-clinical-trial-shows-remdesivir-accelerates-recovery-advanced-covid-19