Nat Commun:厉害了!挑战“诺奖技术”,CRISPR可“生产”多能干细胞
![]() 0
2018-07-10
点击查看
0
2018-07-10
点击查看

ACS Appl Mater Interfaces:骨靶向调控干细胞的定向迁移研究获进展
![]() 0
2018-07-12
点击查看
0
2018-07-12
点击查看

J Periodontal Res: :牙周肉芽组织中的干细胞群和免疫调节分子
![]() 0
2018-07-23
点击查看
0
2018-07-23
点击查看

Sci Rep:在肾细胞肿瘤中,癌症干细胞标记OCT4和NANOG的共表达能够预测不良预后
![]() 0
2018-08-19
点击查看
0
2018-08-19
点击查看
Nat Methods:缩短至2周!新方法可快速利用干细胞培养脑细胞
![]() 0
2018-08-24
点击查看
0
2018-08-24
点击查看

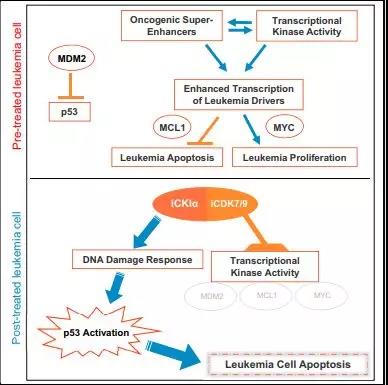
Cell:绝了!白血病治愈率50%!这种药破解40年难题!
![]() 0
2018-08-28
点击查看
0
2018-08-28
点击查看