不同分子亚型的
乳腺癌预后不同。既往利用病理学完全缓解(pCR)来预测预后,但对某些分子亚型并不适用,因此找到替代标志物尤为必要。墨西哥一项研究表明,新辅助化疗(NAC)后残余肿瘤中Ki67降低是DFS和OS显著的预后因素。结果近日在线发表于《The Oncologist》杂志。
背景和目的:
乳腺癌(BC)是一种异质性疾病,过去的十年,基因表达研究已经能够鉴别出不同分子亚型患者具有不同的预后。早期试验采用pCR作为长期治疗有效性的替代指标。然而,对未实现pCR的患者,应该考虑其他生物标志物,从而确定可从进一步辅助治疗中获益的患者。Ki67是一种不同细胞周期阶段(除G0静止期)在细胞核中表达的蛋白。目前,已有多项研究将Ki67作为NAC后pCR率的预测因素。当对于新辅助后具有残余病灶的患者,Ki67的预测作用还了解甚少。所以,此研究的目的是,在NAC后未实现pCR的患者中,评估Ki67水平对长期预后的作用。
方法:
435例IIA~IIIC期BC患者纳入到研究中。患者标准NAC(蒽环类药物+紫杉醇)后无pCR。根据
免疫组化(IHC),将BC定义为以下亚组:管腔A型(ER阳性和PR阳性>20%,HER2阴性,Ki67低)、管腔B型(ER阳性或阴性,PR低,HER2阴性,Ki67高)、三阴性(ER阴性,PR阴性,HER2阴性)、HER2阳性(ER阴性,PR阴性,HER2阳性)、管腔B型/HER2阳性。
根据NAC后Ki67的改变将患者分为:降低组(NAC治疗后,残余肿瘤比最初核心活检的Ki67水平至少降低1%),非降低组(NAC后,Ki67水平增加或无改变)。
DFS的定义为行BC手术当天到局部或远处复发的时间,OS的定义为自BC确诊当天到任何原因死亡或失访的时间。
结果:
基线特征:
435例患者符合入组标准。患者中位年龄为50岁(范围,25~84),52%的患者为绝经前。25%的患者为管腔A型BC,45%为管腔B型,14%为三阴性,5%为HER2阳性,11%为三阳性。NAC前,肿瘤平均大小为6.2cm,68%的患者为T4~T4期,92%淋巴结阳性。52%的患者
临床分期为IIIA~IIIC期,46%为高组织学分级。NAC后,44例患者(10%)行保乳手术。中位残余肿瘤大小为2.5cm(范围,0~5),137例患者(32%)病理学淋巴结状态为ypN0,160例(37%)为ypN1,97例(22%)为ypN2,38例(9%)为ypN3。
Ki67:
NAC前Ki67阳性的中位百分比为20%,NAC后降至10%。57%的残余肿瘤的Ki67阳性率至少降低1%。
DFS:
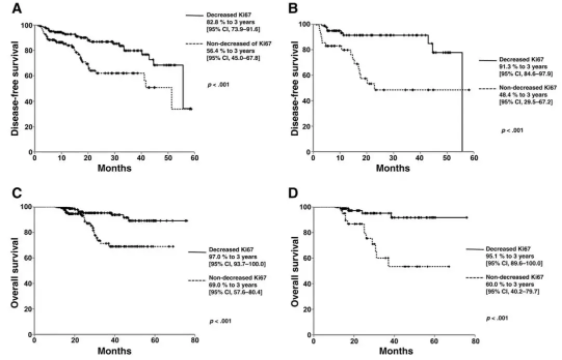
中位随访期为27.4±14.9个月。总体DFS为43.9个月(95% CI,40.8~47.1)。Ki67水平降低的患者比未降低的患者具有更长的中位DFS:47.6个月(95% CI,44.1~51.3)vs 38个月(32.7~43.3)(P <0.001)。Ki67水平降低的患者中,3年DFS率为82.8%(79.3~91.6),Ki67未降低者为56.4%(45.0~67.8)。
单变量分析显示,影响DFS的其他因素包括AJCC分期(II期,78.6(70.5~86.6)vs III期,59.2(45.5~72.9);P<0.001);ER状态(阳性,76.1(68.2~83.9)vs 阴性,57.3(42.6~72.1);P<0.001);PR状态(阳性,73.0(63.9~82.0)vs 阴性,67.4(55.2~79.5);P<0.001)。管腔A型、三阴性、HER2阳性和管腔B型/HER2阳性的DFS和OS无显著性差异。相反,在管腔B型患者中,Ki67降低者比未降低者具有较长的DFS(47个月(39.7~47.6)vs 36.2个月(29.2~43.3);P=0.001)。多变量分析显示,Ki67的差异为所有患者DFS的高度显著的独立预测因素,HR为3.39(1.8~6.37;P<0.001)。
OS:
总体OS为67.2个月(64.3~70.2)。Ki67降低者与未降低者的中位OS分别为71.2个月(68.3~74.2)和55.9个月(50.9~60.9)(P<0.0001),相应的3年OS率分别为97.0%(93.7~100)和69.0%(57.6~80.4)。管腔B型患者中,Ki67降低者的OS为70.7个月(66.7~74.8),未降低者为52.9个月(46.2~59.7)(P<0.0001),3年OS率分别为95.1%(89.6~100)和60%(40.2~79.7)。
单变量分析显示,影响OS的因素为
临床分期(II期,90.8(85.0~90.0)vs III期,76.0(64.4~87.5);P<0.001);ER状态(阳性,89.8(84.7~94.8)vs 阴性,69.0(51.7~86.2);P<0.006);PR状态(阳性,88.9(83.2~94.5)vs 阴性,78.1(66.3~89.8);P=0.040);初始Ki67水平(高于20%,88.4(80.7~96.0),低于或等于20%,84.3(77.2~91.3);P=0.048)。多变量分析表明,Ki67的差异为OS的显著独立预测因素,HR为7.03(2.6~18.7;P<0.001)。
Ki67降低vs未降低患者的DFS和OS:所有肿瘤类型的DFS(A),管腔B型的DFS(B),所有肿瘤类型的OS(C),管腔B型的OS(D)。
结论:
NAC后残余肿瘤中Ki67降低为DFS和OS的显著预后因素。Ki67的改变可准确识别具有高复发和死亡风险的患者,该标志物在管腔B型患者中尤其显著。在管腔B型患者中,Ki67的降低比已知的癌症预后因素(如临床分期和激素受体状态)具有更重要的预测作用。需要进一步的试验检测新的治疗策略来改善BC患者的预后。
点评
NAC后pCR与良好的长期结局强烈相关,然而,未实现pCR的患者可具有不同预后。不幸的是,直到现在,还没有明确的生物标志物可以作为预后的预测因素。对于ER阳性BC患者,此问题更为困难,这是由于此类患者具有较低的pCR率,并且区分具有良好预后和不良预后的患者具有高度挑战性。因此,迫切需要一种生物标志物来替代pCR。
此研究发现,NAC后残余肿瘤中Ki67的改变可用于鉴别具有较好预后的患者,尤其是ER阳性BC患者。结果显示,NAC后,哪怕Ki67评分自基线绝对降低1%就与良好预后相关。
鉴别出NAC后处于高风险的患者对于其个体化治疗策略的制定非常重要。NAC后Ki67未降低的患者具有较差的DFS和OS结局,这使得为此类患者制定专业化的治疗方案提供了可能。这就是Ki67测量的意义所在,也是此研究值得关注的原因。
值得注意的是,在许多情况下,由于不同的观察者和不同的实验室会产生不同的Ki67测量结果,因此业界对Ki67测量的可重复性产生了担忧。另外,所有评估基线和NAC后Ki67水平差异的研究都使用了不同的方法学,因此前瞻性研究对于验证不同的方法学非常必要。
原始出处:
Paula Cabrera‐Galeana, et al. Ki67 Changes Identify Worse Outcomes in Residual Breast Cancer Tumors After Neoadjuvant Chemotherapy. The Oncologist. February 2018.
来源:肿瘤资讯
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言