乙型肝炎病毒(Hepatitis B virus,HBV)是引发慢性乙型肝炎的“罪魁祸首”,易导致肝硬化、甚至于肝癌。乙肝病毒一般通过血液、性接触和母婴三种途径传播,其中血液传播是最主要的传播途径。
虽然预防性乙肝疫苗、抗病毒治疗药物已经上市,但是全球每年仍然有65万人死于HBV感染所致的肝衰竭、肝硬化和肝癌。而作为乙肝大国,中国约有9,300万慢性HBV感染者,其中慢性乙肝患者约2,000万例。在我国肝硬化和肝癌患者中,由HBV感染引起的比例分别高达60%和80%以上。
这主要与疫苗覆盖率、治疗手段有限有关,现有的治疗药物主要分为两种:注射干扰素(IFN-α)和口服核苷类似物(NAs),虽然能够有效抑制病毒,但是存在长期用药、病毒耐药性、易复发等问题。
解析HBV的生命周期:对其步步封锁,寻找新的清除靶点
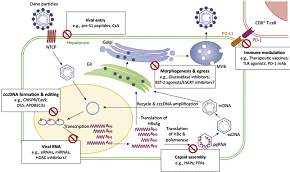
乙肝病毒入侵、感染宿主细胞的过程:最初,乙肝病毒与宿主肝细胞表面受体NTCP结合,会“脱掉蛋白外衣”去除乙肝表面抗原(HBsAg)。剩余的病毒颗粒侵入细胞,并将病毒松弛状的双链DNA运输至细胞核内。病毒DNA进入宿主细胞核,在DNA聚合酶的作用下,两条链的缺口均被补齐,形成共价闭合环状的超螺旋DNA分子,即cccDNA。前基因组RNA出核逆转录形成rcDNA,与编码的外膜蛋白组装形成新的病毒颗粒。这些新合成的病毒颗粒要么再次进入细胞核补充cccDNA,要么以出芽的方式感染邻近的正常肝细胞。
图中红色标记的是预期的抗病毒靶点:病毒入侵、cccDNA形成、病毒DNA转录、衣壳组装、病毒包装及排出、免疫抗性。
cccDNA是乙肝病毒前基因组RNA(pgRNA)复制的原始模板,是病毒复制、感染细胞的核心。只有清除了细胞核内的cccDNA,才能彻底消除乙肝患者病毒携带状态,这也是是抗病毒治疗的目标。
目前的治疗手段并不能彻底清除病毒。不少科研机构、医药企业正在致力于寻找新的切入点。他们希望,通过整合这些不同的方法能够提高慢性乙肝病毒持续感染的治愈率。
1、病毒进入抑制剂(Entry Inhibitors)
病毒进入抑制剂应当是阻断病毒感染的第一道“大门”。考虑到肝细胞表面的NTCP是与病毒识别的受体,且与病毒大分子蛋白的pre-S1结构域存在互作,所以科学家们纷纷把目光锁定在NTCP受体上。
动物试验已经证实,酰化pre-S1多肽能够抑制HBV感染及肝内传播。此外,另一种抑制剂是环孢霉素A(cyclosporine A)。它是一款已获FDA批准的免疫调节剂。环孢霉素A衍生物可以阻断pre-S1多肽与NTCP受体互作,从而实现防止病毒入侵的目标。
除了直接靶向NTCP受体,包括白细胞介素-6、视黄酸受体拮抗剂在内的药物则是通过抑制NTCP表达阻断病毒入侵。
但是,即便上述药物能够抑制病毒入侵,仍然存在3大问题:
首先,酰化pre-S1能否抑制本已存在肝细胞核内的cccDNA?一旦pre-S1酰化过程终止,HBV病毒势必卷土重来。这意味着,它并不能根除病毒DNA。
其次,NTCP受体并一定是HBV与宿主细胞互作的唯一受体。一旦被证实还存在其他受体,就意味着靶向NTCP很可能不能完全阻止病毒感染。
最后,NTCP受体蛋白由SLC10A1基因编码。该基因并非人类细胞所特有。NTCP的正常生理功能是运输胆汁酸。然而,现有的候选药物并不能通过抑制胆汁酸运输而阻断病毒入侵。
不过,科学家表示,病毒入侵抑制剂可以与其他治疗药物结合使用,有望增强病毒防御能力。
2、通过CRISPR/Cas9破坏HBV cccDNA
cccDNA是乙肝病毒得以猖獗、复发、耐药的根源。科学家希望通过基因编辑技术破坏病毒的复制、表达过程,例如ZFNs、TALENs和CRISPR/Cas9。科学家选择最为保守、适用于多种HBV基因型的多切割位点,破坏cccDNA结构和稳定性,从而瓦解HBV复制模板。
虽然这些试验在体内、体外都得到了很好的验证,但是它依然存在局限性:
其一,CRISPR/Cas9治疗本身存在伦理担忧和安全顾虑。例如,Cas9酶存在脱靶隐患,易引发非目标基因组的损伤。所以需要确保CRISPR/Cas9能够精准识别cccDNA,而非宿主基因组。
其二,这种策略可能会导致抗CRISPR/Cas9的HBV变体。所以,挑选多切割位点很必要,它能够尽可能降低抗性出现的概率。
其三,CRISPR/Cas9技术的精髓在于它能够直接靶向cccDNA,但是已有的研究并没有比较剪切前、剪切后的cccDNA分子量变化,而是转向检测HBsAg、HBV总DNA等指标。
其四,这种治疗方法依赖于CRISPR/Cas9体系进入被感染细胞的效率。只有大多数被感染细胞经过CRISPR/Cas9技术处理,病毒才能够被控制住。
其五,少量cccDNA存在于微型染色体上。现在并不确定基因编辑技术能否靶向这一部分。
3、表观遗传学修饰cccDNA
除了瓦解其结构之外,科学家希望通过表观遗传学修饰cccDNA使其沉默不表达,主要方式包括DNA甲基化、组蛋白翻译后修饰。
已有研究证实,cccDNA转录、HBV复制能够被干扰素、白介素- 6、X蛋白、组蛋白去乙酰化酶抑制剂、P300抑制剂表观修饰。但是,围绕这一方法是否有效的研究一直未成定论,例如组蛋白去乙酰化酶抑制剂能否恢复HBV复制仍然需要验证。
事实上,组蛋白去乙酰化酶抑制剂会影响机体血小板数量,且存在激活潜伏期病毒的风险。如果这些未知、隐患被克服后,表观遗传学修饰cccDNA能够作为抗乙肝病毒的有效策略之一。
4、抗病毒miRNA和 siRNA
SiRNAs具有沉默基因表达的能力。同样,作为非编码RNA,miRNAs同样具有抑制基因表达的功能。迄今为止,超30种候选siRNA和至少3种miRNA作为候选分子参与各类疾病治疗的临床研究。
几种基于siRNA的抗HBV药物正处于临床试验阶段:ARC-520药物能够直接靶向不同HBV变体的保守序列,在细胞、动物模型验证中能够显著抑制病毒RNA、蛋白和DNA。围绕ARC-520的临床Ⅱa期试验结果都显示良好。此外,包括miR-130a、miR-125a-5p和miR-199a-5p在内的几种miRNAs被证实抑制HBV复制。
5、抑制衣壳包装
异芳基—二氢嘧啶(HAPs)、phenylpropenamides(PPAs)化合物被证实能够干扰病毒衣壳蛋白的形成,相关试验正处于临床前/临床研究中。另一种抑制衣壳组装药物是GLS4(HAPs的衍生物BAY41-4109)。这些抑制剂能够干扰pgRNA衣壳化过程,影响蛋白外壳的稳定性或者使得衣壳结构异常。
6、抑制新组装病毒排出
抑制病毒颗粒分泌,能够有效阻断病毒扩大感染规模。利用α-葡萄苷酶抑制剂、亚氨基糖衍生物等化合物抑制内质网或者高尔基糖基化过程。这一步能够有效阻断表面抗原HBsAg的组装,从而减少感染性病毒的扩散。此外,干扰素诱导因子tetherin被证实能够抑制HBV分泌。
7、治疗性疫苗
HBV慢性感染会与体内特异的T细胞达成协议,形成免疫耐受(immunologic tolerance)。免疫疗法则是针对耐受性,激活T细胞攻击感染HBV病毒细胞。
科学家希望通过注射治疗性疫苗特异性激活与HBV不应答的T细胞。但是相关临床Ⅰ期试验结果却不佳,无论是病毒E抗原标、血清转化还是病毒DNA指标变化都不显著。
除了激活对HBV特异不应答的T细胞,如何持续维持细胞毒性T淋巴细胞(CTL)的活跃度也很重要。Toll类受体-9(TLR-9)能够诱导CD11b+髓系细胞聚集,从而进一步促进CTL在肝脏的活跃度。
虽然,通过拉米夫定结合混合有各类HBV ORFs和免疫调节剂IL-12的DNA疫苗进展治疗白种人患者则表现出良好的效果,但是,结合疫苗和阿德福韦(adefovir)治疗韩国患者却未能出现预期效果。
近期,有研究团队开发出依赖于乙肝表面抗原-乙型肝炎免疫球蛋白复合体和明矾佐剂的疫苗,并通过了临床Ⅲ期试验,但是仍然需要后续试验以确定其有效性。目前,几项关于治疗性疫苗的临床研究正在进行中,例如ABX203(临床Ⅱ/Ⅲ期)、TG1050(临床Ⅰ期)。
8、PD-1抗体免疫治疗
PD-1抗体作为抗癌治疗的热门武器,也可以用于瓦解慢性病毒感染。对于非活动性乙肝病毒携带者,抑制PD-1能够启动对病毒特异的CD8+T细胞。
有研究人员结合三种方法治疗感染乙肝病毒(WBV)的土拨鼠:首先用恩替卡韦药物治疗持续28周, 从12周开始加上治疗性疫苗,在24周的时候注射PD-1抗体。结果发现,患病动物体内的CD8+T细胞活跃、抗体浓度增加、病毒DNA下降。
原始出处:Chiaho Shih, Shu-Fan Chou, Ching-Chun Yang,Jyun-Yuan Huang,Gansukh Choijilsuren,Ren-Shiang Jhou.Control and Eradication Strategies of Hepatitis B Virus.Trends in Microbiology.June 07, 2016.