在 20 年前,我刚开始做临床研究监察员(CRA)的时候,去试验中心只需要带一本方案加上一个笔记本就可以。那时候的笔记本不是现在的电脑笔记本,那时的笔记本是纸做的。 随着科技的发展,临床研究这个产业也发生了翻天覆地的变化。不但产生了许多专业工具、派生了更多专业部门,而且对于从业人员的要求也逐渐改变。下面我从以下三个方面介绍现代新药临床研究的状况。
【1. 临床研究的新工具】
1.1 电子病例报告表(Case Report Form,CRF)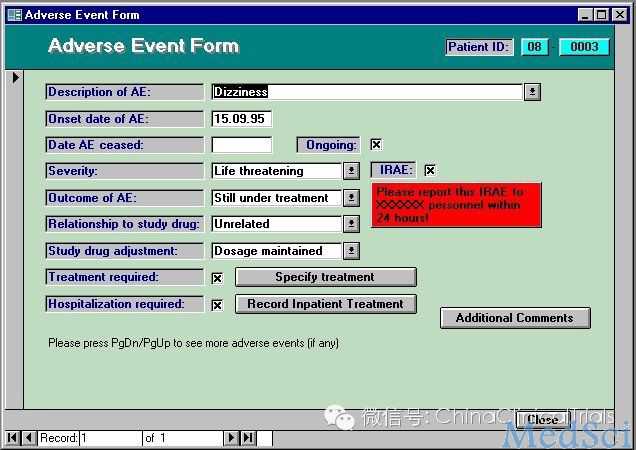
现在国内的临床研究多数还是在用纸质 CRF,但在欧美地区,已经几乎没有纸质 CRF,以前曾有过一种过渡模式,那是纸质 CRF 表的传真系统,也就是将纸质 CRF 表及时传真到数据管理部门,让数据管理部门第一时间获得数据,并完成相应的数据录入。电子 CRF
的出现,让临床研究监查的模式发生了革命性的变化。电子 CRF 不但可以让数据同步输入到数据库,而且将数据库的逻辑检错功能直接体现在病例报告表的输入页面。通过浏览网络化的病例报告表,CRA 和项目经理在办公室就能远程监查各试验中心患者入选和访视情况。CRA 在去试验中心之前,可以事先浏览电子 CRF 中的数据,这样可使现场监查更有效率和针对性。由于数据的录入是及时同步到数据库中,在数据库锁定的一刹那,就可以进行统计分析,减少了中间环节及错误率,提高了工作效率。同时,电子数据采集(EDC)也在不断整合一些新的功能,让监查工作更为简便。例如,在 EDC 中预先设定每次访视的时间窗,如果患者访视超过时间窗,系统会自动提醒。自动设定正常值的范围,对正常值范围的值有自动提醒;对于极端的离群值也有自动提醒;对于每次的更改,都有修改痕迹;对于不良事件,自动提醒是否有相应的伴随用药;对于新的用药,也自动提示是否有对应的不良事件。这些功能使临床研究的
效率大大提高。
但电子 CRF 表也有一些弊端。首先,电子 CRF 表需要培训以后才可以得到用户名和密码。很多 CRA 对那冗长的培训过程感到害怕。不但不同种类的 电子CRF表(Inform,Rave,PDS等等)需要完成不同的培训,同一种电子CRF表的不同版本也需要继续培训。一方面各种电子 CRF 表的版本在不断的升级,另一方面生产电子 CRF 表的公司也在不断地被并购。不同的公司有不同的 SOP,所以要求也不一样。一个 CRA 承担不同的项目,可能要同时涉及到几种不同的电子 CRF,都需要完成相应培训,增加了不少的工作量。特别是更换CRA的时候,需要新的CRA很快上手,却往往被电子 CRF 的培训卡住。现在国外的合同研究组织(CRO)公司都愿意要有经验的 CRA,没有经验的新人很难入行,就是因为在专业化程度日益增高的前提下,新人上手很难,而有经验的 CRA 可能已经在既往的项目中完成了相应的培训,接到新项目以后,马上就可以开始工作了。另一方面,电子 CRF 是依赖于网络的。如果试验中心没有网络或者网络信号不好,CRA 就没法工作。有些公司发给 CRA 无线网卡,但实际上很多医院里面是没有手机信号的,无线网卡也不好用。有的电子CRF有离线功能,也就是离线状态下可以输入数据,于在线的状态下进行整合。但由于 CRF 表常有由疑问表等引起的更改,整合后产生的离线数据同在线数据不一致,解决起来也很麻烦。所以,大多数的电子 CRF表都是设计在线同步录入的方式。
1.2 中央化随机系统(IVRS/IWRS)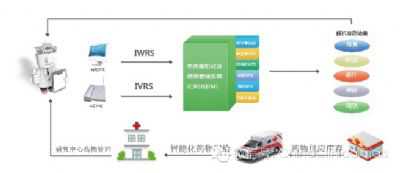
IVRS(Interactive Voice Response System)系统用于临床研究药品的管理上已经有很多年了。通过 IVRS 进行的中心化的随机,便于药品的集中管理,不但避免了传统盲法信封在操作上可能出现的差错,也方便了临床研究药品的调配,避免了临床研究药品的浪费。近来
推出的 IWRS 系统,是在 IVRS 原理的基础上,将药品的管理网络化。 IWRS 的原理同 IVRS 相似,一个是用打电话来获得随机号,另一个是通过登录相关的网站来获得随机号。但 IWRS 系统将药品从药库发到各基地的具体情况、各基地的接受情况、药品派发给每位受试者的情况、每位受试者用药及归还的情况、药品销毁或者退回的情况全部体现在网络之中。CRA在去基地之前,登录一下网站,药品的分配情况便一目了然。CRA 在基地只需要验证一下退回的药品和待销毁的药品,然后在网上电子化签名就可以了。患者对临床研究药品的依从性也可以从网上体现出来。
IVRS/IWRS 极大程度地提高了临床研究的效率,但也有一些问题。IVRS 最常见的问题是密码共享。一些试验中心不止一个人管理药品,但只有一个账号,所以往往不同的人共用这一个账号来登录 IVRS,但这是不允许的。一些 IVRS 的应答中心是在其他国家,这样就有一个语言问题和时区问题。一些国内的试验中心需要有具有一定英文基础的 CRA 来帮助他们进行应答。IWRS 的出现在一定程度上改进了这种状况。
{nextpage}
1.3 中心实验室(Central Lab)的使用
中心实验室(CentralLab)的使用,不但规范了血样的采集和运输程序,减少了各项临床检验指标的误差,而且可以将实验室检查结果直接同步到数据库中,不需要 CRA 再实地监查这些数据。电子病例报告表(EDC)中,患者每次新的访视,都可以自动提醒中心实验室对各基地派发收集血样的试管。当然,实验室检查的报告在同步到数据库的同时,也会给研究者提供一份打印出来的报告,供研究者查看。
中心实验室的优势使得现在在北美进行的绝大多数临床研究都采用中心实验室。一些国际性的 CRO 公司也纷纷建立了自己的中心实验室。当然,中心实验室会在一定程度上增加临床研究的成本。每个中心实验室不但要进行 CAP 认证,而且 CAP 认证还需要定期的更新。快递费和冷链费也是一笔不小的开支。现在已经有了专门快递血样的公司,服务更为专业,当然在费用上,与普通的快递公司相比,更高一些。这些增加的成本,最终还是转嫁到新药研发的总体成本上。
国内的一些研究者不喜欢用中心实验室。一些研究者认为,如果用当地的实验室,他们当天就可以拿到实验室检查报告,这样方便对患者的病情进行判断并及时采取措施。而中心实验室的结果往往较慢。虽然国外的中心实验室可以很快出报告并将报告传真至研究者,但最快也不可能当天就有结果,因为毕竟要花时间将样本运送到另外一个城市的中心实验室。如果中心实验室是在海外,那就更麻烦。而国内的一些中心实验室,检查费加快递费比付给研究者的费用还要高很多,这样就有点本末倒置了。研究者觉得自己的劳动价值没有得到体现,在情绪上也对中心实验室有所抵制。当然,现在一些国内的公司也成立了中心实验室,通过了 CAP 认证,这让中心实验室的价格大大降低,并在一定程度上促进这个行业的发展。
1.4 中心化的读片

现在应用比较多的有中心化读片,有中心化的 CT/MRI 阅片,中心化的眼科读片(如 OCT,FA/FP 等)。受试者的影像学资料通过网络传送到中心阅片单位,不但可以规范各影像师的操作,而且也减少了阅片方面的误差。一方面,影像师必须先经过培训,拍出的影像学资料符合标准才给予合格证明,这就保证了影像学资料的质量。另一方面,由经过认证的读片专家进行集中的阅片,避免了同一张片子由不同的专家读片引起的误差。现在很多研究都采用了中心阅片的方法,同时也有一些CRO 公司成立了中心化阅片的公司,专门负责组织专家进行中心化阅片工作。
{nextpage}
1.5 中心化的心电图(eRT)
eRT是目前较为常用的中心化心电图检查。eRT 给各参与临床研究的单位配置一个专门的心电图机,这个心电图机有上传功能,进行心电图检查以后,资料自动上传到一个数据中心。由这个数据中心集中给出心电图的报告。在实际应用中,有时候研究者在进行eRT 系统设置的时候遇到困难,不知道如何输入患者的信息。同时 eRT 提供的心电图机一般都是一次性的机器,有时候会出现导线过短的问题。
1.6 临床研究管理系统(CTMS)
虽然各大 CRO 公司使用 CTMS 都有一段时间,但随着网络化的不断发展,CTMS 也在不断更新。现在各大CRO 公司的 CTMS 都是网络化,也就是说 CRA 直接将相关的信息输到网络化的数据库中。CRA可以及时输入并更新各基地的状况,例如入选情况、患者访视情况、不良事件情况、方案违背情况、监查情况、甚至差旅花费和付费情况等等。这种网络化管理可以将临床研究各项数据从采集、归档到报告一步到位,精简了项目经理的工作,减少了项目管理的层次。特别是对于那种在几十个国家同时进行的、上千个基地同时参加的临床研究,这种优势更为明显。而传统的层层汇报的模式,会产生堆积如山的文件。
现在是否有成熟的CTMS 系统,已经成为申办方对一个专业CRO 公司的评价指标。因为 CTMS系统建立后,在给予申办方相关人员授权的情况下,申办方的人员也可以直接通过CTMS系统得到临床研究的相关数据,让项目管理更直接、更透明。随着临床研究的专业化发展,北美的各大药厂都逐渐将临床研究项目外包。公司内部虽然保留了一些 CRA,但这些 CRA 已经不再行使监查的职能,而主要行使项目管理的职能了。有的药厂干脆将CRA 的称呼改成了 CRM(ClinicalTrial Management),药厂的 CRM 可以直接通过 CTMS 系统了解项目的进展情况,从而行使相应的管理职能。近年来很多公司都在强调项目管理在临床研究中的作用,实际上临床研究中最关键的是现场工作,而非项目管理。CTMS 的应用也会带来一些问题,那就是增加了CRA 的工作量。首先所有的 CTMS 都需要一个复杂的培训过程,CRA 需要花费大量时间去通过这些培训和考试。同时由于系统的不断更新,每次更新都伴随新的培训。有的公司每隔几年就需要购买全新的系统,相应的培训量就更大了。CRA 面对海量的培训和迷宫般的系统,往往感到十分无助。由于所有的信息都需要 CRA 输入,实际上是将项目管理的功能下降到了 CRA 的层面,但 CRA 并不会因此而减低既往的工作量。所以,每个新系统推出的时候,都是 CRA 最忙的时候。而每个系统都需要一年左右的时间才能达到稳定,系统稳定之前,很可能会在 CRA 输入海量数据时死机。而系统稳定以后,过一年可能就要更新了。这些问题都是公司在推出 CTMS 时需要考虑的。
1.7 药物管理的专业化
以前国内的临床研究,药物都是由申办方来管理,直接从工厂车间寄出。外企的临床研究由于没有专门的仓库,所以管理比较混乱。现在已经有专门的药物管理公司来负责药物的贮存和派发,也就是专用的药库。十年前中国的昆泰公司在上海就建立了国内唯一的中心药库,现在美国的 Fisher 公司、Cardinal等也进入了中国市场。专业的药库保证了药物贮存的条件,同时按照IVRS/IWRS 系统的信息,对药品进行派发和回收,保证了药品的及时供应。
1.8 血样运输的专业化

随着中心实验室的广泛运用,如何将血样及时并保质的运送到也是一个非常关键的问题。现在有专门负责血样运输的公司来操作,让血样的运送更加安全可靠。
{nextpage}
1.9 专业化的不良事件警戒中心
(Pharmacovigilance,PV)不良事件的报告,特别是严重不良事件(SAE)的报告,现在也有专业的公司来负责。专业的公司负责不良事件的收集、整理、出疑问表、上报有关管理部门,让 SAE 的管理更为高效和规范。
1.10 严重不良事件报告的网络化
以前所有 SAE 的报告(IND Safety Report)都是打印出来,由药物警戒部门(PV)发送到各个研究单位,或者用电子邮件发送 PDF 版到 CRO 公司,再由CRA 打印出来寄到各临床研究单位。研究者在阅读相关的 SAE 报告后,在SAE 报告上简签,然后按照各伦理委员会的具体要求,向伦理委员会报告。现在很多公司都推出了网络化的 SAE 管理,即所有的 IND Safety Report 都放在网上。研究者用特定的用户名和密码登陆网站,便可在网上浏览。网站自动记下研究者的登陆过程,表示研究者已经阅读了相关的报告。这种做法不但节省了大量的纸张,而且可以让研究者在第一时间得到相关的药物安全信息。
但这种做法也产生了一些问题。研究者往往会忘记自己的密码。一些研究者甚至将自己的用户名和密码交给他的助理,这样助理就可以代替研究者登陆。更有甚者,CRA 代表研究者注册一个邮箱,自己登陆。这实际上就产生了很严重的作弊问题。对于研究者来讲,助理准备好资料并做好标记,他直接签名,似乎已经形成了习惯,并不觉得费力。但如果让研究者自己去记住密码,登陆网站,还要等着一个个文件慢慢打开,可能是一件十分难以接受的事情,何况获得用户名和密码之前还要经历一次为时不短的培训和考试。
1.11 临床研究文件管理的网络化
过去,CRA 在监查时往往要复印大量的文件,例如伦理的批件、严重不良事件的伦理报告、方案违背的伦理报告等等。现在公司建立了临床研究文件的电子管理系统。临床研究人员对这些文件进行扫描,然后直接上传到相关的网页,不但提高了效率,也减少了纸张的浪费。当然,对于一些要求收集原件的文件,还是需要采用传统的邮寄的方式。这种操作方式,让 CRA 从研究者文件夹中解放出来,使现场监查能专注于与方案和操作相关的医学步骤。
1.12 监查报告的网络化
监查报告的网络化为临床研究的项目管理提供了极大的方便。由于临床研究的全球化趋势,项目经理同 CRA 往往不在同一个城市。以前,CRA在完成监查报告签字以后,往往需要邮寄给项目经理,再由项目经理签字归档,费时也费钱。现在的监查报告都是在网上完成,CRA 完成报告后,电子签名即可。项目经理审批后,也是采用电子签名的方式。电子化的报告贮存在个项目的数据库中,便于查阅和归档。这种网络化的监查报告往往是CTMS 的一个模块。实际上,对于 CRA而言,监查报告的模块是 CTMS 中最重要的一个模块。
{nextpage}
1.13 培训系统的网络化
现在的培训都是在网上进行。在某些国际性的 CRO 公司,一个 CRA 从入职开始,平均每年要完成近 200 个培训。这些培训都是 CRA 平时挤时间来完成的。培训就像给树浇水,一次浇多少水不重要,重要的是每次培训能吸收多少。所以,培训是一个缓慢的长期的过程。网络化的培训最能满足这种培训要求。
此外,员工的报销系统(ExpenseReport)、 时间管理系统(Timesheet)等等也都网络化了。各种新工具的出现,让临床研究更加专业化。
【2. 临床研究的新部门】
随着临床研究专业化的不断发展,部门分工越来越细。以前药厂的医学部只有几个 CRA
加上注册专员,现在一些大公司的医学部都有上百人的编制。一个专业的 CRO 公司,不但有Clinical Operation 部门(也就是 CRA做临床研究监查的部门),还有 QA 部门、QC 部门、MedicalMonitor 部门、SSU 部门,远程监查部门等等。一些公司还拥有自己的数据管理部门、统计部门、中心实验室、中心读片部门、中心药物警戒部门等等。随着新部门的增加,CRO公司也增加了许多新的职位,每个职位对应不同的功能,以至于一个新手想将这些职位的缩写搞清楚,都是一件十分困难的事情。这也解释了为什么在北美,一方面CRA 很缺乏,另一方面新人想入行也非常困难。因为这个行业在高度的专业化发展的过程中,产生了许多属于行业本身的东西,新人入行,最困难的不是对 GCP 和临床研究方案的理解,而是被五花八门的缩写搞得一头雾水,这些东西是书本上没有的,必须在实际工作中才可以学到。
【3. 从业人员的教育背景】
专业化的不断发展,使得临床研究从业人员的医学背景变得越来越不重要(Medical Monitor 除外),从事临床研究的实际经验变得更加重要。临床研究专业已经变成了一个特殊的专业,这个专业既不同于临床工作,又不同于药学工作,是大学课程里面不存在的专业。国内最早一批的 CRA 几乎全部都是临床医生。虽然有临床背景的 CRA更能够理解研究者的工作,但 CRA 是不能干涉研究者的工作的。所以,医学背景已经变得不是那么重要,熟悉临床研究的各种程序才是最重要的。在美国我的一个 CRA 同事,他是学 IT 出身的,完全没有医学背景,现在做 CRA 也做得很好。他说他刚做这个行业的时候,觉得有些自卑,因为其他人都是有医学背景的,而他一点医学背景的都没有。现在他完全没有那种感觉了,似乎在 CRO 公司,有一点 IT 背景还更重要一些。甚至一些看上去专业化程度更高的部门,例如 QA/QC 部门,不但不需要医学背景,连实际监查的经验也不需要了。专业化的分工让人变成一个庞大机器里面的一颗螺丝钉,但必须是一颗非常合格的坚固的螺丝钉。