2020年第1季度,国家药监局共批准12个新药上市,包括6个进口药品和5个国产药品,5款创新药在中国获批新适应症,涵盖癌症、自身免疫性疾病等疾病领域。其中,国产药品中还包括1个疫苗和1个中药。引人注目的是,这17款创新药中,有八款创造了“中国首个”的记录,其中几款还填补了中国在一些疾病治疗领域的空白。
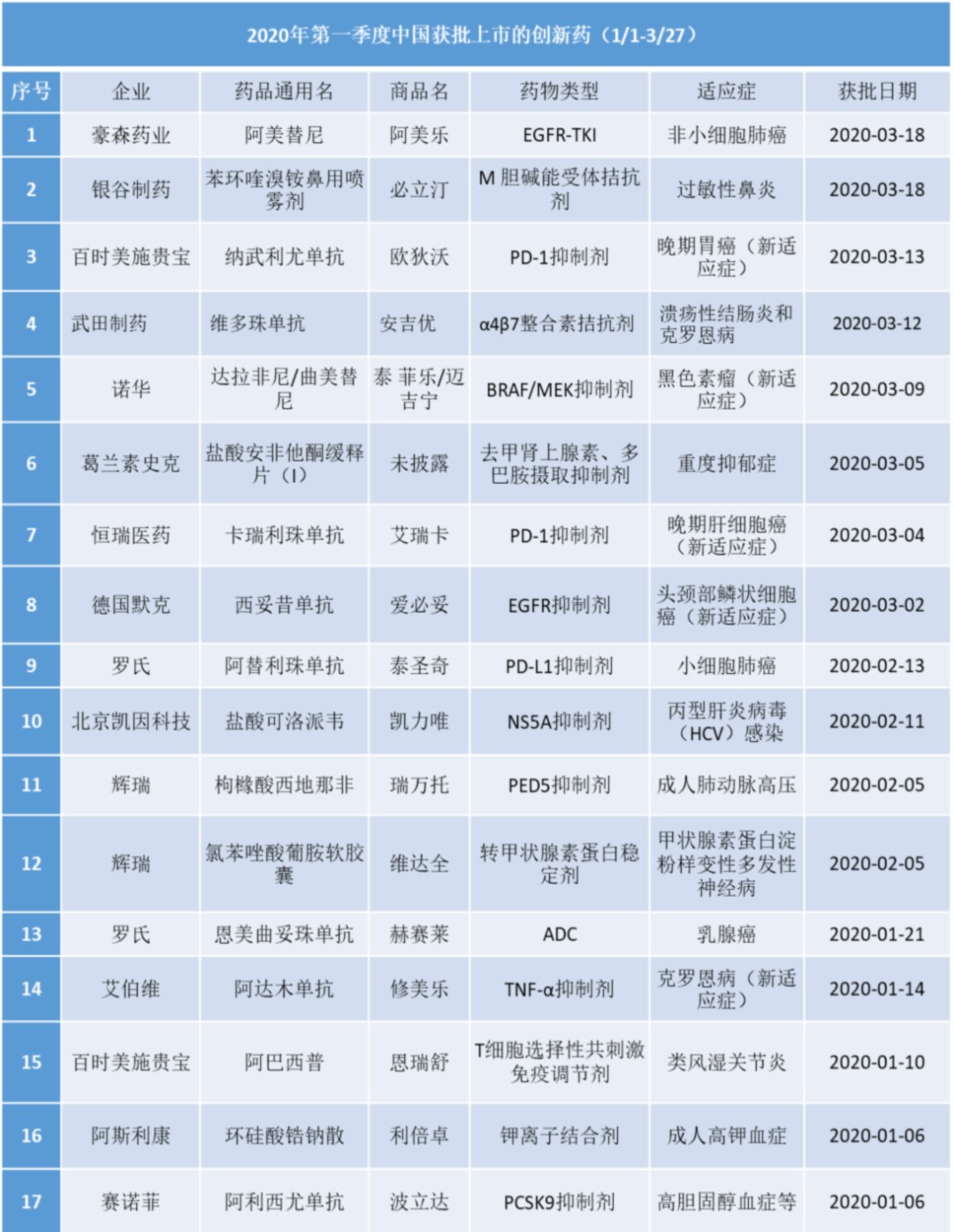
注:此处所列新药,主要是指NMPA首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类、5.1类;生物药主要是生物制品注册分类下的1类、2类。不包括生物类似物、新适应症、新剂型。
1、7款抗癌药获批,5个创造“中国首个”的记录
从获批的适应症来看,本季度获批的创新药中抗癌药最多,有7个,分别为:豪森药业的第三代EGFR-TKI阿美替尼、百时美施贵宝(BMS)的PD-1抑制剂纳武利尤单抗、诺华(Novartis)的双靶组合疗法达拉非尼/曲美替尼、恒瑞医药的PD-1抑制剂卡瑞利珠单抗、德国默克(Merck KGaA)的西妥昔单抗、罗氏(Roche)的抗PD-L1单抗阿替利珠单抗以及抗体偶联药物(ADC)恩美曲妥珠单抗。其中阿美替尼、阿替利珠单抗、恩美曲妥珠单抗是首次获批,其余四款抗癌药获批 这7款抗癌药中,有五款创造了“中国首个”的记录:豪森药业的阿美替尼是首个获批上市的中国国产第三代EGFR-TKI;百时美施贵宝的纳武利尤单抗是中国首个获批的胃癌免疫疗法;恒瑞医药的卡瑞利珠单抗是中国首个获批的肝癌PD-1免疫疗法;罗氏的阿替利珠单抗是中国首个获批的广泛期小细胞肺癌免疫疗法;罗氏的恩美曲妥珠单抗是中国首个获批上市的抗体偶联药物。
其它两款抗癌药获批的适应症,对中国患者的意义也很重大:德国默克的西妥昔单抗打破了中国复发和/或转移性头颈部鳞状细胞癌患者30年来铂类化疗效果不佳的困局,填补了头颈部鳞癌领域靶向治疗的空白;诺华的双靶组合疗法达拉非尼/曲美替尼新适应症的获批,则使更多的黑色素瘤患者有了治疗选择。 罗氏的恩美曲妥珠单抗于2020/1/21在中国获批,成为中国批准上市的首个抗体偶联药物。适用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,填补了我国HER2阳性乳腺癌患者在新辅助治疗后未达到病理完全缓解的治疗空白。该适应症在美国和欧盟获批的时间分别为2019年5月和2019年12月,实现了中国和欧美国家的同步批准。
首个国产三代EGFR-TKI药物
豪森的甲磺酸阿美替尼片于2020/3/18获得国家药监局附条件批准,用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者。这是全球第3个三代EGFR-TKI创新药,也是首个国产三代EGFR-TKI药物。 甲磺酸阿美替尼为表皮生长因子受体的激酶抑制剂。甲磺酸阿美替尼片是我国自主研发并拥有自主知识产权的创新药。本品的上市有助于改善经第一代EGFR-TKI治疗后疾病进展且T790M阳性非小细胞肺癌患者的药物可及性,为-----非小细胞肺癌患者提供新的用药选择。 2019年世界肺癌大会(WCLC)上,陆舜教授公布了阿美替尼二线治疗EGFR T790M突变阳性局部晚期或转移性NSCLC的Ⅱ期研究结果。试验纳入来自中国大陆36个地区(189名患者)和中国台湾(55名患者)的244例患者。总体患者的中位治疗时间为9.5个月。 中位随访时间为4.7个月,经独立评审委员会评估的结果显示,客观缓解率(ORR)为68.4%,疾病控制率(DCR)为93.4%。 安全性方面,3级及以上治疗相关不良事件(AE)发生率为20.9%,药物相关严重AE发生率为10.2%;2%的患者因AE而进行药物减量,药物相关死亡AE有4例。
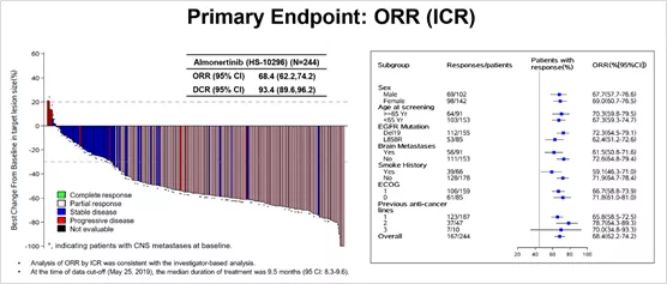 图2:2019年WCLC大会公布的阿美替尼II期试验ORR结果
图2:2019年WCLC大会公布的阿美替尼II期试验ORR结果
以此次阿美替尼亮相的数据与奥希替尼AURA17的Ⅱ期临床结果比较,在ORR和DCR方面,阿美替尼能与奥希替尼比肩,不过脑转移的控制能力逊于奥希替尼,3级以上AE发生率也高于奥希替尼。
2 自身免疫性疾病领域再填两员新将
自身免疫性疾病是指机体对自身抗原发生免疫反应而导致自身组织损害所引起的疾病,包括系统性红斑狼疮狼疮、银屑病、强直性脊柱炎、类风湿性关节炎、克罗恩病等等。
第一季度,自身免疫性疾病领域有两款新药首次获批,分别为武田制药(Takeda)的维多珠单抗和百时美施贵宝的阿巴西普。 维多珠单抗是一种人源化单抗药物,作为一种肠道选择性的生物制剂,可以特异性拮抗α4β7整合素,抑制其与肠粘膜细胞粘附分子1(MAdCAM-1)的结合,但不抑制其与血管细胞粘附分子1(VCAM-1)的结合。作为第一批临床急需境外新药名单,维多珠单抗本次在中国加速获批治疗符合特定条件的中重度活动性溃疡性结肠炎和克罗恩病的成年患者。 阿巴西普是由百时美施贵宝公司开发的一种T细胞选择性共刺激免疫调节剂,由人细胞毒性 T 淋巴细胞相关抗原 4(CTLA-4)细胞外结构域与免疫球蛋白IgG1的Fc区组成。它能与抗原呈递细胞表面的CD80和CD86结合,阻止后者与T细胞表面CD28的相互作用,从而抑制T细胞激活,减少其下游炎症反应,继而抑制关节损伤。
本次在中国,阿巴西普获批的适应症为类风湿关节炎。在中国大陆地区,阿巴西普的临床研究和商业化推广由先声药业与百时美施贵宝共同负责。 除了上述两个药品外,全球“药王”修美乐(阿达木单抗)在第一季度也收获了两个新适应症——中重度活动性克罗恩病成年患者,以及成年非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎患者。至此,修美乐已在中国获批六个适应症。
3 四款临床急需境外新药加速获批
临床急需境外新药主要是指近年来在欧美日已上市但在中国尚未上市的,用于治疗罕见病,严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药。对于这些药品,经申请人研究认为不存在人种差异的,可直接在中国提出上市申请,中国国家药监局(NMPA)将按照优先审评审批程序,加快审评审批。截至目前,国家药品监督管理局药品审评中心(CDE)已经发布了两批临床急需境外新药名单,共计74个药品。
第一季度,有四个临床急需境外新药在中国获批上市,除了上文提到的武田制药旗下的维多珠单抗,还包括阿斯利康(AstraZeneca)的环硅酸锆钠散,辉瑞(Pfizer)的枸橼酸西地那非片和氯苯唑酸葡胺软胶囊。 环硅酸锆钠散是阿斯利康开发的一种不溶于水、不被吸收的钾离子结合剂。环硅酸锆钠采用的创新离子捕获技术,对钾离子具有高选择性,因而具有更快的起效时间与更好的耐受性。该药在中国获批治疗成人高钾血症。根据阿斯利康新闻稿,高钾血症药物治疗领域经历了近60年的空白期 ,作为中国首个上市的创新型药物,环硅酸锆钠散的获批标志着高钾血症治疗在中国迎来新时代。 辉瑞的枸橼酸西地那非片和氯苯唑酸葡胺软胶囊在今年2月5日同日获批。枸橼酸西地那非片获批治疗成人肺动脉高压(PAH,WHO第1组),以改善运动能力和延缓临床恶化,是中国首个被批准用于治疗肺动脉高压的5型磷酸二酯酶(PDE-5)抑制剂。
值得一提的是,该药物从上市申请正式获CDE受理到获批上市,仅用了4.5个月。 氯苯唑酸葡胺软胶囊获批治疗的适应症为,转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)I期症状性成人患者。此前,中国没有治疗ATTR-PNI期症状性成人患者的有效药物,氯苯唑酸葡胺软胶囊的获批填补了这一领域的空白。
4 三个中国国产1.1类新药首次获批
有三个中国国产1.1类新药首次获批获批上市,除了前文提到的豪森药业的非小细胞肺癌治疗药物阿美替尼,还有北京凯因科技的丙型肝炎药物盐酸可洛派韦胶囊,和银谷制药的过敏性鼻炎药物苯环喹溴铵鼻喷雾剂。 盐酸可洛派韦胶囊是凯因科技开发的一种NS5A抑制剂,可通过抑制NS5A蛋白而阻断HCV病毒的复制和组装。该药被获批与索磷布韦联用治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染,可合并或不合并代偿性肝硬化。盐酸可洛派韦胶囊是第一季度唯一一款被中国国家药监局“官宣”获批上市的创新药。 苯环喹溴铵用于变应性鼻炎
国家药品监督管理局通过优先审评审批程序批准1类创新药苯环喹溴铵鼻喷雾剂(商品名:必立汀)上市,用于改善变应性鼻炎引起的流涕、鼻塞、鼻痒和喷嚏症状。银谷制药有限责任公司为本品的药品上市许可持有人。
苯环喹溴铵为选择性M胆碱能受体拮抗剂,可能通过抑制胆碱能神经介导的腺体分泌和炎症反应,缓解变异性鼻炎的症状。
苯环喹溴铵鼻喷雾剂是我国自主研发并拥有自主知识产权的创新药。该品种上市为变应性鼻炎患者提供新的用药选择,更好地满足了患者的临床需求
5 .近10年来首个糖尿病中药新药
五和博澳的桑枝总生物碱片于2020/3/18获得国家药监局批准上市,该药的主要成分为桑枝中提取得到的总生物碱。适应症为配合饮食控制及运动治疗2型糖尿病。该药III期临床证明疗效与阿卡波糖相似,是近10年来首个获批的糖尿病中药新药。 除上述药物外,NMPA还批准了长春百克的鼻喷冻干流感减毒活疫苗是国内首个获批的鼻喷流感疫苗。除了上述药物,本季度还有两款进口创新药在华首次获批上市:一款是来自葛兰素史克(GSK)的盐酸安非他酮缓释片(I),获批治疗重度抑郁症;另一款是来自赛诺菲的PCSK9抑制剂阿利西尤单抗,获批用于动脉粥样硬化性心血管疾病患者的心血管事件预防,以及原发性高胆固醇血症(杂合子型家族性和非家族性)和混合性血脂异常中降低低密度脂蛋白胆固醇(LDL-C)水平的治疗。其中,阿利西尤单抗是第二款在中国获批上市的PCSK9抑制剂类降脂药物。