自身免疫性疾病是免疫系统对自身机体产生免疫反应,自身抗体或自身效应淋巴细胞攻击正常细胞,导致自身组织受损的一类疾病,如系统性红斑狼疮、1型糖尿病、重症肌无力等,多数无法治愈,需要终生治疗。理想的治疗方式是保留保护性免疫的同时消除病理性自身反应细胞。
B淋巴细胞/浆细胞是自身免疫性疾病最重要的效应细胞之一,既往嵌合抗原受体(CAR)T细胞疗法(后简称“CAR-T细胞疗法”)通过特异性杀伤B淋巴细胞在急性B淋巴细胞白血病(B-ALL)、B细胞非霍奇金淋巴瘤(B-NHL)、多发性骨髓瘤(MM)等疾病的治疗中获得了显著的疗效,提示CAR-T细胞疗法在自身免疫性疾病治疗中的巨大潜力。近期,《新英格兰医学杂志》(NEJM)发表一项具有里程碑意义的临床研究成果,表明“首批”接受CAR-T细胞疗法的15例严重自身免疫性疾病患者,在为期15个月的中位随访期内,均持续维持缓解或症状大幅减轻,并已停止使用所有免疫抑制与抗炎药物,NEJM发表的同期社论称这是项“标志性的发现”。
CAR-T细胞疗法能治愈自身免疫性疾病吗?CAR-T细胞疗法对所有自身免疫性疾病均有效吗?CAR-T细胞疗法的短期和长期疗效,以及安全性情况如何?《医学新视点》结合NEJM、《柳叶刀》(The Lancet)等医学顶刊近期发表的相关文献,与您共同了解CAR-T细胞疗法在自身免疫系统疾病中的应用情况,以飨读者。
CAR细胞疗法治疗自身免疫性疾病的策略
自身免疫性系统疾病患者的免疫系统对自身抗原反应性增强,导致免疫耐受破坏,引起由T细胞和B细胞介导的自身免疫应答。T细胞可引起效应细胞毒性反应,B细胞可分化为浆细胞产生针对自身抗原的特异性抗体,效应细胞和抗体靶向表达自身组织,导致组织损伤。同时,自身蛋白经修饰也可诱导病理性自身抗体产生,诱发自身免疫性疾病,这种自身免疫循环一旦启动,就会造成自身免疫性疾病持续存在。常规治疗方式只是缓解了自身免疫循环,但并未从根源上打破这种循环。
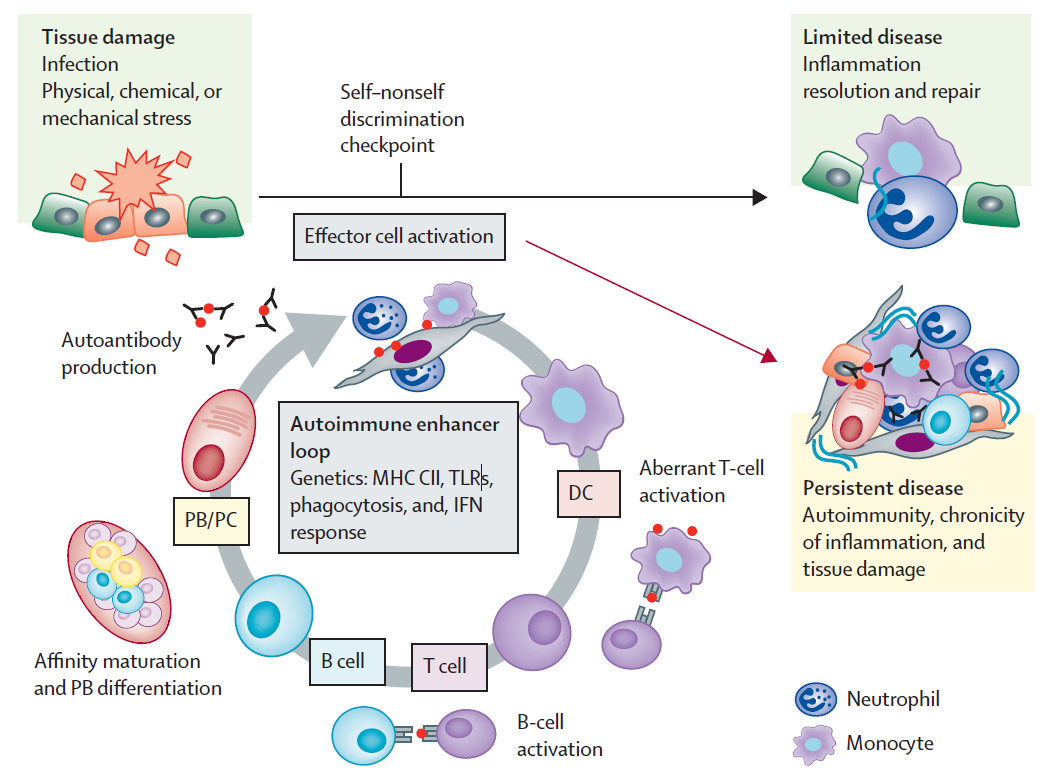
▲引发慢性炎症和组织损伤的自身免疫循环(截图来源:参考文献[1])
根据上述免疫循环,自身免疫性疾病的潜在致病因素可能是:1)自身抗体的存在;2)与疾病相关的自身反应性淋巴细胞;3)介导免疫耐受的Treg细胞减少或功能缺失。
CAR细胞用于自身免疫系统疾病的治疗策略主要有3种,即CAR-T、嵌合自身抗体受体T细胞(CAAR-T)和嵌合抗原受体调节性T细胞(CAR-Treg)。本文重点阐述CAR-T细胞疗法在自身免疫性疾病中的进展。
系统性红斑狼疮
系统性红斑狼疮患者B细胞对DNA和核抗原的病理反应先于临床症状,所以临床通常采用B细胞耗竭疗法,免疫抑制剂和激素类药物。
2021年,德国风湿免疫学家Georg Schett团队报道了首例重度系统性红斑狼疮患者接受靶向CD19的CAR-T细胞疗法数据,发现治疗后44天,患者疾病活动指数从16分下降到0分;
2022年他们再次报道了5例难治性系统性红斑狼疮患者的治疗效果,结果显示,所有患者病情均获得改善,狼疮性肾炎被"治愈";
2024年该团队病例系列研究结果登顶NEJM,结果显示8例系统性红斑狼疮患者在治疗6个月后均达到狼疮低疾病活动状态(LLDAS)标准,并达到系统性红斑狼疮缓解定义(DORIS)缓解,长达29个月的随访显示,所有患者均无疾病活动,整个观察期间,抗DNA抗体消失并保持阴性,补体因子C3水平恢复正常,蛋白尿消失。
根据公开资料显示,已有多款用于治疗系统性红斑狼疮的CAR细胞疗法取得重要进展:
瑞基奥伦赛注射液(靶向CD19的CAR-T细胞疗法)用于治疗中重度难治性系统性红斑狼疮的新药临床试验申请获中国国家药品监督管理局(NMPA)默示许可;
GC012F注射液(CD19/BCMA双靶点自体FasTCAR-T细胞疗法)在中国获批临床,拟开发治疗难治性系统性红斑狼疮;
RJMty19注射液(CD19-CAR-DNT细胞药)在中国获得临床试验默示许可,拟开发治疗难治性系统性红斑狼疮。
……
特发性炎性肌病(IIM)
特发性炎性肌病是一组获得性免疫性肌病,以皮肤、肌肉、结缔组织和其他不同组织器官受累的炎性病变,不同类型的特发性炎性肌都有自己的特殊表现。2024年,Georg Schett团队发表于NEJM的病例系列研究结果显示,3例特发性炎性肌病患者在治疗3个月后,均达到美国风湿病学会-欧洲风湿病防治联合会(ACR-EULAR)明显临床应答,肌酸激酶水平恢复正常,肌肉功能正常。
抗合成酶抗体综合征(ASS)是特发性炎性肌病的一种特殊类型,多表现为肌炎、发热、关节炎、技工手等。ASS可激发肺间质病变,病情进展迅速,死亡率高,整体治疗依然比较困难。
Georg Schett团队在The Lancet发表了世界“首例”使用CAR-T细胞疗法“治愈”ASS的案例。这位41岁的男性患者,接受CAR-T细胞疗法6个月后,患者被“治愈”,肌肉病变完全好转,呼吸道症状改善,不再需要高浓度吸氧,肺炎问题也消失了。更令人感到惊喜的是,即使停用了所有免疫抑制药,患者的症状依然在持续好转。
无独有偶,德国图宾根大学医院Claudia Lengerke团队也带来了好消息,发表于JAMA的一篇病例报道显示,1位抗合成酶抗体综合征伴有进行性肌炎和难治性间质性肺部的患者接受靶向CD19的CAR-T细胞治疗后,临床症状快速得到改善,肌肉和肺功能好转。
视神经脊髓炎谱系障碍(NMOSD)
视神经脊髓炎谱系障碍是免疫介导的中枢神经系统炎性脱髓鞘疾病,通常为急性或亚急性起病,进展迅速,80%~90%为复发病程,核心症状为视神经炎(单眼、双眼相继或同时视力减退)、急性脊髓炎等。B细胞及浆细胞会产生抗水通道蛋白4抗体(AQP4),损伤星形胶质细胞,进而诱导自身免疫相关的脱髓鞘改变。
CAR-T细胞疗法在清除B细胞肿瘤方面的能力,为治疗视神经脊髓炎带来了启示。2023年,华中科技大学同济医学院附属同济医院的王伟教授团队发现,使用BCMA特异性CAR-T细胞疗法治疗12例AQP4抗体相关的视神经脊髓炎谱系障碍患者,中位随访5.5个月后,11例患者疾病未复发。
据公开资料显示,伊基奥仑赛注射液(BCMA靶向CAR-T细胞疗法)拟用于治疗视神经脊髓炎谱系疾病适应证在中国获批临床。
重症肌无力(MG)
重症肌无力是由自身抗体介导的获得性-肌肉接头传递障碍的自身免疫性疾病,B细胞在重症肌无力病理过程中发挥着重要作用。发表于The Lancet Neurology的MG-001试验显示,16例成人重症肌无力患者接受Descartes-08(靶向BCMA的rCAR-T细胞疗法)治疗12周后,MG-ADL评分、重症肌无力定量评分、综合评估和生活质量评分均显著好转,在长达9个月的随访中,重症肌无力严重程度量表出现有临床意义的降低。基于该研究令人惊喜的结果,有学者在The Lancet Neurology发表了相关病例报道,一位33岁的抗AchR阳性全身性重症肌无力女性,在接受自体CD19的CAR-T细胞疗法治疗2个月后,肌肉力量和疲劳感均得到改善,手臂水平伸直时间增加,在无任何支具的情况下,行走能力也有所改善。
据公开资料显示,已有多款用于治疗重症肌无力的CAR-T细胞疗法取得重要进展:
伊基奥仑赛注射液(BCMA靶向CAR-T细胞疗法)新适应证在中国获批临床,拟用于治疗难治性全身型重症肌无力;
KYV-101(自体CD19靶向CAR-T细胞疗法)已获得美国FDA授予的快速通道资格,用于治疗重症肌无力和多发性硬化;
……
CAR-T细胞疗法的未来展望
CAR-T细胞疗法治疗自身免疫性疾病后,预期的无药物缓解时长仍有待进一步确认。部分系统性红斑狼疮患者无病进展观察期延长至2年多,从现有结果来看,这期间大部分患者处于B细胞完全重建状态。因此,部分自身免疫性疾病患者在接受CAR-T细胞疗法后有望获得痊愈。当然,这还需要有更长的随访时间来观察和佐证,因为需要明确新的B细胞产生和成熟的过程中,是否会伴随自身反应性B细胞克隆、自身抗体形式,并因此导致疾病复发。如果患者治疗后多年未复发,将有力推动CAR-T细胞疗法作为一种早期干预策略在自身免疫系统疾病中的临床应用。
NEJM发表的与CAR-T细胞疗法治疗自身免疫性疾病的相关社论也指出,CAR-T细胞疗法治疗自身免疫病的未来将受到疗效、安全性、可接受性等因素的影响,如果长期随访能够证实现有结果,那么对某些难治性疾病患者而言是有益的,如果CAR-T细胞疗法真的具有“耐受性”,那么就有理由将其用于早期和并不那么难治的疾病中。
参考资料
[1]Schett G, Mackensen A, Mougiakakos D. CAR T-cell therapy in autoimmune diseases. Lancet. 2023 Nov 25;402(10416):2034-2044. doi: 10.1016/S0140-6736(23)01126-1. Epub 2023 Sep 22. PMID: 37748491.
[2]Müller F, Taubmann J, Bucci L, et al. CD19 CAR T-Cell Therapy in Autoimmune Disease - A Case Series with Follow-up. N Engl J Med. 2024 Feb 22;390(8):687-700. doi: 10.1056/NEJMoa2308917. PMID: 38381673.
[3]罗秀娜,任军,贾凌云,等.自身免疫性疾病自身抗原的研究进展[J].中国免疫学杂志, 2023, 39(1):172-177.
[4]abian Müller,Sebastian Boeltz,Johannes Knitza,et al. CD19-targeted CAR T cells in refractory antisynthetase syndrome. Published:February 15, 2023DOI:https://doi.org/10.1016/S0140-6736(23)00023-5
[5]Pecher AC, Hensen L, Klein R, et al. CD19-Targeting CAR T Cells for Myositis and Interstitial Lung Disease Associated With Antisynthetase Syndrome. JAMA. 2023 Jun 27;329(24):2154-2162. doi: 10.1001/jama.2023.8753. PMID: 37367976; PMCID: PMC10300719.
[6]蒲传强. 特发性炎性肌病 [J] . 中华神经科杂志, 2019, 52(5) : 410-422. DOI: 10.3760/cma.j.issn.1006-7876.2019.05.009.
[7]王维治, 王化冰. 视神经脊髓炎谱系疾病 [J] . 中华神经科杂志, 2022, 55(5) : 511-519. DOI: 10.3760/cma.j.cn113694-20220127-00062.
[8]Qin C, Tian DS, Zhou LQ, et al. Anti-BCMA CAR T-cell therapy CT103A in relapsed or refractory AQP4-IgG seropositive neuromyelitis optica spectrum disorders: phase 1 trial interim results. Signal Transduct Target Ther. 2023 Jan 4;8(1):5. doi: 10.1038/s41392-022-01278-3. PMID: 36596762; PMCID: PMC9810610.
[9]Granit V, Benatar M, Kurtoglu M, et al. Safety and clinical activity of autologous RNA chimeric antigen receptor T-cell therapy in myasthenia gravis (MG-001): a prospective, multicentre, open-label, non-randomised phase 1b/2a study. Lancet Neurol. 2023 Jul;22(7):578-590. doi: 10.1016/S1474-4422(23)00194-1. Erratum in: Lancet Neurol. 2023 Sep;22(9):e10. Erratum in: Lancet Neurol. 2023 Sep;22(9):e10. PMID: 37353278; PMCID: PMC10416207.
[10]Haghikia A, Hegelmaier T, Wolleschak D, et al. Anti-CD19 CAR T cells for refractory myasthenia gravis. Lancet Neurol. 2023 Dec;22(12):1104-1105. doi: 10.1016/S1474-4422(23)00375-7. PMID: 37977704.
[11] Isaacs JD. CAR T Cells - A New Horizon for Autoimmunity? N Engl J Med. 2024 Feb 22;390(8):758-759. doi: 10.1056/NEJMe2400203. PMID: 38381679.
Cancer Cell:提高 CAR-T 疗效的新思路:调节肌酐代谢通路
![]() 0
2024-02-22
点击查看
0
2024-02-22
点击查看
【CII】赵明峰教授团队基于T细胞亚群开发预测CAR-T治疗r/r NHL反应的模型
![]() 0
2024-02-15
点击查看
0
2024-02-15
点击查看

【BJH】双靶点CAR-T的四种策略及其优缺点
![]() 0
2024-02-22
点击查看
0
2024-02-22
点击查看
【Blood Adv】CAR-T治疗套细胞淋巴瘤的神经毒性的临床特征
![]() 0
2024-03-01
点击查看
0
2024-03-01
点击查看

TCT:CAR-T治疗老年NHL和MM的临床结局和毒性
![]() 0
2024-03-05
点击查看
0
2024-03-05
点击查看
BMT:欧洲2022年移植和细胞治疗的规模:CAR-T稳步增长,移植增长放缓
![]() 0
2024-03-07
点击查看
0
2024-03-07
点击查看
