中华医学会外科学分会血管外科学组
一、概述
(一)指南制定的方法
本指南是由中华医学会外科学分会血管外科学组组织,在2011年卫生部颁布的下肢动脉硬化闭塞症诊断标准(WS 339-2011 )及2009年学组编写的外周动脉疾病诊治标准(征求稿)基础上,参考2011年欧洲心脏病学会(ESC)和2011年美国心脏病学会基金会/美国心脏协会(ACCF/AHA)发布的相关指南,结合中国下肢动脉硬化闭塞症的临床诊治特点修改而制定。
(二)定义
1.下肢动脉硬化闭塞症(ASO):指由于动脉硬化造成的下肢供血动脉内膜增厚、管腔狭窄或闭塞,病变肢体血液供应不足,引起下肢间歇性行、皮温降低、疼痛、乃至发生溃疡或坏死等临床表现的慢性进展性疾病,常为全身性动脉硬化血管病变在下肢动脉的表现。
2.间歇性跛行:下肢ASO的主要临床表现之一。是一种由运动诱发的症状,指下肢运动后产生的疲乏、疼痛或痉挛,常发生在小腿后方,导致行走受限,短时间休息后(常少于10min)疼痛和不适感可以缓解,再次运动后又出现。跛行距离可以提示缺血的程度。
3.缺血性静息痛:患肢在静息状态下出现的持续性疼痛,是下肢ASO引起肢体严重缺血的主要临床表现之一,预示肢体存在近期缺血坏死风险。已有组织坏疽者往往伴有严重的静息痛。
4.严重肢体缺血(CLI):指患ASO的肢体处于严重缺血阶段。典型的临床表现包括静息痛(持续2周以上)、溃疡、坏疽,踝收缩压<50mmHg(1mmHg=0.133kPa)或趾收缩压<30mmHg等。
5.糖尿病足:发生在糖尿病患者的,与下肢远端神经异常和不同程度的周围血管病变相关的足部感染、溃疡和(或)深层组织破坏。
6.糖尿病下肢缺血:指糖尿病患者同时合并下肢动脉硬化闭塞,无论二者发生的先后,只要同时存在即可称为糖尿病性下肢缺血。临床表现与单纯动脉硬化性下肢缺血相似,但由于血管钙化严重及侧支血管形成较差,症状与体征可能更严重。糖尿病患者的动脉硬化主要包括动脉粥样硬化和动脉中层硬化:前者引起动脉狭窄和闭塞:后者使血管形成坚硬的管道。微血管病变不是皮肤损伤的主要原因。
7.踝肱指数(ABI):指踝部动脉收缩压与上臂(肱动脉)收缩压的比值,通过肢体的节段性压力测量获得,为无损伤动脉供血状态评估方法。该比值有助于对缺血程度的判断。
8.趾肱指数(TBI):指足趾动脉收缩压与肱动脉收缩压的比值,与ABI—样,是评估下肢缺血程度的常用指标。长期糖尿病患者、老年患者和长期透析患者由于血管中膜钙化,利用ABI常不能有效评估血管病变程度,可通过测量TBI评估血管供血状态,因为这些患者趾端动脉通常钙化不严重。
(三)发病相关危险因素
下肢ASO的主要病因是动脉粥样硬化。发病率随年龄增长而上升,70岁以上人群的发病率在15%〜20%。男性发病率略高于女性。
1.吸烟:吸烟和下肢ASO的发生明显相关。吸烟可以减少运动试验时的间歇性跛行距离,增加外周动脉缺血、心肌梗死、卒中和死亡的危险,增加CLI和截肢的危险。疾病的严重程度和吸烟量呈正相关。
2.糖尿病:糖尿病使本病发生率增加2〜4倍,女性糖尿病患者发生本病的风险是男性患者的2〜3倍。糖尿病患者的糖化血红蛋白每增加1%,相应ASO风险增加26%。糖尿病患者发生严重下肢动脉缺血的危险高于非糖尿病患者,截肢率较之高7〜15倍。
3.高血压:高血压是下肢ASO的主要危险因子之一,收缩期血压相关性更高,危险性相对弱于吸烟和糖尿病。
4.高脂血症:高脂血症使下肢ASO的患病率增高,出现间歇性跛行的危险增加。
5.高同型半胱氨酸血症:相对于普通人群,ASO患者中高同型半胱氨酸的合并概率明显增高。同型半胱氨酸是动脉粥样硬化的独立危险因素,约30%的ASO患者存在高同型半胱氨酸血症。
6.慢性肾功能不全:有研究表明慢性肾功能不全与AS0相关,对于绝经后女性,慢性肾功能不全是AS0的独立危险预测因素。
7.炎性指标:动脉粥样硬化是涉及多种炎性细胞和因子的慢性炎性反应。与同龄无症状人群相比,炎性指标(如C反应蛋白)增高的人群5年后发展为下肢动脉硬化闭塞症的概率明显增高。
二、诊断
下肢AS0的诊断必须通过病史询问、体格检查和相关特殊检查的结合确立。
(一)临床表现
本病好发于中老年人。大部分早期下肢ASO病例没有间歇性跛行等典型的肢体缺血症状,有时仅表现为下肢轻度麻木不适,但是在这部分患者可以检测到动脉功能的异常(如运动后ABI降低),且心血管缺血性事件的风险增加。下肢ASO的主要症状有间歇性跛行、静息痛等。下肢ASO的体征主要有肢端皮温下降、皮肤菲薄、毛发脱落等营养障碍性改变,下肢动脉搏动减弱或消失,动脉收缩压下降,肢体溃疡、坏疽等。
1.间歇性跛行:
下肢动脉供血不足往往会导致下肢肌群缺血性疼痛,症状在运动过程中尤为明显,即出现间歇性跛行,通常表现为小腿疼痛。当血管病变位于近心端时(如主髂动脉闭塞、髂内或股深动脉病变),间跛也可发生于大腿或臀部,即臀肌跛行。症状的严重程度从轻度到重度不等,可严重影响患者的生活质量,部分患者因其他病变导致日常活动受限时症状可不典型。
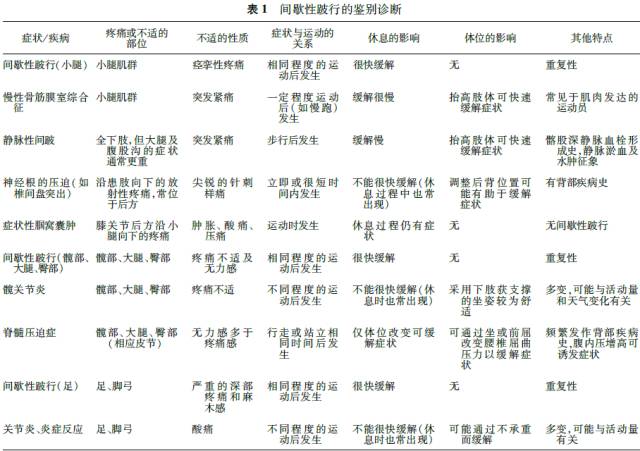
除下肢动脉硬化闭塞症外,主动脉缩窄、动脉纤维肌发育不良、腘动脉瘤、腘动脉窘迫综合征、多发性大动脉炎、血栓闭塞性脉管炎等多种非动脉粥样硬化性血管病变,均可引起下肢间歇性跛行。此外多种神经源性疾病、肌肉关节性疾病和静脉疾病也可能产生小腿疼痛症状,因此间歇性跛行的病因需要鉴别诊断(表1)。
2.严重下肢缺血:
下肢出现缺血性静息痛、溃疡、坏疽等症状和体征,病程超过2周,严重程度取决于下肢缺血程度、起病时间以及有无诱发加重的因素。
静息痛为在间歇性跛行基础上出现的休息时仍然持续存在的肢体缺血性疼痛。疼痛部位多位于肢端,通常发生于前足或足趾。静息痛在夜间或平卧时明显,患者需将患足置于特定位置以改善症状,如屈膝位或者将患足垂于床边。
静息痛应与周围神经病变产生的疼痛相鉴别,后者常见于糖尿病和椎管狭窄患者。存在糖尿病周围神经病变的患者,振动觉和位置觉受损,反射减弱。椎管狭窄压迫神经根所引起的疼痛,在直立或后伸等体位变化时会进一步加重。
患肢缺血持续加重可出现肢端溃疡,严重者发生肢体坏疽,合并感染可加速坏疽。缺血性溃疡多见于足趾或足外侧,任一足趾都可能受累,常较为疼痛。少数病例的溃疡可发生在足背。缺血性足部受到损伤,如不合脚的鞋子导致的摩擦或热水袋导致的烫伤,也可使溃疡发生在不典型的部位。
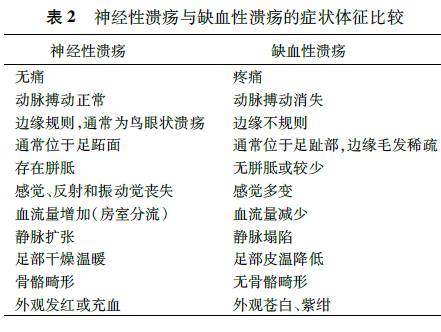
除动脉供血不足外,足部溃疡还可能由其他多种病因引起。常见的有静脉性溃疡,多发生于下肢内踝上方(足靴区)。这种静脉血流淤滞所引起的溃疡,典型表现是溃疡周围湿疹和皮肤色素沉着。周围神经病变也可导致下肢溃疡的形成。由于代谢性疾病(如糖尿病)、肾功能衰竭、创伤或手术等因素导致外周神经受损,患肢保护性感觉丧失,局部压力负荷过大,在反复受到机械压力的部位可发生溃疡。神经性溃疡通常位于身体承重部位,有鸟眼状外观和较厚的胼胝。溃疡周围皮肤感觉丧失,无痛感,触诊足部温暖,肢体远端动脉搏动存在(表2)。
3.急性下肢缺血:
下肢ASO的起病过程一般较缓慢,但当其合并急性血栓形成或动脉栓塞时,由于肢体动脉灌注突然迅速减少,可出现急性下肢缺血。急性下肢缺血即可发生在已有ASO临床表现的患者,也可发生在既往无典型症状的患者。
急性肢体缺血的典型表现为“5P”症状,即疼痛(Pain)、苍白(Pallor)、无脉(Pulselessness)、麻癖(Paralysis)和感觉异常(Paresthesia),也有将冰冷(poikilothermia)作为第6个“P”。症状的严重程度常常取决于血管闭塞的位置和侧支代偿情况。
疼痛是患者急诊就医的最常见症状。患者通常会主诉足部及小腿疼痛感。体检脉搏消失并可能出现患肢感觉减退。轻触觉、两点间辨别觉、振动觉和本体感觉的受累常早于深部痛觉。与足外侧相比,足内侧肌群在发病早期受下肢缺血的影响相对较小,如出现持续静息痛、感觉丧失和内侧足趾活动障碍则提示患肢存在极为严重的缺血。在患肢缺血程度评估过程中,与对侧肢体进行比较非常重要(表3)。

(二)实验室检查
在首次诊断下肢ASO时,应常规进行适当的实验室检查,以发现是否存在可以治疗的高危因素(糖尿病、高脂血症等)和相关动脉硬化所致的器官损害(肾功能)。
1.血细胞计数:血红蛋白增多症、红细胞增多症、血小板增多症。
2.血糖:空腹和(或)餐后血糖,糖化血红蛋白。
3.尿液常规:了解有无血尿、蛋白尿等。
4.肾功能:了解肾功能情况对判断患者是否耐受血管外科手术十分重要,有利于评估术后肾衰的可能性及采取相应对策。除常规检查外,需进行肌酐清除率、尿浓缩试验及肾图等。肌酐清除率代表肾小球滤过率,当低于50ml/min,血清肌酐开始上升。血清肌酐>265mol/L,尿素氮>8.9mmol/L说明存在肾功能障碍。肾图检查可以通过描记示踪剂的时间-放射性升降曲线对单/双肾功能进行评估。注意不应为检查而延误急诊手术时机。
5.血清脂质:血清脂质成分主要是低密度脂蛋白(LDL)、高密度脂蛋白(HDL)及甘油三酯。空腹胆固醇水平>7mmol/L人群中间歇性跛行的发病率成倍增加,总血脂浓度与HDL的比值是反映下肢动脉硬化发生的最佳预测指标之一。LDL增高是独立危险因素,与动脉粥样硬化发病率呈正相关,而HDL呈负相关。
如患者发病年龄轻、缺乏动脉硬化高危因素、多次发生血栓性事件、有明显家族史和阻塞部位异常、常规治疗效果不佳等情况出现时,则需要进一步的实验室检查。排除非动脉硬化的可能性,如炎症,高凝状态或代谢缺陷(心磷脂抗体综合征、胆固醇栓塞、高半胱氨酸血症等)。
(二)辅助检查
1.ABI测定:
ABI测定是最基本的无损伤血管检查方法,易操作、可重复,可以初步评估动脉阻塞和肢体缺血程度。ABI计算方法是踝部动脉(胫后动脉或足背动脉)收缩压与上臂收缩压(取左右手臂数值高的一侧)的比值。正常值为1.00〜1.40,0.91〜0.99为临界值。ABI≤0.90可诊断为下肢缺血。CLI时ABI常<0.40。
当高度怀疑下肢缺血,但静息ABI正常时,测量运动后ABI(平板运动试验)对确定诊断有帮助。方法是先测定患者静息状态下的ABI,然后患者以3.5km/h的速度在坡度为12%的平板检查仪上行走,出现间歇性跛行症状时测量运动后的ABI,ABI明显降低提示下肢缺血。ABI测定可以用于初筛肢体缺血的患者、评估肢体缺血的程度、对腔内治疗及开放手术治疗适应证的选择提供客观依据、作为术后或药物治疗后疗效的评价以及术后随访的重要手段。动脉壁钙化或弹性降低会导致假性高压的发生,从而影响ABI的准确性,常见于长期糖尿病、终末期肾病和高龄患者,此时可检测趾肱指数(TBI),作为诊断依据。TBI<0.70即可诊断下肢缺血。
2.超声检查:
通过二维超声图像可以测量内中膜厚度、斑块大小、明确斑块性质,结合彩色多普勒成像及频谱多普勒可以诊断动脉狭窄或闭塞的部位和程度,并提供收缩期峰值流速、病变部位与病变近心端的峰值流速比值、搏动指数等血流动力学参数。超声检查属无创性检查,检出率高、实时动态、方便快捷、可重复,门诊即可完成。
近年来,由于设备性能不断提高,图像清晰度也随之改善,从而使诊断准确性达到很高的水平。超声检查目前在临床上作为筛查首选的检查方法,可准确诊断病变部位及程度、评价流入及流出道、术中及术后评估腔内治疗及开放手术的疗效、移植物通畅与否以及作长期随访。但超声检查的准确性依赖仪器及操作者的水平,因此尚有一定的局限性。
3.计算机断层动脉造影(CTA):
CTA是术前常用的无创性诊断方式,随着机器性能提高和软件的更新,在一定程度上可以替代DSA。CTA图像由于动脉壁的锦化影响动脉的有效显影,对远端小动脉的显影有时不理想。通过阅读横断面原始图像,可以提高诊断准确性。
4.核磁共振动脉造影(MRA):
MRA也是术前常用的无创性诊断方法,可显示ASO的解剖部位和狭窄程度。但MRA图像有时会夸大动脉狭窄程度,体内有铁磁性金属植入物时不适合行MRA。缺点是扫描时间长、老年或幼儿患者耐受性差。
5.数字减影血管造影(DSA):
DSA可以准确显示病变部位、性质、范围和程度,目前仍然是诊断ASO的金标准。但作为一种有创检查,有一定的并发症发生率。随着CTA和MRA成像技术的提高,DSA较少单独用于诊断。通常可以通过无损伤检查提供初步诊断资料,必要时再行DSA。尤其是在CTA和MRA成像不佳、不能明确诊断时,DSA仍是最为重要的检查手段。如果患者行腔内治疗的可能性大,则首选无损伤诊断,血管造影明确病变部位及性质后,同期进行腔内治疗。
(四)诊断标准
下肢ASO的主要诊断标准:
(1)年龄>40岁;
(2)有吸烟、糖尿病、高血压、高脂血症等高危因素;
(3)有下肢动脉硬化闭塞症的临床表现;
(4)缺血肢体远端动脉搏动减弱或消失;
(5)ABI≤0.9;
(6)彩色多普勒超声、CTA、MRA和DSA等影像学检查显示相应动脉的狭窄或闭塞等病变。符合上述诊断标准前4条可以做出下肢ASO的临床诊断。ABI和彩色超声可以判断下肢的缺血程度。确诊和拟定外科手术或腔内治疗方案时,可根据需要进一步行MRA、CTA、DSA等检查。
(五)分期和分级标准
1.分期:下肢ASO的严重程度可根据Fontaine分期和Rutherford分类法(表4)。

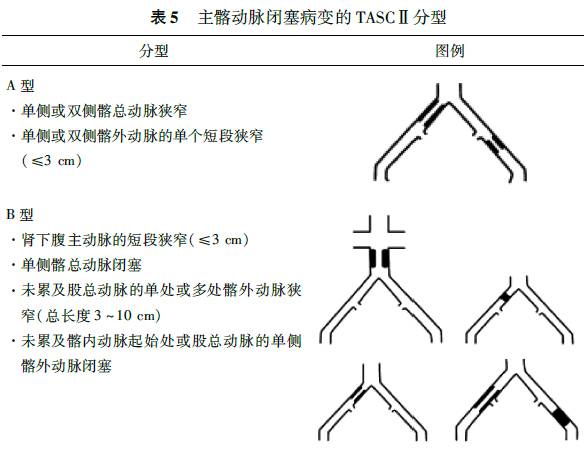
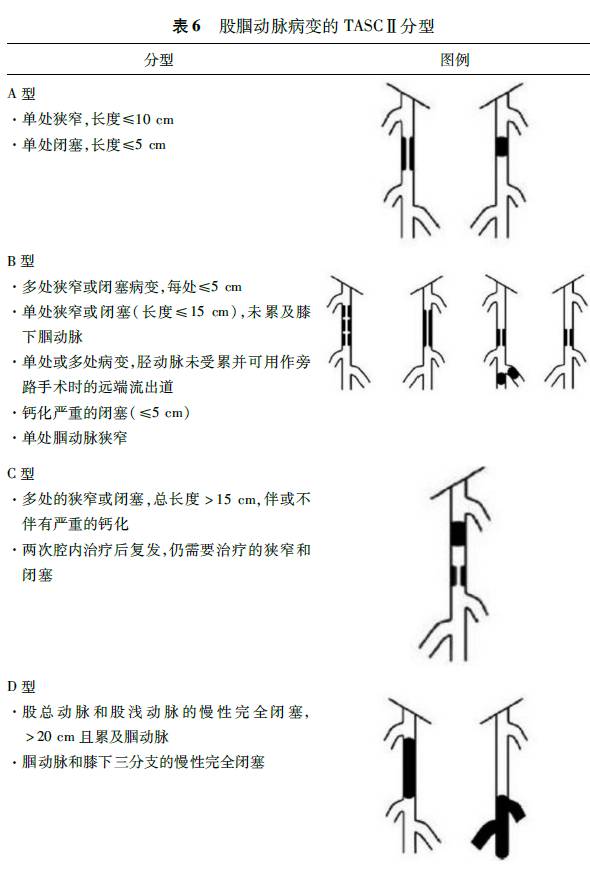
2.分级:根据影像学检查所见动脉狭窄或闭塞程度,可按2007年第2版泛大西洋协作组(TASC)分型标准对主髂动脉病变和股腘动脉病变进行分型(表5,6),对临床治疗及预后具有指导意义。
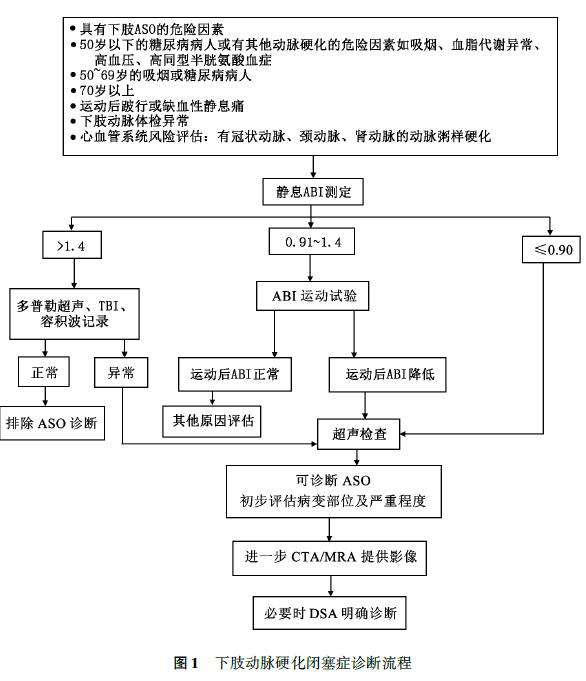
(六)诊断流程
下肢AS0的诊断需要针对每位患者的具体情况进行综合分析,首先是危险因素的评估,如高龄、吸烟、高血脂、糖尿病以及其他部位是否存在动脉粥样硬化(如冠状动脉、颈动脉和肾动脉等)。然后通过病史询问和体格检查,初步确立下肢动脉硬化闭塞症的临床诊断。综合临床症状和体征,有助于判断肢体缺血的严重程度。
通过节段性动脉压测定和ABI计算,可推断下肢动脉硬化闭塞的病变部位,推荐用于存在1项或1项以上ASO高危因素的可疑患者。将ABKO.9作为诊断阈值时,此项检查对血管直径狭窄率超过50%的病变有很高的诊断敏感性和特异性,但要警惕假性高压造成的漏诊(假性高压通常是指动脉硬化较为严重、血管钙化明显,测量血压时袖带不能将动脉压闭所导致测得的动脉压异常增高,最常见于糖尿病患者)。
此外双侧锁骨下动脉或双上肢动脉狭窄/闭塞导致的上肢血压降低,如头臂干型大动脉炎患者,也可以导致ABI异常增高。因此,对于ABI>1.4的患者,需结合多普勒超声容积波记录和波形进行分析,少数特殊病例需要测定趾动脉压力和经皮氧分压以助诊断。
ABI运动试验适用于下肢动脉搏动可及,踝肱指数基本正常(0.91〜1.40),但与间歇性跛行等临床症状严重程度不相称的患者。如果ABI运动试验结果正常,可排除严重下肢ASO。如果运动后ABI显著下降,则可诊断下肢ASO。根据节段性压力和ABI测定的结果,可决定患者是否需要进一步的检查措施。
结合彩色多普勒血流显像和动脉收缩期峰值流速、峰值流速比值测定,可准确评估下肢动脉硬化病变位置、狭窄程度及对血流动力学的影响,适用于下肢动脉硬化患者术前评估和术后随访。
CTA检查是术前制定血管重建方案的最重要检查。但是CTA需要使用较多的肾毒性造影剂,并且在血管严重钙化时评估动脉狭窄程度存在闲难,既往下肢金属植入物产生的伪影也影响CTA的成像质量。
MRA检查可避免CTA使用的碘离子造影剂对肾功能异常患者残余肾功能的进一步损害,但是成像时间较长且存在夸大效应。患者体内有心脏起搏器等金属植入物,或者存在幽闭恐惧症等为MRA检查禁忌。肾功能不全患者慎用含钆磁共振造影剂,因检查后有出现肾源性系统性纤维化的风险。
DSA可以定位和测量病变,测定病变近远端的压力梯度,以利于制定治疗方案。有创性DSA很大程度上已被CTA、MRA所代替,但仍然是排除检查的金标准。接受传统外科手术或血管腔内治疗的患者应行DSA检查(图1)。
三、治疗
(一)针对心血管危险因素的治疗
1.降脂药物治疗肩议下肢ASO患者使用他汀类药物降脂治疗。他汀类药物主要适用于血中总胆同醇及低密度脂蛋白胆同醇(LDL-C)增高为主的患者。以多项随机对照试验研究结果为依据,明确他汀类药物治疗可获益的患者包括:(1)确诊动脉粥样硬化性心血管疾病(ASCVD)者;(2)原发性LDL-C升高(>4.9)者;(3)40〜75岁、LDL-C为1.8〜4.9mmol/L的糖尿病患者;(4)无ASCVD与糖尿病,但10年ASCVD风险>7.5%者。应控制低密度脂蛋白(LDL)水平<2.6mmol/L,对于具有缺血高风险的下肢ASO患者,建议控制LDL水平<1.8mmol/L。纤维酸衍生物类降脂药可用于合并低高密度脂蛋白(HDL)、正常LDL及高甘油三酯血症的下肢ASO患者。
2.抗高血压药物治疗:治疗原则:小剂量开始,优先选择长效制剂,联合应用及个体化。常用降压药物包括钙通道阻滞剂、血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体阻滞剂(ARB)、利尿剂和受体阻滞剂五类,以及由上述药物组成的同定配比复方制剂。此外,a-受体阻滞剂或其他种类降压药有时亦可应用于某些高血压人群。对于仅合并高血压的下肢ASO患者建议控制血压<140/90mmHg。对于有高血压同时合并糖尿病或慢性肾病的下肢ASO患者建议控制血压<130/80mmHg。ACEI类药物适用于有症状的下肢ASO患者。p受体阻滞剂是有效降压药物,不会对跛行产生负面作用。
3.糖尿病治疗:糖尿病是动脉硬化发生发展的重要危险因素,对于合并糖尿病的下肢ASO患者,必须加强饮食管理。控制血糖目标值:空腹80〜120mg/dl(4.44〜6.70mmol/L),餐后120〜160mg/dl(6.7〜8.9mmol/L),糖化血红蛋白(HbAlc)<7.0%。建议患者主动学习并掌握足部日常护理方法,养成足部自我检查习惯,选择合适的鞋袜,正确护理并治疗足部的擦伤、裂伤、溃疡等。
4.戒烟:吸烟是动脉硬化的主要危险因素之一,可引起血管痉挛、血管内膜损害、脂类代谢异常等,加重或促进动脉硬化发生发展。戒烟是预防和治疗下肢ASO的重要措施之一。对于吸烟者应严格要求并督促其戒烟,如戒烟闲难可在替代治疗辅助下完成。
5.抗血小板和抗凝治疗:抗血小板药物共同的作用是抑制血小板活化、黏附、聚集和释放功能,从而产生预防血栓形成、保护血管内皮细胞、扩张血管和改善血液循环的作用。抗血小板治疗可以降低ASO患者心梗、脑卒中及血管源性死亡的风险。
推荐使用的抗血小板药物包括阿司匹林、氯吡格雷等。低剂量阿司匹林(75〜150mg/d)可以获得与高剂量相同的疗效。阿司匹林联合氯吡格雷可降低有症状的下肢ASO患者(无出血风险和存在心血管高危因素)心血管事件的发生率,应警惕出血风险。使用传统抗凝药(如华法林)并不能减少心血管事件的发生,而且可能增加大出血风险。
(二)间歇性跛行的治疗(图2)

1.运动和康复治疗:规律的有氧运动可改善最大平板步行距离、生活质量和生活能力。特别是下肢动脉硬化闭塞症的老年患者,运动治疗可增加无痛步行距离和最大步行距离,同时降低血浆胆固醇浓度,降低收缩压。运动治疗必须在专业指导下进行,每次步行30〜45min,每周至少3次,至少持续12周。推荐的运动方式有行走、伸踝或屈膝运动。也可以采用其他运动形式,但有效性不明确。FontaineIV级患者不推荐进行常规运动治疗。
2.药物治疗:
(1)西洛他唑(Cilostazol):西洛他唑是一种强效磷酸二酯酶III抑制剂。1999年FDA批准用于治疗间歇性跛行。2007年被TASCII指南推荐作为治疗间歇性跋行的一线药物。西洛他唑具有抗血小板活性和舒张血管特性,不仅能够直接抑制血小板功能,改善内皮细胞功能,还可通过减少循环中活化或预调节血小板数目而有效预防血栓性疾病。
(2)前列腺素类药物:分为静脉和口服剂,前者如前列腺素E1(前列地尔)等,后者如贝前列素钠及伊洛前列素等。药理作用是扩张血管和抗动脉粥样硬化(保护血管内皮、抗内膜增生、抗血小板)。可提高患肢AB1,改善由下肢缺血引发的间歇性跛行、静息痛以及溃疡等症状。
(3)沙格雷酯:5-羟色胺(5-HT2)受体选择性拮抗药。通过选择性地拮抗5-HT2与HT2受体的结合,抑制血小板凝集及血管收缩。用于改善慢性动脉闭塞症引起的溃疡、疼痛及冷感等缺血症状。
3.血运重建:应根据患者的向身情况个体化选择合理的血运重建方式。无症状或症状轻微的下肢ASO无需预防性血运重建。
(1)腔内治疗:许多中心选择腔内治疗作为首选的血运重建方法,因为相对手术而言,腔内治疗并发症发生率和死亡率均较低,而且如果治疗失败还可以改用开放手术治疗。当间歇性跛行影响生活质量,运动或药物治疗效果不佳,而临床特点提示采用腔内治疗可以改善患者症状并且具有良好的风险获益比时,建议采用腔内治疗。治疗下肢ASO的血管腔内技术较多,例如经皮球囊扩张成形术(PTA)、支架植入、斑块切除术、激光成形术、切割球囊、药物球囊、冷冻球囊以及用药物溶栓治疗或血栓切除等。
①主-髓动脉病变:主-髂动脉TASCA〜C级病变推荐首选腔内治疗。当TASCD级病变合并严重的内科疾病或存在其他手术禁忌时也可以选择腔内治疗,但应在有经验的中心完成。当球囊扩张效果不满意时(如跨病变压力差持续存在、残余狭窄>50%或发生影响血流的夹层)应植入支架。
②股-腘动脉病变:股-腘动脉TASCA〜C级病变应将腔内治疗作为首选治疗方式;当TASC-D级病变合并严重的内科疾病或存在其他手术禁忌时也可以选择腔内治疗,但应在有经验的中心完成。覆膜支架可以作为复杂股浅动脉病变治疗的一个选择。在治疗股-腘动脉病变时,药物涂层球囊较普通球囊具有更高的近期通畅率。激光成形和斑块切除技术等也是股-腘动脉病变腔内治疗的选择。
③腘动脉以下病变:保肢是腘动脉以下病变腔内治疗的最主要目的。当需要重建腘动脉以下血运时,腔内治疗应作为首选治疗方案,球囊扩张是首选治疗方法。不推荐常规支架植入治疗,支架植入可以作为球囊扩张成形术效果不满意或失败后(如压力差持续存在、残余狭窄>50%或发生影响血流的夹层)的补救治疗方法。激光成形和斑块切除技术等可作为腘动脉以下病变腔内治疗的选择。
(2)手术治疗:
①手术适应证:
严重间歇性跛行影响患者生活质量,经保守治疗效果不佳;
影像学评估流入道和流出道解剖条件适合手术;
全身情况能够耐受。<50岁患者的动脉粥样硬化病变的进展性更强,导致疗效不持久,这类患者间歇性跛行的手术治疗效果不明确,手术干预要相当慎重。手术应在有经验的医疗中心进行。
②手术方式:
可以通过解剖旁路或解剖外旁路来重建病变部位血供。当需要通过手术重建主髂动脉血运时一般选用人工合成材料;需要重建腹股沟韧带以下肢体血运时,可以采用自体静脉或人工合成材料。对于预期寿命不长的患者,可给予恰当的镇痛以及其他支持性治疗。对于复杂的多节段病变,也可采用复合手术(手术联合腔内治疗)的方法分別改善流入道或流出道。
③主-髂动脉闭塞性病变:肾下腹主动脉-双侧髂(股)动脉旁路术是主髂动脉弥漫性病变的推荐术式,可选择经腹或腹膜后入路,也可通过腹腔镜技术进行。不同近端吻合方式(端-端或端-侧)对通畅率无影响,聚四氟乙烯或编织涤纶人造血管均可选择。主髂动脉内膜切除术是主髂动脉闭塞可以选择的一个术式,优点是能够避免与移植物可能相关的感染及降低多种晚期并发症。适用于较年轻以及由于血管细小不适合腔内治疗或主-双股动脉旁路术的患者。由于解剖原因或心肺疾病等原因不能行经腹主髂(股)旁路的患者,可考虑改良腹膜后途径或主-单股加股-股旁路术。其他可选择的手术方式有腋-股旁路及单纯股-股旁路术等。胸主动脉在一定条件下也可以作为流入道的选择。除特殊情况(如慢性肾下型主动脉闭塞合并严重跛行而不适合行主-股旁路的患者)外,腋-股旁路一般不用于间歇性跛行的治疗。④腹股沟韧带以下动脉病变:腹股沟韧带以下旁路术,包括人工血管及向体血管旁路,是腹股沟韧带以下动脉疾病最常用的血管重建方法。旁路手术需要在通畅的流入道上建立近端吻合口,流出道质量较远端吻合口位对通畅率影响更大。流入道的位包括股总动脉、股浅动脉、股深动脉以及腘动脉甚至胫动脉。旁路远端吻合口的位置包括股动脉、膝上及膝下腘动脉、胫动脉、腓动脉甚至足背动脉。向体静脉旁路术后通畅率优于人工血管旁路术。股动脉内膜剥脱术现在多作为动脉旁路术的辅助,以构建良好的吻合口。内膜切除通常从股总动脉开始,切口超过病变的后部沿股深动脉延伸,通常至少要到一级或二级分支,远端内膜可以固定或不固定。在行腹股沟韧带以下旁路手术的同时处理股深动脉病变非常重要,如果旁路手术失败,充足的股深动脉灌注可防止发生严重的复发性肢体缺血。
⑤手术后随访:主-股动脉旁路的通畅率较高,但旁路手术治疗腘动脉以下病变的移植物通畅率较差。影响旁路手术早期(<30天以内)通畅率的主要因素包括旁路近端和远端的血管情况、围手术期的抗凝措施和医生的手术技术操作等。影响远期(>90d)通畅率的主要因素包括吻合口的内膜增生再狭窄以及动脉硬化病变的进展等。动脉旁路术后需定期随访。随访内容包括:记录跋行症状好转情况,病变近端、移植物和远端血管的脉搏情况,多普勒超卢检查整个移植物并记录收缩期速度峰值,计算跨病变部位的速度比,测量静息和运动时ABI,以减少心血管事件的发生,提高通畅率。腹股沟韧带以下动脉裸支架植入术后推荐进行至少1个月的双联抗血小板治疗。腹股沟韧带以下动脉旁路术后推荐采用阿司匹林单药或双联抗血小板治疗。也有研究显示腹股沟以下向体静脉旁路术后采用维生素K抑制剂(华法林)行抗凝治疗的通畅率优于阿司匹林,人工血管旁路术后采用阿司匹林的通畅率更高;但华法林抗凝治疗的大出血风险增大。因此,应根据患者向身情况制定个体化抗血小板和抗凝方案。
采用人工移植物行膝下动脉旁路的患者,推荐采用双联抗血小板治疗。
(三)严重下肢缺血(CLI)和保肢治疗(图3)
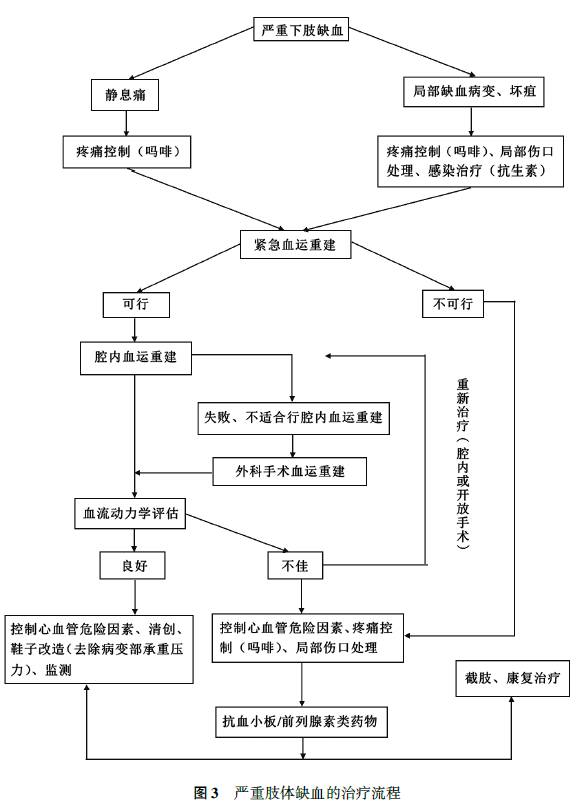
CLI是下肢动脉疾病最严重的临床表现,特点为由动脉闭塞引起的缺血性静息痛、溃疡或坏疽。CLI患者的预后远不如间歇性跛行患者好,表现在高截肢率及高死亡率,因此,对CLI的治疗应更为积极。CLI治疗的目的是保肢,当技术可行时,应对所有CLI患者进行血管重建。在患者一般情况稳定的前提下,对心脑血管疾病的治疗不应该影响CLI的治疗。
理想的治疗应遵循个体化原则,综合考虑患者临床表现的紧迫性、伴发病和导致CLI的局部动脉解剖情况等。如肢体已经是终末期缺血或存在严重感染(如气性坏疽),此时紧急截肢是救命的唯—选择。CLI患者合并严重的心肌缺血、心肌病、充血性心力衰竭、严重肺部疾病或肾功能衰竭时,手术治疗的风险增高,应尽可能首选腔内治疗。
1.CLI的药物治疗:
CLI药物治疗的目的是缓解静息痛、促进溃疡愈合,以及辅助救肢。抗血小板药物(阿司匹林、氯吡格雷和西洛他唑等)可以预防心血管及其他部位动脉硬化闭塞症的进展。前列腺素类药物(如前列地尔注射液或贝前列素钠)可以有效减轻静息痛、促进溃疡愈合,其中伊洛前列素可有效降低截肢率。
在药物治疗过程中或血管重建手术前后,缺血性静息痛或肢体坏疽引起的疼痛需要适当、有效的止痛治疗,给药方案遵循一般止痛治疗的阶梯治疗原则,从对乙酰氨基酚等非甾体类抗炎药开始,如无效可再尝试阿片类止痛药物。对于缺血性溃疡或坏疽合并感染的患者,需要在病原学检查结果的指导下,有针对性地使用广谱、足量、足疗程的全身抗生素治疗。
2.CLI的腔内治疗:CLI治疗的最重要转变是从开放性旁路手术逐渐向创伤较小的腔内治疗的转变。在许多医疗中心,腔内治疗已经成为CLI血管重建的首选方案,而血管旁路术成为了后备选择。腔内治疗的最大优势是创伤小、并发症发生率低以及近期疗效好,但远期通畅率较低仍是限制其应用的主要原因,因此,更多地适用于亟需救肢但手术风险较高或预期生存时间较短的患者。CLI的腔内治疗应以重建至少1支直达足部的血管为手术目标,具体重建方法可参考“间歇性跛行的腔内治疗”。
3.CLI的手术治疗:对于威胁肢体的严重缺血,如患者预期寿命>2年,在向体静脉可用、且全身情况允许的情况下,开放手术也可作为首选。对于流入道和流出道均有病变的CLI患者,应优先处理流入道病变;如流入道血管重建后,肢体缺血或溃疡仍无好转,应进一步处理流出道病变。如果患者情况允许,也可考虑同时处理流入道和流出道病变。对于肢体已严重坏死、顽固的缺血性静息痛、合并感染或败血症,并且因合并症导致预期生存时间较短的CLI患者,应考虑首选截肢。对于预期生存时间不足半年的患者,恰当的镇痛及其他支持性治疗或许是最好的治疗方式。
手术方式可通过解剖旁路或解剖外旁路来重建病变部位血供。如流入道血流通畅,且有足够的侧支血管供应远端的股浅动脉闭塞,也可选择行单纯股深动脉成形术。从远期通畅率角度考虑,向体血管是首选的移植材料,人丁血管次之。尽量选择患侧大隐静脉,如同侧无可用大隐静脉,可选择对侧大隐静脉或小隐静脉及上肢静脉作为移植血管。
(2)腹股沟韧带以下动脉病变:导致CLI的腹股沟韧带以下股、腘动脉病变常常表现为多节段性狭窄或闭塞。移植血管的选择及远端吻合部位的选择是影响旁路手术效果的两个主要因素。如远端吻合口位于膝上,向体静脉与人工血管旁路的远期通畅率相当,均可选择使用;如远端吻合口位于膝下,应尽可能使用自体大隐静脉作为移植血管,以获得较好的远期通畅率。手术方式有两种:原位或倒置的向体大隐静脉旁路术。当静脉长度不够时,可采用复合序贯式旁路,即人工血管吻合到膝上腘动脉后,用向体静脉与更远处的动脉吻合,必要时还可以使用由人工血管与向体静脉组合而成的复合血管移植物。
(四)糖尿病性下肢缺血治疗
应重视糖尿病下肢缺血的多科综合治疗。在国内学者提出的“改善循环、控制血糖、抗感染、局部清创换药、营养神经、支持治疗”六环法措施的基础上还应增加:(1)控制高危因素:如降压、降脂和戒烟;如果病因不去除,病变继续发展,治疗的效果就不佳。(2)截肢(截趾):当坏疽的病变已经发生,截肢(趾)仍然不失为一种明智的选择。然而无论如何,下肢动脉血流的重建在治疗糖尿病下肢缺血的方法中,是最重要和关键的措施。重建的方法同CLI的治疗。
(五)急性下肢缺血的治疗(图4)
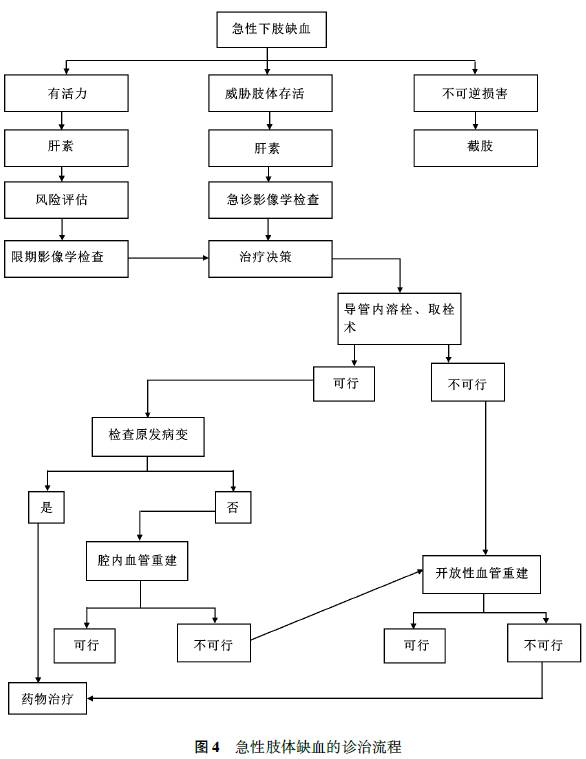
急性肢体缺血(ALI)的患者可在数小时内发生神经和肌肉的不可逆性损伤,因此应强调对所有怀疑ALI的肢体血流情况进行多普勒超卢检查,尽快评估并决定治疗方案(表7)。

对于威胁肢体存活的ALI患者,需行急诊血运重建。经皮血栓抽吸装置可用于外周动脉闭塞所致的急性肢体缺血的辅助性治疗。外科手术治疗适用于出现运动或严重感觉障碍的患者,尤其是下肢缺血严重已威胁患肢生存、腔内溶栓治疗可能延误血运重建时间的ALI患者。对于因心源性或其他来源栓子脱落引起的急性下肢动脉栓塞,动脉切开取栓术是首选的治疗方法。当肢体无法挽救时,需在患者全身情况恶化之前截肢。
血运重建后要密切关注缺血再灌注损伤导致的局部和全身并发症,出现骨筋膜室(骨间隔)综合征,应该及时行骨筋膜室切开减压。
(六)中医中药治疗
辨病辨证论治:中医以辨证论治为主,但活血化瘀法贯穿始终,常配合静脉滴注活血化瘀药物,以建立侧支循环,改善肢体血运。
(1)寒凝血瘀证:肢体明显发凉、冰冷、呈苍白色,遇寒冷则症状加重,步履不利,间歇性跛行、多走疼痛加重,小腿酸胀,休息减轻。古淡,苔薄白,脉沉迟。病机概要:寒湿之邪阻于脉络,则气血凝滞,经络阻塞,不通则痛。四肢气血不充,失于濡养。治法:温经通脉。治宜温通活血,用阳和汤加味。熟地黄、黄芪各30g,当归,干姜、怀牛膝各15g,地龙12g,麻黄6g。中成药:脉管复康片、金匮肾气丸、银杏叶片等。
(2)血脉瘀阻证:肢体发凉怕冷,疼痛,步履沉重乏力,活动艰难,严重者持续疼痛,夜间尤甚、彻夜不寐。肢端、小腿有瘀斑,或足紫红色、育紫色。古有瘀斑或舌紫绛,脉弦涩。病机概要:邪阻脉中,经络阻塞,气血凝滞,气血不达四末,失于濡养。治法:活血化瘀,通络止痛。治宜益气活血,内服桃红四物汤加味。川芎15g,当归20g,生熟地各15g,赤芍10g,柴胡6g,枳壳10g,桃仁10g,红花10g,炙甘草10g。中成药:活血通脉胶囊、脉络疏通颗粒等。
(3)气血亏虚证:患肢皮肤干燥、脱肩、光薄、皲裂,趾增厚、变形、生长缓慢,汗毛脱落,肌肉萎缩。出现身体消瘦而虚弱,面色苍内,头辇心悸,气短乏力。古质淡,苔薄内,脉沉细无力。病机概要:气血亏虚,肢端失养,久则肌肉萎缩,患趾溃破。治法:补益气血。药用八珍汤合补阳还五汤加减。熟地30g,当归尾15g,党参15g,白术15g,地龙10g,黄芪30g,茯苓20g,川芎10g,当归15g,赤芍15g。中成药:八珍丸、复方丹参片等。
(4)血运重建术后:行外科旁路术后或PTA术后,患者下肢缺血症状有明显改善,结合疾病本身血瘀存在,治以活血化瘀或补益之剂,方如下:高龄术后体虚予补气扶正,体虚用地黄丸合四物汤加减:滋补肝肾,活血止痛。熟地30g,山萸肉15g,山药30g,丹皮15g,泽泻10g,茯苓20g,川芎10g,当归15g,赤芍丨5,炙甘草10g。虚证不明显者,方用血府逐瘀汤加减:温阳通经止痛。川芎15g,当归20g,生熟地各15g,赤芍10g,柴胡6g,枳壳10g,桔梗6g,川牛膝20g,桃仁10g,红花10g。
2.中成药治疗:(1)血府逐瘀胶囊:0.4克/粒,每次6粒,每天2次。(2)灯盏生脉胶囊:0.18克/粒,每次2粒,每天3次。
中华医学会外科学分会血管外科学组成员及主要参加讨论专家(按姓氏笔画顺序):
戈小虎、王玉琦、王兵、王深明、王劲松、王豪夫、包俊敏、毕伟、刘昌伟、刘长健、刘冰、刘鹏、李晓强、李震、李毅清、李鸣、吕雄、庄百溪、陈忠、谷涌泉、陆清声、陆信武、时德、汪忠镐、吴丹明、吴庆华、吴向未、辛世杰、肖占祥、余波、张小明、张福先、张鸿坤、张岚、张桕根、张纪蔚、金星、金辉、金志宏、周为民、郭伟、郭平凡、郭曙光、郝斌、胡何节、姜维良、姚陈、赵纪春、赵捃、赵志靑、袁时芳、常光其、符伟国、章希炜、董同祥、蒋米尔、景在平、覃晓、舒畅、翟水亭