摘要:脑梗死是一种严重危害人类健康的重大疾病,程序性坏死是细胞程序性死亡形式之一。近些年研究认为程序性坏死参与了脑梗死后神经元损伤,但其分子调控机制尚不清楚。作者就程序性坏死的概念及相关通路、程序性坏死与脑梗死神经元损伤的关系、程序性坏死标志物在脑梗死患者血浆中的水平、程序性坏死与脑梗死治疗等几个方面进行综述,归纳总结了二者的相关性,为制定新的脑梗死治疗策略提供理论依据。
脑梗死是一种具有高致残率和高致死率的疾病,脑血管阻塞引起相应组织区域血流量的突然减少或中断,导致供血区脑组织严重缺血缺氧,形成相应的梗死灶,引起一系列病理生理过程,包括兴奋性氨基酸毒性、能量代谢障碍、血-脑屏障破坏、氧化应激反应、钙超载、炎性反应和凋亡等,最终引起神经元死亡。然而,脑梗死后神经元不同死亡形式的激活和调控机制尚不清楚。目前认为脑梗死后神经元死亡形式包括程序性细胞死亡和非程序性细胞死亡。程序性细胞死亡是细胞通过特定的信号途径有序死亡的过程,它是一种受控的生理现象,在维持组织正常结构和功能中起着重要作用,在这些过程中,细胞会通过一系列的信号转导途径启动细胞死亡程序,最终导致细胞核发生变化、细胞体体积减小、细胞膜变性等;非程序性细胞死亡通常被认为是一种不受调节的细胞死亡过程,其特征为细胞肿胀、生物膜完整性丧失、细胞内容物溢出和离子梯度的消散,从而引发炎性反应等。非程序性细胞死亡主要是坏死,而程序性细胞死亡包括细胞凋亡、程序性坏死、自噬、铁死亡和焦亡等。目前认为多种细胞死亡通路参与脑梗死后神经元死亡,是否一条或多条死亡途径占主导位置以及多种途径之间的相互关联有待进一步研究。作为程序性细胞死亡的形式之一,程序性坏死近年来在脑梗死中的作用被广泛关注,本文就程序性坏死与脑梗死的关系进行了归纳总结。
1 程序性坏死的概念及相关通路
程序性坏死是近年来新发现的一种细胞程序性死亡方式,与细胞凋亡形态学特征不同,其具有典型的坏死表现,如细胞肿胀、细胞膜破裂、细胞质内物质流出、炎性反应和周围组织损伤等。然而,与坏死被动的病理过程不同,其具有独特的信号通路,由受体相互作用蛋白激酶1(receptor-interacting protein 1,RIP1)和受体相互作用蛋白激酶3(receptor-interacting protein 3,RIP3)调控。RIP1 和RIP3 的磷酸化及坏死体的形成是程序性坏死的重要标志。程序性细胞死亡不同死亡形式与坏死的触发途径和形态特征见表1。

程序性坏死可由肿瘤坏死因子α(TNF-α)DNA损伤、辐射等激活,其中以TNF-α 诱导发生的程序性坏死最为经典,其激活程序性坏死途径如下:首先,TNF-α与细胞膜上的TNF受体1 结合,募集TNF受体相关死亡结构域、RIP1等,形成复合物Ⅰ,然后复合物Ⅰ 与肿瘤坏死因子受体1 分离,形成由RIP1、RIP3、凋亡相关因子相关死亡结构域蛋白、TNF受体相关死亡结构域和含半胱氨酸的天冬氨酸蛋白水解酶8组成的复合物Ⅱ。当含半胱氨酸的天冬氨酸蛋白水解酶8 失活时,RIP1 和RIP3 能够相互磷酸化,形成“坏死体”,进一步磷酸化混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)以使其活跃。活化的MLKL低聚体与细胞内膜结合形成选择性离子通道,导致钙离子大量流入,改变细胞渗透压,最终导致细胞膜破裂和细胞死亡(图1)。
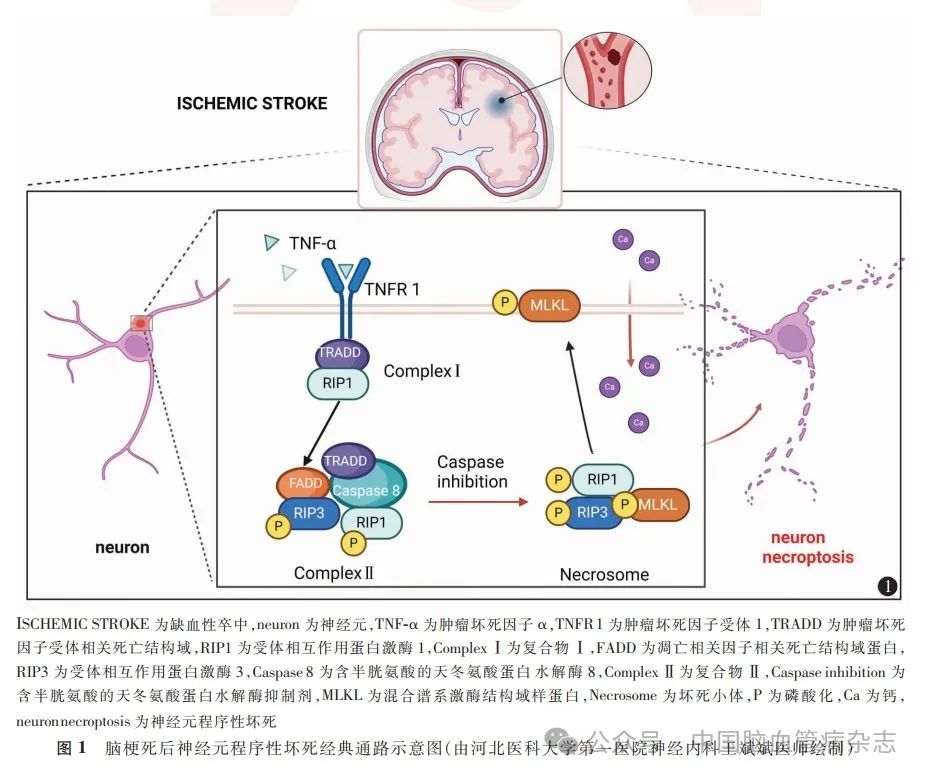
RIP1、RIP3和MLKL通常用作程序性坏死的分子标志物。研究表明,在大鼠大脑中动脉闭塞/再灌注(middle cerebral artery occlusion and reperfusion,MCAO / R)模型中,这些标志物在大鼠大脑的同侧纹状体中增加。最近的一项研究进一步发现,RIP1 和RIP3 缺失可减少程序性坏死,减轻小鼠MCAO / R后的脑损伤。然而,一些研究质疑RIP1在程序性坏死信号传导中的功能,认为RIP3 -MLKL轴起着重要作用。RIP3不仅可以被RIP1激活,而且在Ser229 / Thr232位点自磷酸化后自动激活。有研究表明,RIP3 可以激活位于线粒体外膜上的磷酸甘油酸变位酶家族成员5,导致线粒体损伤并最终形成程序性坏死。此外,RIP3 和高迁移率族蛋白1(high mobility group box 1 protein,HMGB1)在大鼠MCAO模型中显著升高,应用RIP3 抑制剂可以减少HMGB1的释放,提示RIP3可能在HMGB1介导的程序性坏死中发挥重要作用。以上研究结果反映了RIP3在程序性坏死中的核心位置,但具体病理生理过程仍需进一步探索。
2 程序性坏死与脑梗死神经损伤的关系
多项研究提示,程序性坏死参与了脑梗死的发展和转归。程序性坏死的经典核心相关指标RIP1、RIP3、MLKL变化在诸多体内或体外脑缺血模型中被发现。Vieira 等运用小鼠CA1 海马原代神经元构建了氧葡萄糖剥夺模型,发现该模型细胞中RIP1和RIP3在信使RNA和蛋白水平上调,含半胱氨酸的天冬氨酸蛋白水解酶8 mRNA水平降低,这与经典的程序性坏死的信号通路相吻合。在MCAO诱导大鼠脑缺血的体内模型中,同样检测到梗死区磷酸化RIP1、磷酸化MLKL 含量的升高,而应用RIP1的特异性抑制剂Nec-1 则有效减少了程序性坏死,并且减少了大鼠脑梗死模型的梗死体积。
脑梗死后如何诱发程序性坏死启动,最终导致细胞死亡的病理生理过程尚不清楚。有研究表明脑梗死后小胶质细胞的激活会释放细胞因子,如TNF-α、TNF相关凋亡诱导配体和凋亡相关因子配体,这些死亡信号与其细胞表面膜受体的结合会触发RIP1 和其他蛋白质的募集,形成复合物Ⅰ ,进而激发一系列级联反应,最终导致程序性坏死。另一项研究显示,脑梗死后细胞缺血缺氧,三磷酸腺苷(adenosine triphosphate,ATP)合成不足,导致含半胱氨酸的天冬氨酸蛋白水解酶8 酶活性下降,继而诱发程序性坏死启动。另有研究表明,大鼠双侧椎动脉和颈总动脉阻断后,线粒体通透性转变孔道通透性增加,线粒体肿胀,功能紊乱,ATP耗竭,进而引起导致程序性坏死。特异性线粒体通透性转变孔道抑制剂环孢菌素A 可减少脑缺血动物模型中的神经元程序性坏死和脑梗死体积。此外,脑缺氧后产生大量的活性氧,加速了细胞内p53 的磷酸化,导致线粒体损伤,进而引起程序性坏死增多。脑梗死后程序性坏死可激活星形胶质细胞产生促炎介质,导致坏死周围聚集更加丰富的毒性物质,诱发更加严重的炎性反应,加重脑梗死后脑损伤。有研究表明,脑梗死程序性坏死过程中形成并激活了核苷酸结合寡聚化结构域样受体热蛋白结构域相关蛋白3炎症小体复合物;脑梗死引起的一些炎性反应可作为上游参与程序性坏死的启动和触发,而同时,程序性坏死的发生又反过来加剧了炎性反应。
此外,程序性坏死造成脑梗死后神经损伤的细胞类型也有差异。有研究显示,在小鼠脑梗死模型中,在脑梗死1 ~ 3 d内的急性期发生的程序性坏死以神经元为主;而在脑梗死5 ~ 7 d亚急性期中,发生程序性坏死的细胞与胶质纤维酸性蛋白、离子钙结合衔接分子1等共定位,提示脑梗死亚急性期程序性坏死以星形胶质细胞和小胶质细胞为主。值得注意的是,程序性坏死与其他程序性细胞死亡形式相互影响,有共同的作用靶点。有研究表明,程序性坏死可通过RIP3与凋亡诱导因子相互作用,从细胞质转移至细胞核,从而促进DNA降解和神经元程序性坏死。此外,与自噬有关的细胞程序性死亡也对程序性坏死的发生产生了影响。有研究表明,自噬减少可以增加程序性坏死,而自噬增加则可以抑制程序性坏死。另有研究显示,程序性坏死和焦亡也有着共同的信号通路,如核因子κB信号通路、核苷酸结合寡聚化结构域样受体热蛋白结构域相关蛋白3 通路等,在脑梗死后可以同时被触发。由此可见,程序性坏死造成的神经损伤有复杂的病理生理机制,程序性坏死与其他形式的程序性细胞死亡之间存在着相互作用,我们需要深入研究这些相互作用,以更好地理解程序性细胞死亡对脑梗死的影响,并开发新的治疗策略。
3 程序性坏死标志物在脑梗死患者血浆中的水平
程序性坏死主要的标志性蛋白包括RIP1、RIP3和MLKL。RIP1是一种重要的细胞死亡信号分子,属于TNF受体超家族的蛋白质,RIP1 与TNF 受体的结合可激活多种信号通路,参与了多种生物学过程,如发育、炎性反应、免疫应答等。研究显示,RIP1在多种人类疾病中发挥重要作用,如癌症、心血管疾病和神经系统疾病等。RIP1 在不同疾病患者的血浆水平可能存在差异。有研究显示,血浆RIP1水平与急性脑梗死预后相关,其水平升高与发病后1年不良预后呈正相关。此外,在心肌梗死患者中,血浆RIP1 水平明显升高,并与病情严重程度和出院后5 ~ 24 个月预后有关。另外,在某些肿瘤(如恶性黑色素瘤和结直肠癌)患者中,RIP1的表达水平与治疗效果和术后预后也有一定相关性。不同疾病中RIP1 的血浆水平变化情况还需要更多的研究来进一步证实。
RIP3是程序性细胞死亡途径的重要调控因子,其通过与RIP1和TNF受体相关死亡结构域结合来介导细胞程序性坏死,而其在某些条件下也可以介导细胞凋亡。近年来,研究者发现,RIP3 还与多种疾病的发生和发展密切相关,如癌症、心血管疾病、炎性疾病等,因此,RIP3 也成为了一种重要的治疗靶点,是调节细胞存活、凋亡和坏死的关键蛋白。RIP3通过导细胞坏死、诱导线粒体功能障碍和破坏能量代谢参与梗死后神经元死亡有研究显示,RIP3水平是预测脑梗死预后的独立危险因素。RIP3可促进巨噬细胞坏死并影响血小板活化和凝血功能,加重动脉粥样硬化病变。血浆RIP3水平与ST段抬高型心肌梗死预后不良有显著相关性。血浆RIP3水平与冠状动脉粥样硬化性心脏病独立相关,RIP3 水平越高,冠状动脉粥样硬化性心脏病患者病情越严重。
MLKL是一种与细胞死亡相关的蛋白,通过被磷酸化来激活,然后在细胞膜附近聚集,最终导致胞膜破裂和细胞死亡。有研究显示,血浆MLKL水平可作为评估脑梗死患者预后的重要指标。此外,血浆MLKL水平在其他疾病中也有研究。血浆MLKL可以作为一种肿瘤标志物用于评估肿瘤患者的预后和治疗效果。此外,血浆MLKL水平还可能与免疫系统疾病相关。心肌梗死患者中,血浆MLKL水平明显升高,并与严重程度和长期预后有关。由此可见,程序性坏死标志物RIP1、RIP3和MLKL血浆水平在脑梗死等多种疾病中有重要临床意义,是潜在的治疗靶点和预后预测指标。
4 程序性坏死与脑梗死的治疗
大量的研究证实了程序性坏死与脑梗死后神经损伤有关,因此探索了针对程序性坏死的各种治疗方法,包括药物干预和基因修饰,但目前均处于基础研究阶段,尚未进入临床研究及应用。
以程序性坏死为靶点的药物如JLX001 是天然化合物环维罗布辛D的双盐酸盐。有研究结果表明,JLX001可明显降低MCAO/ R模型大鼠脑组织中的病理损伤和脑梗死体积,降低神经元程序性坏死相关分子的表达水平,提示JLX001可能通过经典的RIP1/ RIP3/ MLKL途径减少程序性坏死。Pellino3是一种泛素E3 连接酶,有研究显示,在大鼠脑缺血模型中,Pellino3 可通过降低RIP1 来阻止TNF-α诱导的程序性坏死复合物的形成,进而减少脑梗死体积。既往研究表明,在啮齿动物中施用胰高糖素样肽1受体激动剂利拉鲁肽可通过介导活性氧、细胞凋亡和程序性坏死途径,减少缺血-再灌注损伤后脑梗死体积。促红细胞生成素是控制红细胞生成的激素,在脑缺血-再灌注损伤的情况下可通过减少脑氧化应激,保留小胶质细胞形态,减轻海马程序性坏死和凋亡,进而起到神经保护的作用。此外,草药提取物蒲古黄酮是从黄芩等植物中提取出来的一种黄酮类化合物,可通过抗炎途径抑制程序性坏死,保护大鼠大脑免受缺血性损伤。
在以程序性坏死为靶点的基因修饰方面,也进行了多项基础研究,可使用RIP3敲除、MLKL敲除、短发夹RNA RIP1转染、小干扰RNA RIP3转染或小干扰RNA MLKL 转染完成程序性坏死的遗传修饰。这些基因的缺失可导致脑梗死体积减小和降低局灶性脑缺血-再灌注损伤中的神经功能缺损。此外,颗粒蛋白前体是中枢神经系统中的一种多功能蛋白,其可调节细胞生长、分裂和细胞存活。颗粒蛋白前体过表达的小鼠在脑缺血-再灌注损伤期间显示出脑梗死体积和神经功能缺损的减少。颗粒蛋白前体的过表达降低了磷酸化RIP1 /RIP1、磷酸化RIP3 / RIP3 和磷酸化MLKL/ MLKL 的表达,证实其通过减少程序性坏死发挥神经保护作用。
作为脑梗死后神经元死亡形式之一,程序性坏死参与了脑梗死的病理生理过程,最终导致神经损伤,其病理生理机制包括诱发氧化应激、炎性反应、增加线粒体损伤等,针对程序性坏死的干预可能是减轻脑梗死后神经损伤的潜在治疗靶标。然而,目前程序性坏死与脑梗死的相关性研究尚存在以下不足:(1)脑梗死后神经元死亡机制复杂,在某些条件下可以同时触发多种形式的程序性细胞死亡,我们既往的研究表明,脑梗死后可同时触发细胞调亡和程序性坏死,不同细胞死亡形式之间的串扰值得进一步研究。(2)尽管目前有大量动物或细胞实验研究证实程序性坏死在脑梗死中的作用,一些靶点药物也在开发,但目前仍无真正应用于临床的药物,从基础实验到临床应用还有很长的路要走。总之,我们需要深入研究程序性坏死与其他细胞死亡形式之间的相互作用,以更好地理解程序性细胞死亡对脑梗死的影响,探索能够同时干预多种信号通路的新型药物和治疗策略,为脑梗死的治疗提供新选择。
偏头痛相关脑梗死
![]() 0
2023-11-05
点击查看
0
2023-11-05
点击查看

【论著】平均血小板体积和脑白质高信号对穿支动脉疾病型脑梗死早期神经功能恶化的预测价值
![]() 0
2024-03-02
点击查看
0
2024-03-02
点击查看

【病例报告】多次颈动脉支架置入术治疗放射性多发颈部动脉狭窄合并脑梗死一例
![]() 0
2024-03-04
点击查看
0
2024-03-04
点击查看

【论著】术前DSA检查与颈动脉内膜切除术后新发脑梗死特点及相关性分析
![]() 0
2024-03-27
点击查看
0
2024-03-27
点击查看

揭秘益气通络颗粒如何攻克缺血性脑卒中:网络药理学与多组学的神奇联手!
![]() 0
2024-04-25
点击查看
0
2024-04-25
点击查看

Front Neurol:1993 - 2023年针刺治疗脑梗死的文献计量学分析
![]() 0
2024-05-19
点击查看
0
2024-05-19
点击查看
