骨髓增生异常综合征(MDS)特征是全血细胞减少、无效造血、进展为急性髓系
白血病(AML)风险增加。
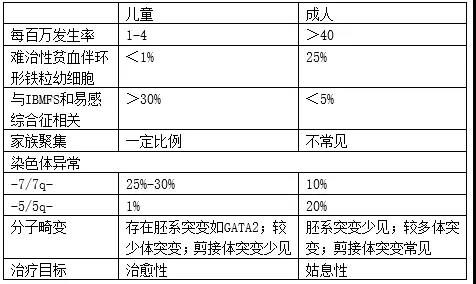
儿童MDS年发生率1-4/百万,患者多有细胞毒药物暴露史,如拓扑酶抑制剂和烷化剂,或遗传性骨髓衰竭综合征(IBMFS)、遗传易感综合征(表1和2)。成人MDS体突变,如TET2、DNMT3A、TP53和剪接体复合物,在
儿童患者均不累及,儿童MDS驱动突变包括SETBP1、ASXL1、RUNX1和RAS。意大利Locatelli教授在BLOOD杂志以4份病例展示了儿童MDS发病机制及治疗的异质性。
表1 儿童与成人MDS的差别
表2 儿童易发生MDS的综合征/易感状态
病例1
8岁男孩因下肢瘀斑和血肿就诊,血红蛋白11.1g/dL,ANC1.3x109/L,PLT34×109/L,BM示低增生,形态异常,累及髓系和巨核细胞,无原始细胞。细胞遗传学未见异常核型,骨髓活检证实增生明显减低和岛状红系增生。3周后复查结果一致,
诊断儿童难治性血细胞减少(RCC),染色体断裂和端粒长度检查除外了范可尼贫血(FA)和端粒体病。家族内无合适供者。
因ANC>1.0×109/L和PLT34×109/L,采取观察等待策略,3个月内ANC<1.0×109/L且血小板输注依赖,此时找到匹配无关供者(UD),遂噻替哌/氟达拉滨预处理后行异基因造血
干细胞移植(HSCT),GvHD
预防包括ATLG、环孢A和短程甲氨喋呤。造血恢复轻度延迟,I级皮肤急性GvHD。HSCT27个月后,
临床状态好、血象正常、
免疫功能完全恢复。
儿童全血减少伴BM增生明显减低的病因多种,RCC、获得性重型再障(SAA)和IBMFS最常见,3种疾病的临床和组织病理学鉴别很具挑战,对治疗影响巨大。RCC是儿童MDS最常见亚型,男女发病相当,中位
诊断年龄7-8岁,与成人患者多表现为贫血不同,儿童患者还表现为血小板减少和/中性粒细胞减少,此外还有MCV增高及血红蛋白F增加。
RCC诊断
RCC定义是持续血细胞减少,BM原始细胞<5%,PB原始细胞<2%,发育异常,多为红系和巨核。儿童RCC的特殊组织病理学改变包括不成熟红系前体造血岛伴少量粒细胞,巨核细胞减少或缺乏,小巨核少见,高达80%患者BM增生减低。
有经验的病理医师可区分RCC与SAA,但RCC和IBMFS单纯依赖形态学无法区分,15%疑为RCC的患者经功能检测诊断为范可尼贫(FA),很多FA患者并无明显体格发育异常。端粒疾病患者也可以单独BM衰竭为首发表现,依靠临床并不能准确诊断。因此RCC诊断需综合病史、体格检查、功能检测、FA基因检测、端粒长度等各项检查,最近研究显示NGS对诊断IBMFS很有帮助。70-80%RCC并无核型异常,11%患者可有单体7。
RCC治疗
异基因HSCT是MDS治愈性方法,因此应尽早配型,RCC伴单体7属高危,应尽早移植治疗,伴复杂核型者更应尽早移植,正常核型且无输血依赖或明显的中性粒细胞减少则推荐观察等待,持续中性粒细胞减少和/血小板和红细胞输注依赖时也推荐治疗干预。
既往HSCT采用清髓方案时无事件生存率75%,移植相关死亡是治疗失败主要原因,因此低增生和正常核型时减低剂量预处理可能更有利,正常或过增生BM或单体7或复杂核型应行清髓处理;推荐BM做为
干细胞来源并给予GvHD
预防以减少疾病复发风险、减低GvHD,无关供者脐血移植(UCBT)结果差于BM或PB干细胞来源,只推荐缺少匹配供者时;缺乏合适供者时
免疫抑制治疗(IST)+ATLG+环孢A对低增生且无不良核型RCC也是一种选择,因BM衰竭部分源于T细胞介导的造血抑制,兔ATLG结果差于马ATLG,加入艾曲波帕是否获益有待进一步研究,不过儿童RCC在IST后仍有复发或进展风险。
病例2
14岁女孩因发热15天入院,PLT52×109/L,WBC12.3×109/L,原始细胞2%,血红蛋白7.2g/dL,BM见18%原始细胞浸润,巨核细胞和红系发育异常,细胞遗传学示单体7,AML再现性突变
筛查阴性。2周后重复BM结果同前,诊断MDS-原始细胞增多(MDS-EB),无同胞匹配供者,6周后找到匹配UD,清髓处理后移植,HSCT14个月后仍处于完全缓解。
儿童进展期MDS
MDS时原始细胞在PB>2%或在BM中5%-20%时为MDS-EB,转化中MDS-EB(MDS-EB-t)的特征是PB或BM中原始细胞20%-29%,不过单次标本原始细胞比例并不能准确区分MDS-EB/MDS-EB-t和AML,需要排除AML再现性易位和细胞遗传学异常如单体7,无器官肿大和疾病快速进展更支持进展期MDS。
MDS-EB和MDS进展来的AML(MDR-AML)治疗很具挑战,治疗相关毒性大、复发风险高,单纯传统AML化疗的生存率<30%,大部分儿童进展期MDS经HSCT治疗获得成功,>12岁、诊断与HSCT间隔>4个月、严重GvHD可能增加TRM。HSCT前强化疗的作用仍需明确,BM原始细胞≥20%时AML样化疗可减少复发风险。
病例3
13岁男孩患先天耳聋,因中度全血细胞减少(WBC3.3×109/L,PLT92×109/L,血红蛋白10.4g/dL,单核和淋巴细胞减少)、高热、肺炎就诊,双下肢淋巴水肿,BM显示骨髓增生减低,原始细胞3%,细胞遗传学示三体8,拟诊RCC伴胚系GATA2突变,测序证实GATA2基因外显子6错义突变,其父母无此突变,因其为独子故寻找UD。
IBMFS/其它遗传易感与儿童MDS间的复杂关系
MDS可来自IBMF以及杂合胚系RUNX1和CEBPA突变,遗传易感性对MDS的影响知之甚少,近年注意到非综合征性家族性MDS/AML易感综合征,由GATA2、ETV6、SRP72、SAMD9和SAMD9L突变所致。GATA2胚系突变导致单倍剂量不足而出现一系列疾病,包括单核细胞减少、B淋巴细胞减少、NK细胞缺乏、先天耳聋、淋巴水肿(MonoMAC或Emberger综合征)、全血减少伴
感染、MDS或AML发生风险增高。
GATA2相关疾病在生命早期表现为造血、免疫和淋巴管综合征,伴全身
感染,生命后期MDS/AML风险明显增加,研究显示伴GATA2突变的青少年患者诊断年龄偏大,进展期MDS明显增多,70%具有单体7,再障发展来的MDS或治疗相关MDS(t-MDS)缺少GATA2突变,基于上述结果推荐MDS患者>4岁且伴单体7时均应行GATA2分析。GATA2突变不增加不良预后,但因疾病高进展风险应及时HSCT,避免IST。
1/3GATA2胚系突变者同时伴ASXL1异常,这些获得性突变使疾病不断进展,但GATA2突变患者移植的时机仍有争论,Locatelli教授推荐出现细胞增生不良且无严重并发症或向进展期MDS发展时进行HSCT。虽然大部分GATA2缺陷为散发,无MDS家族史或其它GATA2相关症状,但仍推荐家族内供者行GATA2检查。非清髓预处理增加植入失败和复发几率,提示预处理与更好的植入和去除恶性髓系克隆有关。
病例4
5岁女孩最先诊断为腹部IV期伯基特
淋巴瘤(骨髓受累),接受6周期化疗(含有环磷酰胺、依托泊苷)+利妥昔单抗治疗,完全缓解。随访6个月时PLT降至63×109/L,并进行性加重,同时中性粒细胞降至0.9×109/L,骨髓见三系增生异常,原始细胞12%,细胞遗传学见复杂核型(3种畸变),累及11q23。诊断为治疗相关MDS-EB,其姐HLA与之匹配,行HSCT,预处理包括马利兰、环磷酰胺和马法兰。HSCT后出现III级急性GvHD,累及皮肤和肝脏,激素和光疗后缓解,HSCT后100天免疫抑制治疗逐渐减量。9个月后出现血小板减少,BM见10%原始细胞,细胞遗传学改变同HSCT前,3个月后因疾病进展患者死亡。
t-MDS/t-AML流病学与临床特征
t-MDS和t-AML均为髓系肿瘤,发生于不相关恶性疾病放疗和/化疗后,中位诊断年龄60岁,但可发生于任何年龄,是儿童恶性疾病治疗后最严重的迟发并发症。儿童接受包括高剂量烷化剂和拓普异构酶II抑制剂的标准实体瘤治疗时,t-MDS/t-AML累积发生率5%-11%,接受急性淋巴细胞白血病治疗时的发生率为1%-5%。
成人t-MDS/t-AML有二种发生模式:继发于烷化剂和/放疗,多发生于治疗4-7年后,多伴染色体5和7异常;继发于拓普异构酶II抑制剂,较早发生,多伴MLL畸变,且多为复杂核型的一部分。NGS研究显示30%成人t-MDS/t-AML携带TP53体突变,有助于更多细胞遗传学异常的发生且对化疗反应不佳。近期研究显示
乳腺癌治疗后发生t-MDS/t-AML的患者中,21%存在恶性疾病易感胚系突变,因此t-MDS/t-AML患者应注意胚系易感综合征。
t-MDS/t-AML治疗
t-MDS/t-AML治疗极具挑战性,治疗选择有限,异基因HSCT对生存最有益,单纯传统化疗诱导失败率很高,结果很差。CIBMTR和EBMT的大宗t-MDS/t-AML治疗研究中儿童和成人OS相似,约为35%。根据有限研究,Locatelli教授推荐t-MDS/t-AML患者应尽早HSCT,供者与受者免疫遗传学相容时不推荐T细胞去除。移植前强化疗的作用仍不清楚,但进展期儿童MDS HSCT结果显示,诱导化疗对BM原始细胞>20%的疾病治疗获益有限,移植后复发是治疗失败的主要原因,预后极差。二次移植对复发患者是一种治疗选择,但成功机会有限。
评论:成人和儿童MDS无论是形态学、细胞遗传学还是治疗均明显不同,患者除体突变不同外,还要注意遗传易感综合征,这直接影响治疗决择。然而因疾病的稀少性,未来还需要更多研究来明确儿童MDS的诊断与治疗。
来源:肿瘤资讯
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言

![]() 0
2018-03-21
点击查看
0
2018-03-21
点击查看

![]() 0
2018-03-22
点击查看
0
2018-03-22
点击查看

![]() 0
2018-03-23
点击查看
0
2018-03-23
点击查看

![]() 0
2018-03-24
点击查看
0
2018-03-24
点击查看
![]() 0
2018-03-25
点击查看
0
2018-03-25
点击查看

![]() 0
2018-03-27
点击查看
0
2018-03-27
点击查看
