癌症严重威胁人类健康,2022年全球约有2000万新增癌症病例和970万癌症相关死亡病例。尽管现有多种治疗方法,但由于癌症的复杂性,治疗效果有限。癌症干细胞(CSCs)被认为是导致癌症治疗失败的关键因素之一,它具有自我更新、分化和耐药等特性,能够促进肿瘤的发生、发展、转移和复发。因此,深入了解CSCs的耐药机制并开发针对性的治疗策略具有重要意义。
近日,四川大学华西医院Jing Jing教授与Yuanyuan Zhang教授在MedComm-Oncology联合发表了题为“Unraveling the underlying mechanisms of cancer stem cells in therapeutic resistance for optimizing treatment strategies”的综述文章。作为该期刊的2025年首期封面文章,该综述系统阐述了CSCs的产生机制、耐药机制以及当前针对CSCs的治疗策略,对推动癌症治疗领域的基础研究与临床实践发展具有重要的理论指导意义。

(ESCI新晋期刊,联合主编:Guido Kroemer教授 & 黄灿华教授)
CSCs的起源之谜
CSCs产生机制复杂,主要有三种途径。一是突变的多能成体干细胞,像BMI-1、Sonic hedgehog和Wnt等信号通路相关基因突变,会使成体干细胞转变为CSCs,乳腺癌中PIK3CA和AKT1基因的突变就是典型例子。二是非CSCs的去分化,辐射诱导的上皮-间质转化(EMT)可让非CSCs获得CSCs特性,多种癌症在放疗后都出现过这种情况。三是肿瘤微环境(TME)介导产生,TME中的细胞和成分,如肿瘤相关巨噬细胞、髓源性抑制细胞等,能促进CSCs的形成与维持。

Figure 1 癌症干细胞(CSCs)和干细胞(SCs)内突变相关信号通路。
CSCs耐药的“护盾”
CSCs对常规癌症治疗有很强的耐药性,主要通过多种机制实现。ABC转运蛋白可将化疗药物排出细胞,导致多药耐药。其次,CSCs的DNA损伤修复能力很强,能迅速修复放疗和化疗造成的损伤。在代谢方面,CSCs十分灵活,可根据环境在糖酵解和氧化磷酸化之间转换,以满足自身需求。同时,它还能抵抗氧化应激,增强抗氧化防御。此外,解毒ALDH酶的高表达,也帮助CSCs抵御化疗药物。

Figure 2 癌症干细胞(CSC)介导的癌症治疗耐药机制
针对CSCs的治疗策略探索
为攻克CSCs介导的治疗耐药性,研究人员从多方面探索治疗策略。在消除增殖的非CSCs方面,可靶向Annexin A2、Ki67等蛋白抑制癌细胞增殖,NY-ESO-1特异性T细胞受体等已展现一定潜力,但CAR-T细胞疗法对实体瘤效果欠佳。
消除CSCs可针对其特异性信号通路、表观基因组等。抑制TGF-β和PI3K/mTOR等信号通路,能改善化疗效果;调节CSC的表观基因组可增强其对治疗的敏感性;针对CSC微环境靶点和利用CSC标记物进行药物递送,也是消除CSCs的有效途径。
分化疗法通过诱导癌细胞成熟来降低肿瘤负担,如ATRA和ATO联合治疗急性早幼粒细胞白血病效果显著,在骨肉瘤治疗中PPARγ激动剂也有潜力。对于低分化肿瘤,联合疗法或单靶点多靶点策略更具优势,TKIs虽已用于低分化甲状腺癌治疗,但仍有问题需解决,低分化小细胞肺癌也在探索新疗法。
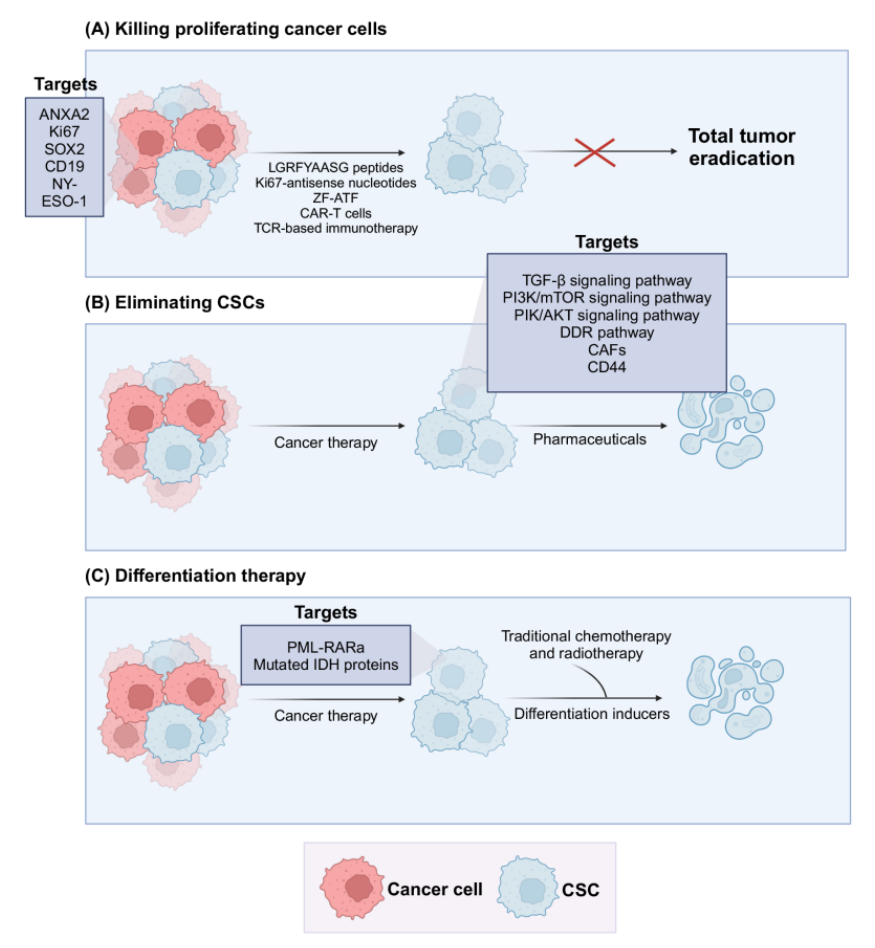
Figure 3 克服癌症干细胞(CSC)介导的治疗耐药性的潜在策略
未来挑战与展望
目前,针对CSCs的治疗面临诸多挑战,如靶向抗原的特异性、CSCs的精准识别等问题。不过,随着研究的深入,单细胞分析等技术的发展有助于发现CSC-特异性特征,减少治疗副作用。未来,还需进一步探究CSCs与免疫细胞的相互作用,开发更有效的治疗方法,为癌症患者带来更多希望。
阅读原文:
Tan Y, Qin S, Zhang Z, et al. Unraveling the underlying mechanisms of cancer stem cells in therapeutic resistance for optimizing treatment strategies. MedComm – Oncology. 2025; 4:e70009. doi:10.1002/mog2.70009