CART治疗MM
BCMA CAR T 细胞疗法是治疗多发性骨髓瘤的革新方法。《Blood》近日发表的一篇“Blood Spotlight(血液聚焦)”文章中,作者回顾了相关的临床和临床前数据,支持将CAR T纳入一线治疗和用于 T 细胞结合抗体之前。此外作者认为,通过基因组和表型分析评估 BCMA 表达和稳步改善早期诊断和副作用管理,以及快速、可扩展的 CAR T 细胞生产的发展(改善可及性),或可实现(BCMA)CAR T 细胞治愈多发性骨髓瘤的愿望。

BCMA CAR T的真实世界数据
idecabtagen vicleucel(ide-cel) 和 ciltacabtagen autoleucel(cilta-cel) 两种 BCMA CAR T 细胞产品的获批意味着多发性骨髓瘤 (MM) 细胞免疫治疗进入新时代。除了它们的关键研究,最近越来越多的长期临床随访数据、相关研究和真实世界证据增加了更广泛的视角,并强调了 BCMA CAR T 细胞疗法在 MM 中巨大的治疗潜力和目前的局限性(表1)。
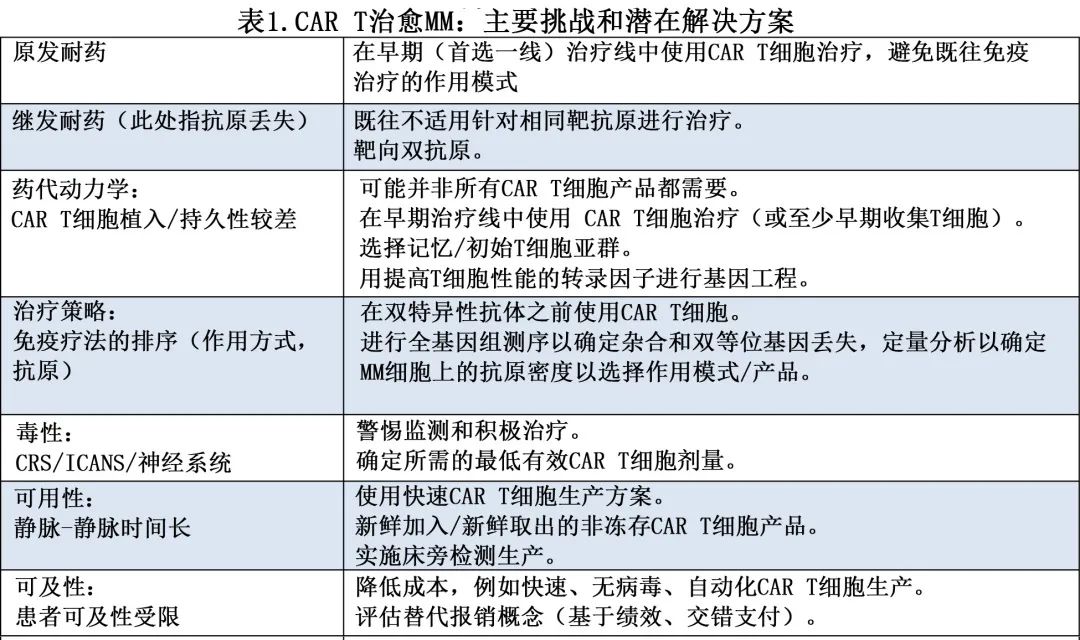
目前一个关键问题在于CAR T 细胞治疗和其他抗 MM 治疗的最佳排序,尤其是 T 细胞双特异性抗体 (BsAbs),其目的是发挥最大治疗作用,而这需要T细胞未终末耗尽和 MM 细胞未编辑(可减少或松散靶抗原表达)。初步研究结果表明,既往接受过抗 BCMA BsAbs的患者 (N=7) 接受cilta-cel给药后ORR为57.1%,PFS为5.3个月,而未接受过 BCMA 治疗的患者的 ORR 为98%,中位 PFS 未达到。一项来自美国的回顾性真实世界研究纳入196例接受单采治疗 ide-cel 的患者;患者接受过多线治疗,只有少数患者符合 KarMMa 关键研究的入选标准。无进展生存期 (PFS) 为8.5个月,而KarMMa关键研究(最佳剂量组)为11.3个月,非复发死亡率为5%。在多变量分析中,既往 BCMA 靶向治疗(尤其是BsAbs)与 BCMA CAR T 细胞治疗的较差结局相关(中位PFS 3.2 vs 9个月)。这些数据表明,既往接受过靶向BCMA(BsAbs teclistamab或elranatamab)对 BCMA CAR T 细胞的疗效具有负面影响,并且BsAbs后 CAR T 细胞治疗的排序为次优。另一方面,考虑到患者数量较少,在 CAR T 细胞治疗后使用BsAbs仅略微降低 ORR。
BCMA CAR T细胞治疗的患者选择
由于BsAbs的可用性和相对容易获得,CAR T细胞治疗的患者和产品选择仍具有挑战性,但最近相关报道较多。其中一个例子是虚弱,如果器官功能良好则不构成 CAR T 细胞治疗的障碍。事实上,有几项正在进行的研究在不适合自体移植的患者中评价 BCMA CAR T 细胞(例如CARTITUDE-5、NCT04923893);最近的一项研究甚至表明,CAR T细胞治疗在接受血液透析的患者中是可行的。但高危特征如 R-ISS 评分为3和髓外病变仍然是 MM 中 CAR T 细胞治疗的不良预后因素,因此如果没有有效的桥接和/或减瘤治疗,高度增殖性复发/难治性多发性骨髓瘤 (RRMM) 患者可能并非 CAR T 细胞治疗的良好候选者。静脉-静脉(即白细胞单采-CAR T 细胞输注)时间超过6-8周的情况尤其如此,导致这些患者的疾病控制具有挑战性。此外值得注意的是,制备失败率和不符合规范的 CAR T 细胞产品进一步加重了该问题。通过极短的离体培养和无病毒的新鲜加入/新鲜取出(fresh-in/fresh-out)生产,新一波改进的 CAR T 细胞生产方案可实现2-3周或更短的静脉-静脉时间,这些“快速”CAR T细胞产品的临床试验数据值得期待 (NCT05172596、NCT04935580、NCT04394650、NCT04499339)。异基因CAR T 细胞可作为现成产品提供,但在初步临床试验中的有效性相当令人失望,并劣于自体 CAR T 细胞,可能是由于 HLA 差异导致的免疫原性和基因编辑导致的遗传毒性。
BCMA CAR T细胞治疗的急慢性毒性
随着接受 BCMA CAR T 细胞治疗的患者数量增加,对急慢性毒性及其临床管理策略的更多见解也得到了推导。细胞因子释放综合征 (CRS) 高达80%,但已失去其“恐惧因子”,因为已确立了精细化的诊断和治疗策略,并且经验越来越多,尤其是在“高容量”CAR T细胞中心。噬血细胞性淋巴组织细胞增生症 (HLH) 是 BCMA CAR T 细胞治疗后的一种罕见并发症,如果管理不充分具有潜在致死性,铁蛋白迅速升高是关键实验室结果。结节病样发作(Sarcoidosis-like flare-up)是另一种与 CRS 相关的罕见疾病。MM 中 BCMA CAR T 细胞治疗后的常见挑战为感染,疾病相关免疫抑制后 MM 患者对感染易感;而CAR T 细胞输注前的清淋预处理、CRS期间 B 细胞和浆细胞的靶向识别及骨髓炎症进一步增加免疫系统的定量和定性缺陷。在 ASH 2022 会议上,Shambavi等人报告称,超过三分之一的患者在 CAR T 细胞治疗后2年未恢复血清IgM、外周血 T 细胞和 B 细胞,即使从 MM 中完全缓解。在 CAR T 细胞治疗前进行疫苗接种和静脉注射免疫球蛋白替代治疗有助于预防感染。
BCMA CAR T细胞治疗后最麻烦的副作用是多系血细胞减少。在许多患者中血细胞减少呈双相过程,CAR T细胞输注后早期出现第一个最低点(主要是由于清淋),CAR T细胞输注后约1个月出现第二个最低点(主要是由于靶向反应性和炎症)。因此,部分患者仍依赖输血或发生严重感染,从而否定了 MM 无治疗间期的获益。最近,Rejeski等介绍了评分系统CAR-HEMATOTOX,可评估接受 BCMA CAR T 细胞治疗的 RRMM 患者发生长期重度中性粒细胞减少症和重度感染的风险。除生长因子支持,应在长期血细胞减少患者中评价自体干细胞增强(autologous stem cell boost)的价值。
靶向BCMA免疫治疗后的神经毒性在机制上仍知之甚少。与 CD19 CAR T 细胞不同,BCMA CAR T细胞治疗后免疫效应细胞相关神经毒性综合征 (ICANS) 并不常见。然而在接受 BCMA CAR T 细胞的患者中,几种神经病理学不良事件的总发生率约为20%,包括头痛、震颤、轻度失语、精神状态改变伴注意力受损和意识模糊、失用症和嗜睡;较少见的有格林-巴利综合征、贝尔轻瘫等颅神经麻痹,可轻、也可危及生命。一个令人费解的副作用是运动和神经认知治疗中出现的不良事件 (MNT),约5%接受 cilta-cel 的患者发生MNT。最近的一项病例研究报告了一名出现帕金森样症状并最终死亡的患者的基底神经节和尾状核中弱表达BCMA。高肿瘤负荷和早期神经毒性患者在较晚的时间点有发生 MNT 的风险。在临床实践中,通过有效的桥接治疗、CRS和神经系统症状的警惕监测和治疗降低 MM 负荷,显著降低了晚期神经毒性的发生率。最近的一份病例报告提示环磷酰胺可能是治疗 MNT 的有效方法。总体而言,BCMA CAR-T 细胞治疗的临床试验中非复发死亡率低于5%,真实世界研究中为5-9%,不高于晚期 RRMM 中的常规化疗。
新出现的挑战:晚期治疗中BCMA CAR T细胞后复发
BCMA CAR T细胞疗法是有史以来引入临床的最强效抗 MM 疗法,然而大多数患者最终会复发,复发时MM细胞经常会出现靶抗原表达的获得性变化。针对替代抗原(如GPRC5D、FcRH5和SLAMF7)的 CAR T 细胞和BsAbs挽救治疗在临床前和早期临床试验中显示出良好疗效。MCARH109 是一种抗 GPRC5D CAR T 细胞产品,在 RRMM 患者中达到的 ORR 约为70%,无论患者既往是否接受过 BCMA 治疗。
BCMA 下调和丢失是 MM 逃避 CAR T 细胞和BsAbs的选择压力的关键机制。有许多导致 BCMA 缺失的基因组畸变,如纯合性缺失、缺失和突变,以及破坏 teclistamab 和 elranatamab 结合位点的单核苷酸变体 (SNV),该 SNV 在1例 ide-cel 原发性难治性患者中检测为种系变异。同样,GPRC5D-CAR T细胞治疗和 BsAbs 后的抗原丢失似乎是一种常见的耐药机制。目前尚未对 MM 中候选靶抗原的抗原丢失频率进行系统分析。当前研究的另一个重点为确定不同 CAR T 细胞产品和 BsAbs 进行识别和消除 MM 细胞所需的 BCMA 抗原密度阈值。既往报道已经表明,对于优化的CD19 CAR,这个阈值可以在几百个 CD19 分子的范围内,相关的临床数据支持这样的观点,即 CD19 表达高于某个阈值与实现和维持淋巴瘤缓解的可能性更高相关。因此,应将新型诊断工具(如全基因组测序和单分子敏感显微镜检查)应用于 MM 的临床病理学检查,以帮助患者分层和监测。
阐明有效治疗和复发的其他机制可为 CAR T 细胞和BsAbs的完善及其最佳临床使用提供信息。Lin 等人报告了 KarMMa 研究的相关数据,强调了与无应答患者相比,应答患者中 CAR T 细胞扩增更大。有趣的是,白细胞单采材料中较高比例的初始和早期记忆 CD4 T 细胞与CAR T 细胞扩增和应答相关。这些数据鼓励增强 CAR T 细胞性能的努力,例如通过表达支持植入、体内扩增和寿命的转录因子。MM 微环境也影响 T 细胞迁移和进入浆细胞肿瘤,Robinson 等人揭示了 MM 病灶内和空间异质性,同时存在可能受激动信号和 CD2-CD58 相互作用调节的富含 T 细胞和无 T 细胞微区。最近在髓内病变中描述了 T 细胞库和巨噬细胞含量的变化,并加强了人们对调节 MM 微环境有利于 CAR T 细胞性能的兴趣。
新机会:在早期治疗中使用CAR T细胞治愈骨髓瘤?
两项随机研究报告了 BCMA CAR T 细胞治疗与标准治疗在早期治疗线中的结局。KarMMa-3 研究将既往接受过2-4线治疗的达雷妥尤单抗难治性 RRMM 患者(大多数也是 IMID 难治性患者)随机分配至接受 ide-cel 或标准治疗。中位随访18.6个月,ide-cel组的中位无进展生存期为13.3个月,标准治疗组为4.4个月。在 CARTITUDE-4 中,既往接受过1-3线治疗的来那度胺难治性 MM 患者随机接受 cilta-cel 或标准治疗。中位随访15.9个月,cilta-cel组未达到中位无进展生存期,而标准治疗组为11.8个月。因此,可以确信 BCMA CAR T 细胞治疗应该并且将成为 MM 一线治疗的新基石,有可能治愈相当一部分患者(图1)。目前正在进行几项评价一线治疗中 BCMA CAR T 细胞和BsAbs 的临床试验,以解决一线治疗中的诱导(例如NCT05695508)、巩固(例如NCT05257083)和维持 (NCT05243797) 问题。

仍有待实现的一个主要目标在于扩大和促进患者获得 CAR T 细胞治疗。在撰写本报告时,ide-cel在5个国家(美国、法国、瑞士、日本、德国)可用并报销,cilta-cel仅在两个国家(美国、德国)报销。可扩展的无病毒自动化制造的进步将进一步增加可用产品的数量,而床旁制造是缩短静脉-静脉时间、降低成本和让临床研究中心参与工作流程和价值化的另一个关键杠杆。最后,重新审视一次性报销计划,倾向于基线支付加基于表现的分期,有助于医疗保健支付方的接受,并使 CAR T 细胞世界地图上空白的国家能够获得患者。
参考文献
Rasche L,et al. CAR T-Cell Therapy in Multiple Myeloma: Mission Accomplished?Blood . 2023 Nov 30:blood.2023021221. doi: 10.1182/blood.2023021221.
Ann Hematol:邱录贵/安刚教授团队探索免疫表型在NDMM细胞遗传学稳定性和风险分层中的作用
![]() 0
2023-12-08
点击查看
0
2023-12-08
点击查看

STTT:陈硕/陈赛娟/范晓虎揭示抗原诱导CAR多聚化增强抗肿瘤效应的结构机制
![]() 0
2023-12-14
点击查看
0
2023-12-14
点击查看

Blood Cancer Journal:新诊断的多发性骨髓瘤患者的肌肉和脂肪组成
![]() 0
2023-12-14
点击查看
0
2023-12-14
点击查看

【BCJ】466例CD38单抗难治性多发性骨髓瘤患者的真实世界治疗模式和结局
![]() 0
2023-12-18
点击查看
0
2023-12-18
点击查看

【ASH继续教育】功能性高危多发性骨髓瘤的特征和治疗
![]() 0
2023-12-20
点击查看
0
2023-12-20
点击查看

Cell Metabolism:中南大学周文/贺艳娟/陈翔等合作发现改善骨髓瘤硼替佐米耐药性的潜在新策略
![]() 0
2023-12-20
点击查看
0
2023-12-20
点击查看
