7月4日,盐野义(Shionogi)及其与中国平安人寿保险股份有限公司的合资公司平安盐野义共同宣布,就新型冠状病毒肺炎(COVID-19)口服抗病毒药物3CL蛋白酶抑制剂S-217622(ensitrelvir,恩司特韦)开始准备提交国内新药上市许可申请的相关资料。
平安盐野义宣称,在正式提交新药上市许可申请前,已就S-217622向CDE提交沟通交流会议申请,以促进本品将来的新药上市许可申请进程。
S-217622(ensitrelvir )是北海道大学和盐野义联合开发的一款口服3CL蛋白酶抑制剂,其作用机制与辉瑞获得批准的COVID-19药物Paxlovid相同。2月,盐野义曾公布S-217622的II/III期临床试验IIa期部分数据。结果显示,在抗病毒方面,与安慰剂组相比,S-217622组能够实现病毒滴度和病毒RNA的迅速下降。见:日本盐野义口服新冠病毒治疗药物Ensitrelvir(S-217622),治愈率达100%
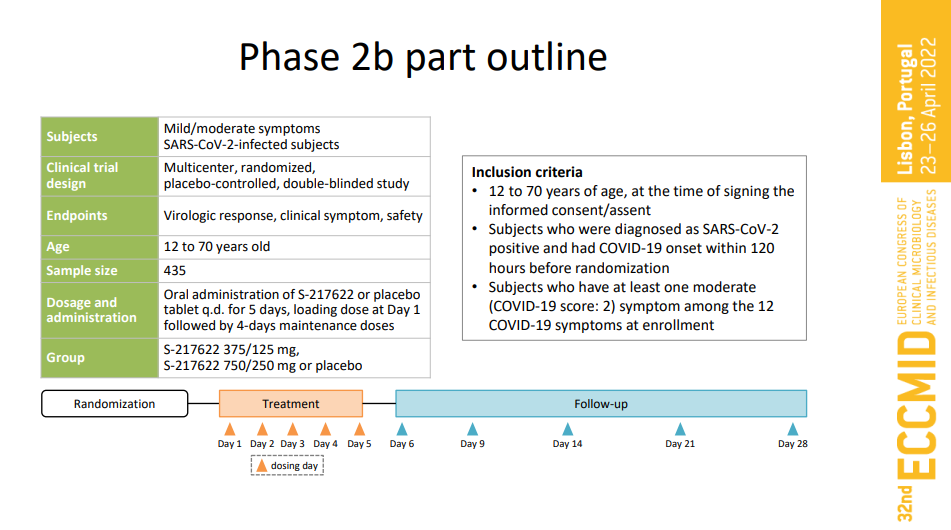
该II/III期研究主要评估S-217622作为COVID-19的治疗药物的疗效和安全性。IIb期研究在日本和韩国招募了428名患者,随机接受安慰剂和S-217622的高低两种剂量治疗。主要目的是确认S-217622与安慰剂相比,每天一次口服给药5天后的抗病毒效果和临床症状改善。
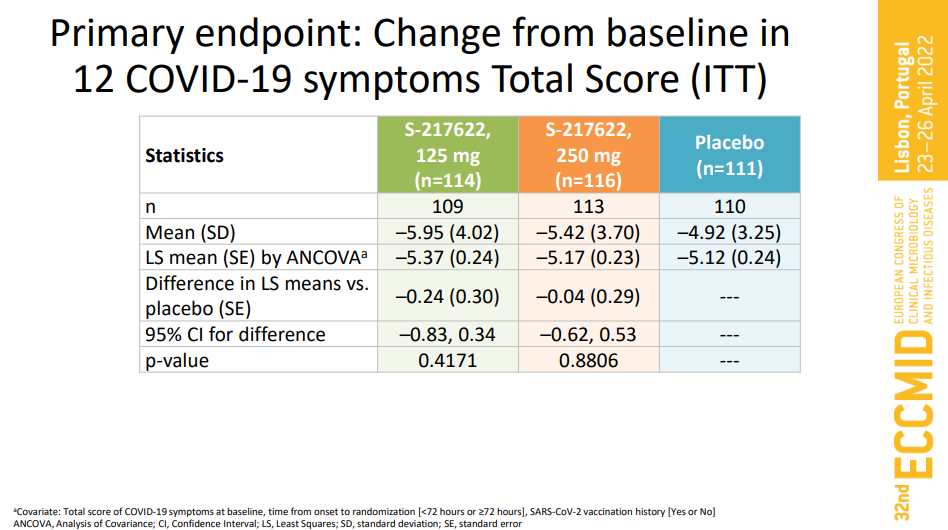
4月23日,在第32届欧洲临床微生物学和传染病大会 (ECCMID) 上,盐野义公布了S-217622 的II/III期临床试验IIb期关键数据。结果显示,S-217622表现出对传染性SARS-CoV-2病毒的快速清除。与安慰剂相比,S-217622在第2、4、6和9天显示病毒RNA显著减少;在治疗的第四天(第三剂之后),病毒滴度阳性的患者比例与安慰剂相比减少了约 90%。与安慰剂相比,S-217622 将传染性病毒的脱落时间缩短了1-2 天。而在症状改善上面,12种COVID-19症状的总分没有显著差异,但事后分析显示S-217622在5种“呼吸和发烧”症状的综合评分有所改善。

安全性方面,II/III期临床试验的I期和IIa/b部分均显示S-217622具有良好的耐受性,很少因药物停药,也没有严重不良事件或死亡的报告。治疗中出现的不良事件通常为轻度至中度,无需治疗即可解决。
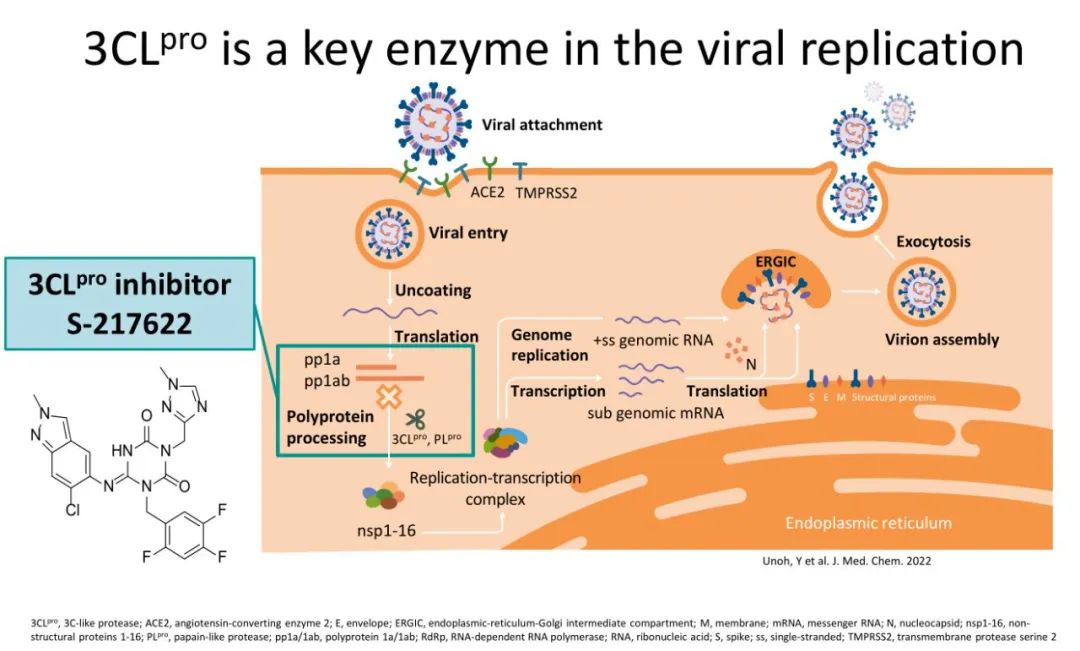
3-胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease,3CLpro),也称3C样蛋白酶或主要蛋白酶 (Mpro),是在冠状病毒中发现的主要蛋白酶。辉瑞Paxlovid凭借EPIC-HR研究获得监管机构批准,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者。EPIC-HR研究成为Paxlovid的“封神”之作,显示将COVID-19相关的住院或因任何原因死亡的风险降低了近90%。同时,也让3CL靶点声名大噪,促使国内外多家企业开始积极布局。
令人遗憾的是,随着奥密克戎的全球大流行,辉瑞3CL蛋白酶抑制剂Paxlovid近期在针对标准风险(EPIC-SR)和暴露后预防(EPIC-PEP)两项III期临床研究中接连失利。如今,加上S-217622被日本监管机构推迟批准,对于火热的3CL赛道增添了诸多不确定因素。同时,EPIC-SR研究的失利,也打消了S-217622针对严重并发症危险因素患者研究(SCORPIO-SR)的部分期待。
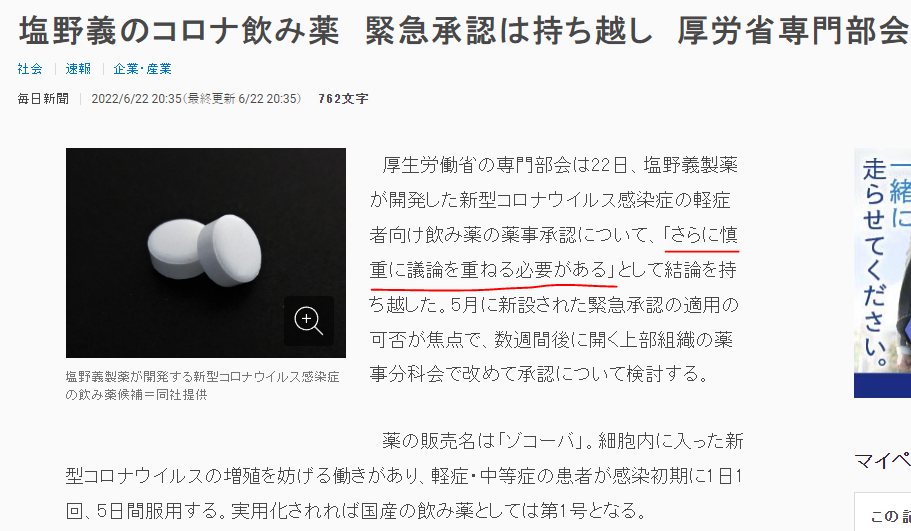
此前,盐野义曾基于一项II/III期研究在日本提交紧急授权使用申请。6月22日,盐野义基于II期数据提交的S-217622紧急授权申请被日本PMDA暂缓批准,称“需要进行更仔细的讨论”。
S-217622 目前仍在开展两项全球III期临床研究,旨在在全球范围内招募参与者,以支持上市的监管备案。
