2022年03月11日,中国国家药监局(NMPA)官网最新公示, 抗CD19单克隆抗体伊奈利珠单抗(inebilizumab)获批上市用于治疗视神经脊髓炎谱系疾病(NMOSD)患者。
伊奈利珠单抗(inebilizumab,Uplizna)是一款 由Viela Bio(已被Horizon Therapeutics收购)开发的对CD19具有高度亲和力的人源化单克隆抗体,通过与CD19抗原结合,可以迅速将这些细胞从血循环中清除,从而降低自身抗体的产生,进而达到改善患者症状的目的。CD19是在B细胞癌症中广泛表达的抗原,它能够增强B细胞受体介导的信号通路,支持B细胞生存,是靶向B细胞癌症的重要靶点。研究显示,CD19表达在多类B细胞上,其中包括分泌抗体的成浆细胞和浆细胞。
国内首款 CD19 单抗,Inebilizumab 是一款对 CD19 具有高度亲和力的人源化单克隆抗体。目前,国内尚未有 CD19 单抗获批上市,Inebilizumab 为国内首款、也是当前唯一一款报上市的 CD19 单抗。
2019 年 2 月,Inebilizumab 获得了美国 FDA 授予的突破性疗法认定,并获得孤儿药资格,治疗罕见自身免疫疾病视神经脊髓炎谱系障碍(NMOSD)。2020 年 6 月,Inebilizumab 获 FDA 批准上市,商品名为 Uplizna。
2019 年 5 月 28 日,豪森药业与 Viela Bio 达成了战略合作,在中国开发 Inebilizumab 治疗 NMOSD 以及其他潜在的炎症/自身免疫和血液学恶性肿瘤适应症。根据协议条款,Viela Bio 有资格获得一笔前期合作费用和超过 2.2 亿美元的里程碑付款,以及基于产品净销售的分层版税,豪森药业则负责领导在中国开发和商业化 Inebilizumab。
Inebilizumab 全球适应症开发进度
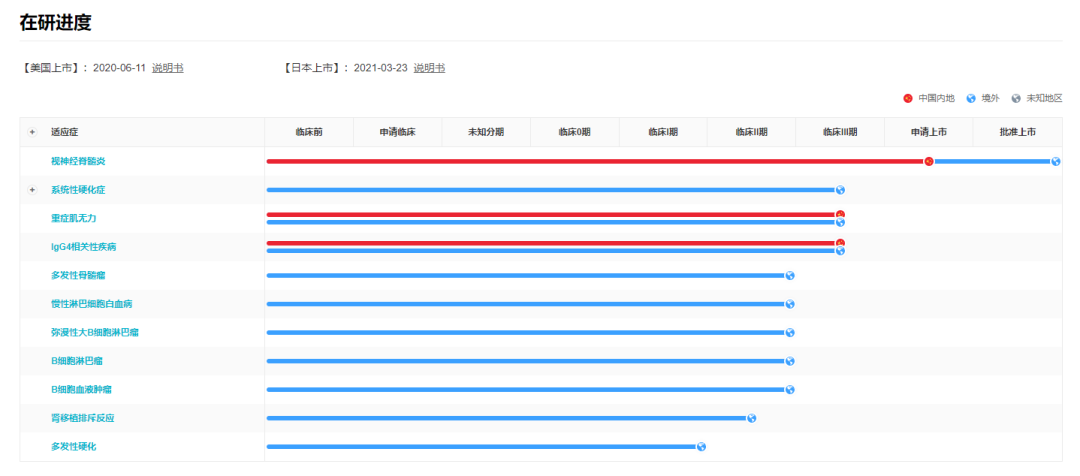 Inebilizumab 是 FDA 批准的第二款 NMOSD 治疗药物。目前,该疾病领域 FDA 已批准三款抗体药,另外两款分别为 Alexion 公司的 C5 抗体依库珠单抗(Eculizumab,商品名 Soliris)和罗氏的 IL-6 单抗萨特利珠单抗(Satralizumab),前者在国内尚未获批 NMOSD 适应症,后者于 2021 年 4 月在国内获批上市,商品名为安适平。
Inebilizumab 是 FDA 批准的第二款 NMOSD 治疗药物。目前,该疾病领域 FDA 已批准三款抗体药,另外两款分别为 Alexion 公司的 C5 抗体依库珠单抗(Eculizumab,商品名 Soliris)和罗氏的 IL-6 单抗萨特利珠单抗(Satralizumab),前者在国内尚未获批 NMOSD 适应症,后者于 2021 年 4 月在国内获批上市,商品名为安适平。
NMOSD 是一种罕见、严重、复发性的神经炎症性自身免疫疾病,以视神经和脊髓的炎性病变为特征。2018 年 5 月被纳入国家 121 种罕见病目录。NMOSD 全球总患病率为 1.82/10 万,多见于亚洲患者,发病时平均年龄为 32.6-45.7 岁,且女性多发。患者时刻担心疾病复发,每次复发都可能会让他们丧失视觉、行动能力甚至生命,给患者及家庭带来极大的经济负担和心理负担。
Inebilizumab 在美国上市基于一项评估 Uplizna 疗效和安全性的 N-MOmentum 临床试验。该试验入组 230 位成年患者,其中有 213 名患者呈抗 AQP4 抗体阳性。为期 197 天的研究显示,与安慰剂治疗组相比,接受 Uplizna 治疗的 161 名抗 AQP4 抗体阳性患者的 NMOSD 复发风险降低了 77%。
NEJM:Eculizumab治疗可降低AQP4-IgG阳性的NMOSD患者复发风险
![]() 0
2019-08-15
点击查看
0
2019-08-15
点击查看
Lancet:Inebilizumab可降低视神经脊髓炎谱系疾病 (NMOSD)发作风险
![]() 0
2019-09-06
点击查看
0
2019-09-06
点击查看
NEJM:Satralizumab治疗视神经脊髓炎谱系疾病的SAkuraSky III期研究取得喜人结果
![]() 0
2019-11-30
点击查看
0
2019-11-30
点击查看

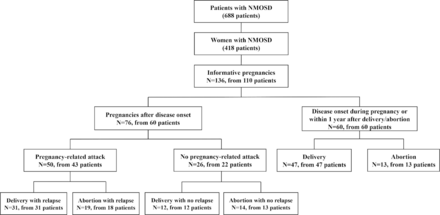
JNNP:视神经脊髓炎谱系疾病:与妊娠有关的发作和预测危险因素
![]() 0
2020-11-29
点击查看
0
2020-11-29
点击查看
Lancet Neurology:托珠单抗与硫唑嘌呤治疗高度复发性视神经脊髓炎频谱障碍(TANGO)的安全性和有效性:一项开放性、多中心、随机、2期试验
![]() 0
2020-12-24
点击查看
0
2020-12-24
点击查看

Radiology:视神经脊髓炎谱系疾病的新角度:从影像走向临床
![]() 0
2021-07-20
点击查看
0
2021-07-20
点击查看
