改善实体瘤疗效是嵌合抗原受体T细胞(CAR-T)疗法面临的主要挑战之一,特别是胃肠道肿瘤。Claudin18.2(CLDN18.2)靶点的表达谱具有一定特性,尤其在胃肠道肿瘤中高表达,是广受临床关注的希望靶点之一。目前,已有多款靶向Claudin18.2的创新药物正在被开发,包括单克隆抗体、双特异性抗体和抗体偶联药物(ADC)等。
CT041/satricabtagene autoleucel(satri-cel)是一种CLDN18.2特异性CAR-T细胞疗法,此前已被证实其表达出具有希望的应答率且安全性可控。近期,《自然-医学》(Nature Medicine)发表satri-cel的一项1期研究最终结果,表明对于CLDN18.2阳性胃肠道癌患者而言,CAR-T细胞疗法显示出相当的治疗潜力和可控的安全性,该研究患者总缓解率和疾病控制率分别为38.8%和91.8%,中位无进展生存期和总生存期分别为4.4个月和8.8个月。

截图来源:Nature Medicine
这是一项单臂、开放标签、1期临床试验。研究人员设计了“3+3”改良剂量递增/递减,其中89例患者输注了2.5×108CAR-T细胞,6例患者输注了3.75×108CAR-T细胞,3例患者输注了5.0×108CAR-T细胞,确定推荐剂量后,在此基础上进行剂量扩展,剂量扩展阶段研究人员将患者分为4个队列,具体为:
队列1:satri-cel单药治疗(61例标准化疗难治性胃肠道癌患者);
队列2:satri-cel+抗PD-1治疗(15例标准化疗难治性胃肠道癌患者);
队列3:satri-cel作为一线治疗后的序贯治疗策略(5例胃肠道癌患者);
队列4:satri-cel单药治疗(2例抗CLDN18.2单克隆抗体难治性胃肠道癌患者)。
共有98例患者至少接受了一次satri-cel输注。截至2024年1月26日,中位随访时间为32.4个月,最长随访时间为41.0个月,12.2%(12/98)患者仍存活,无一例患者失访。
主要研究终点为输注后的安全性和耐受性。在剂量递增/递减阶段,研究人员未观察到输注后28天出现预先定义的剂量限制性毒性,也未观察到长期并发症。98例患者均未发生不良事件,无治疗相关死亡或免疫效应细胞相关神经毒性综合征。96.9%的患者发生了细胞因子释放综合征,均为1~2级,8例患者有胃黏膜损伤。
疗效方面,98例患者的总缓解率和疾病控制率分别为38.8%和91.8%,中位无进展生存期和总生存期分别为4.4个月和8.8个月。
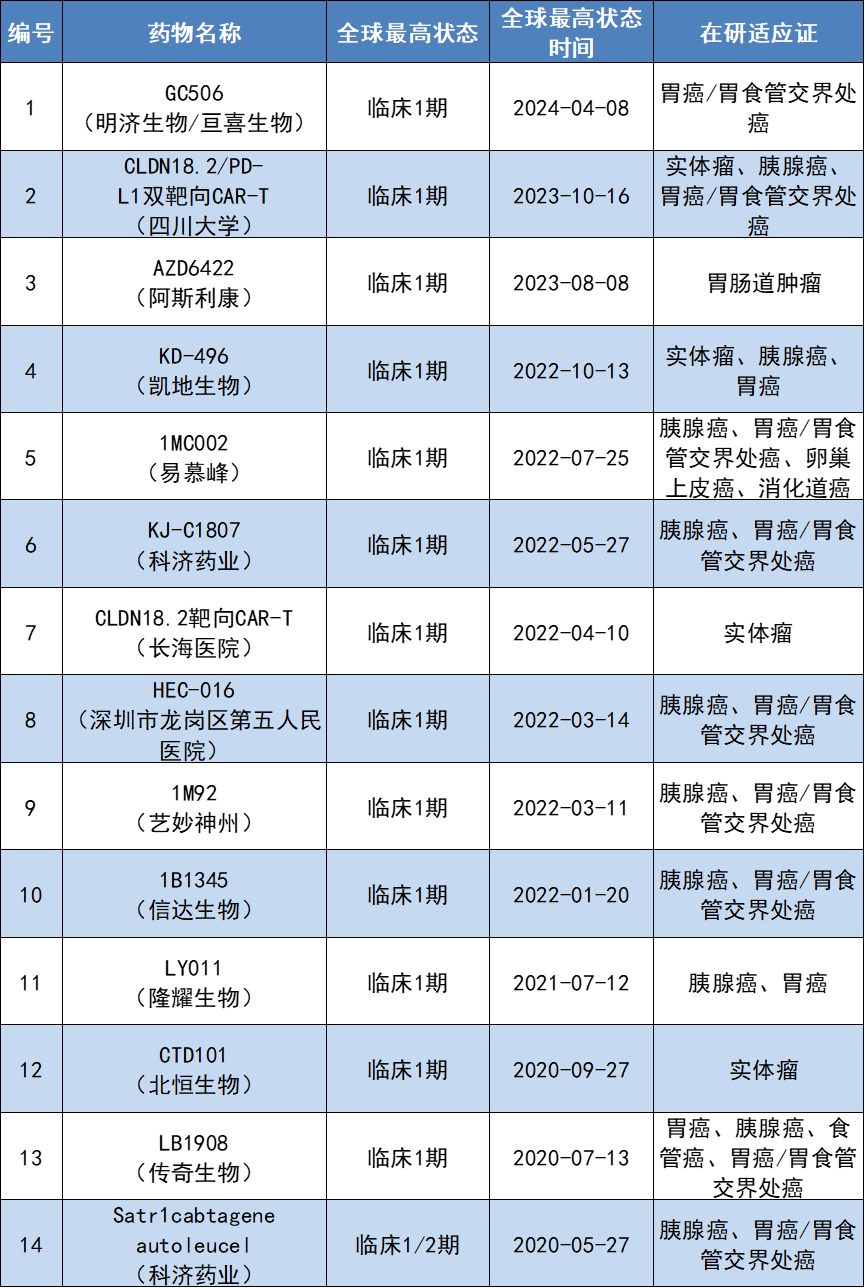
事实上,目前已有多项靶向CLDN18.2的CAR-T疗法正在进行中。据公开资料统计,目前处于活跃研发状态的临床1期或1/2期新药共有14款。期待相关研究早日进入临床关键阶段,造福更多患者。
参考资料
[1] Qi, C., Liu, C., Gong, J. et al. Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial final results. Nat Med (2024). https://doi.org/10.1038/s41591-024-03037-z
JCO | 阿达格拉西布在携带KRASG12C突变的晚期实体瘤中的应用
![]() 0
2024-03-08
点击查看
0
2024-03-08
点击查看

疾病控制率达73%!《自然》子刊:CAR-T疗法有望“攻克”实体瘤,关键在这两大策略!
![]() 0
2024-03-12
点击查看
0
2024-03-12
点击查看
CLIN CANCER RES | Debio 1347在携带FGFR融合阳性的晚期实体瘤患者中的II期篮子试验
![]() 0
2024-05-25
点击查看
0
2024-05-25
点击查看

2024ASCO|I/II 期临床试验:靶向 B7H3 新型 ADC MHB088C 在复发或转移性实体瘤患者的安全性和疗效结果
![]() 0
2024-05-28
点击查看
0
2024-05-28
点击查看

汇总:TILs治疗实体瘤效果显著:肺癌、肝癌、结肠癌、宫颈癌、卵巢癌
![]() 0
2024-06-07
点击查看
0
2024-06-07
点击查看
绘真约大咖 | 朱晓静教授:实体瘤MRD检测应注意哪些事项?如何解读MRD报告,实现患者获益?
![]() 0
2024-06-22
点击查看
0
2024-06-22
点击查看
