大肠杆菌是人和动物肠道内的一种寄生菌,是否致病主要看大肠杆菌的类型。从结构上来说,大肠杆菌具有两个截然不同的膜:内膜和外膜。内膜是磷脂双分子层,而外膜是不对称的,单层磷脂形成内表面,脂多糖(LPS)衬在外表面上。LPS可以保护大肠杆菌免受哺乳动物宿主肠道中的抗生素伤害。磷脂与LPS的比例对于膜功能至关重要,LPS过多对内膜有害,过少又会损害外膜。
长期以来,负责调节LPS生物合成的反馈信号一直是科学界的未解之谜,到底是LPS本身,还是其前体之一?现在,这个问题已经有了答案。
8月12日,来自美国基因泰克公司的研究人员在《Nature》杂志上发表了他们的研究成果:内膜蛋白PbgA就是人们苦苦寻找的LPS信号转导子,它的消耗通过降低LPS的水平和外膜完整性来减弱大肠杆菌的毒性。

https://doi.org/10.1038/s41586-020-2597-x
具体而言,研究人员首先证明了PbgA对于外膜完整性的重要性。他们发现,尿路致病性大肠杆菌pbgA缺失(ΔpgbA)菌株含有抑制突变,而在质粒上重新引入pbgA后,大肠杆菌对血清和抗生素利福平的敏感性得到恢复,这表明pbgA必不可少。

PbgA对于外膜的完整性至关重要
值得注意的是,与先前PbgA充当心磷脂转运蛋白的主张相反,本研究证明,PbgA与任何已知的转运蛋白均无关。接下来,研究人员利用一种称为X射线晶体学的技术,分析了1.9?ngstr?ms的PbgA结构。他们发现,PbgA属于一种酶家族,而全长PbgA的结构与EptA最相似——一种在LPS 17的脂质A结构域中添加磷脂衍生的分子修饰的蛋白质。通过修饰这些磷酸基团,EptA为细胞提供了对与脂质A结合的抗生素(多粘菌素)的抗性。
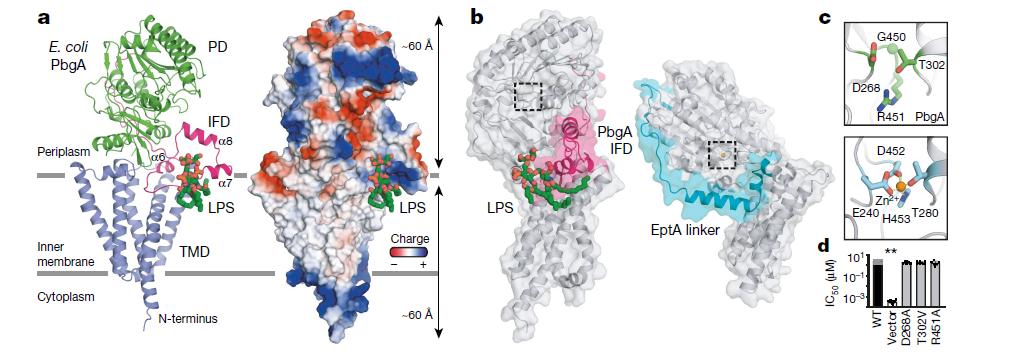
PbgA结构特征
研究人员还发现,PbgA通过接头结构域与脂质A部分结合,而使用的氨基酸序列在任何其他LPS结合蛋白中均未见报道,该LPS结合基序中的突变会破坏PbgA功能。在最后一组实验中,研究人员证明了基于该序列的合成肽可以结合LPS并抑制多种革兰氏阴性细菌(包括多粘菌素抗性菌株)的生长。通过合理的设计,他们改善了该肽的抗生素谱和效力。
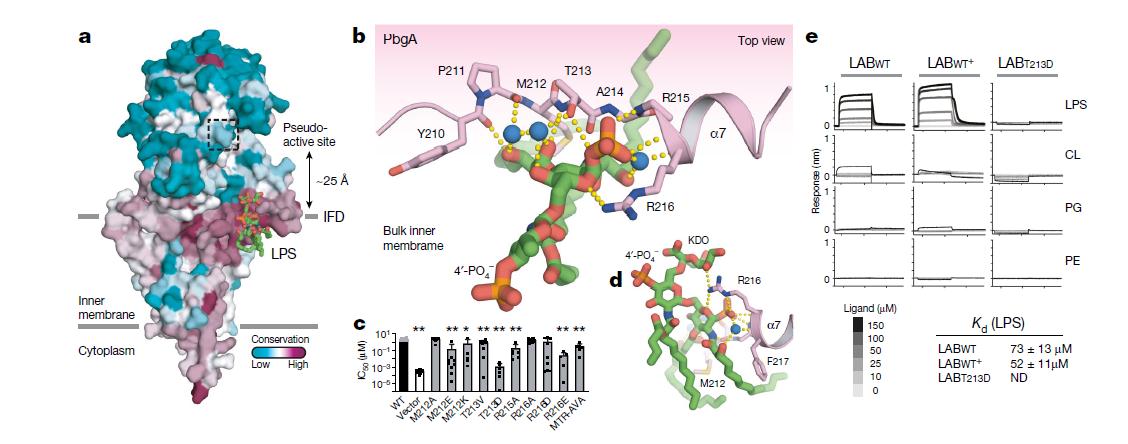
PbgA的周质脂质A结合基序
最后,研究人员阐明了LPS如何控制自身合成:内膜上的PbgA通过与LapB相互作用来调节抗菌酶LpxC的活性,LapB是一种指导酶FtsH降解LpxC的蛋白质。因此,当LPS水平较低时,PbgA会抑制内膜中LapB和FtsH之间的相互作用,从而稳定LpxC并促进LPS生物合成;当LPS分子的数量超过外膜的阈值时,LPS的传输就会停止。
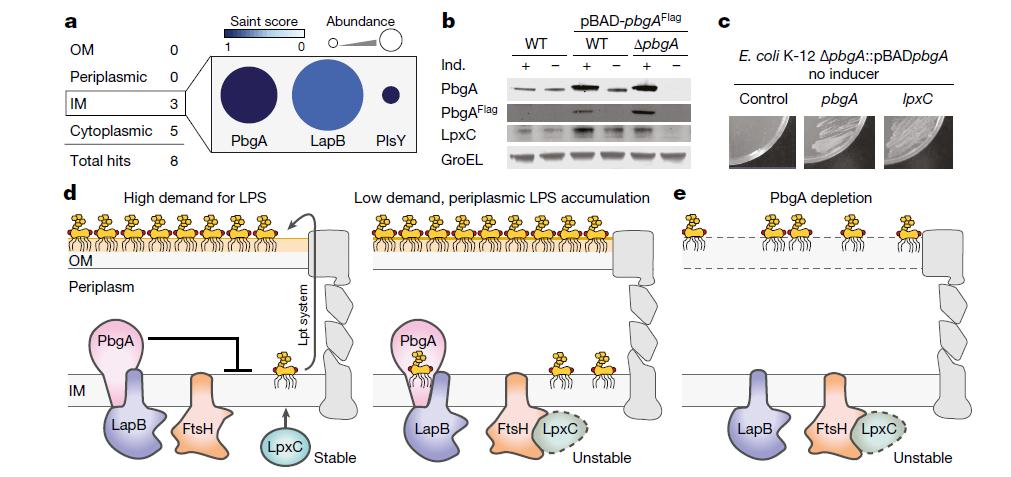
PbgA检测周质LPS水平以调节LpxC稳定性
总结来说,这项研究通过提供与LPS结合的蛋白质的高分辨率结构,扩展了我们对PbgA的理解,同时证明了PbgA是LPS信号转导物。除了阐明细菌膜中显着的脂质平衡作用外,这项研究为开发抗生素提供了新的见解。
原始出处:
Thomas Clairfeuille, Kerry R. Buchholz, Steven T. Rutherford, et.al. Structure of the essential inner membrane lipopolysaccharide–PbgA complex. Nature 12 August 2020