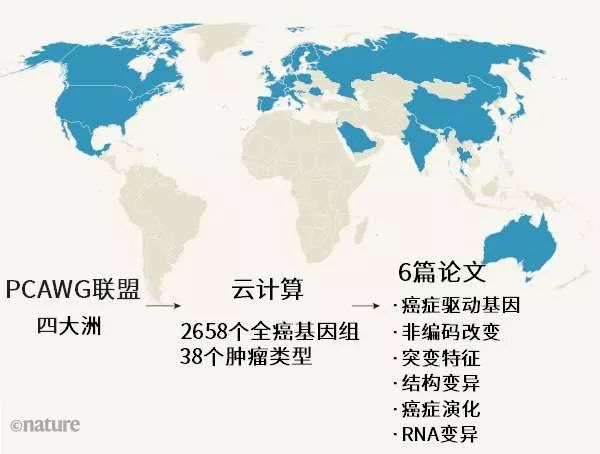
Diabetologia:1988-2015年美国糖尿病患者与非糖尿病患者的癌症死亡率趋势
![]() 0
2020-01-30
点击查看
0
2020-01-30
点击查看

自然·癌症:饿几天,就能增强癌症患者得免疫治疗效果
![]() 0
2020-02-04
点击查看
0
2020-02-04
点击查看
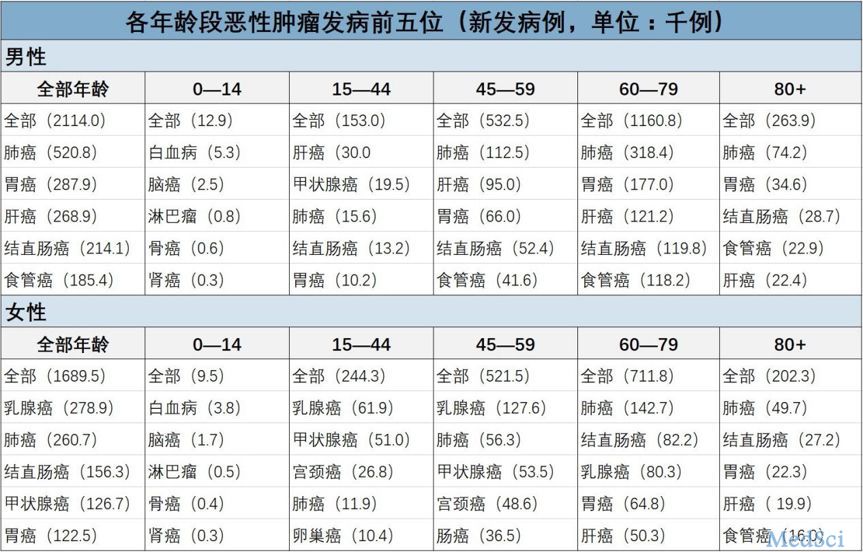
Brit J Cancer:生活方式与癌症发病率和死亡率
![]() 0
2020-02-10
点击查看
0
2020-02-10
点击查看

Carl Juno团队发表在Science上的新研究表明,CRISPR基因编辑后的T细胞在癌症患者中可存活数月
![]() 0
2020-02-11
点击查看
0
2020-02-11
点击查看

J Clin Oncol:2020年ASCO临床肿瘤学年度进展报告
![]() 0
2020-02-12
点击查看
0
2020-02-12
点击查看

Nat Genet:病毒DNA测序助理开发下一代癌症疫苗
![]() 0
2020-02-13
点击查看
0
2020-02-13
点击查看
