iNature
新皮层由大量不同的神经元组成,它们在单细胞分辨率下形成不同的层和复杂的回路,以支持复杂的大脑功能。不同的细胞表面分子被认为是定义神经元身份的关键,它们在结构和功能组织中介导神经元之间的相互作用。然而,控制新皮层精细神经元组织的精确机制在很大程度上仍然不清楚。
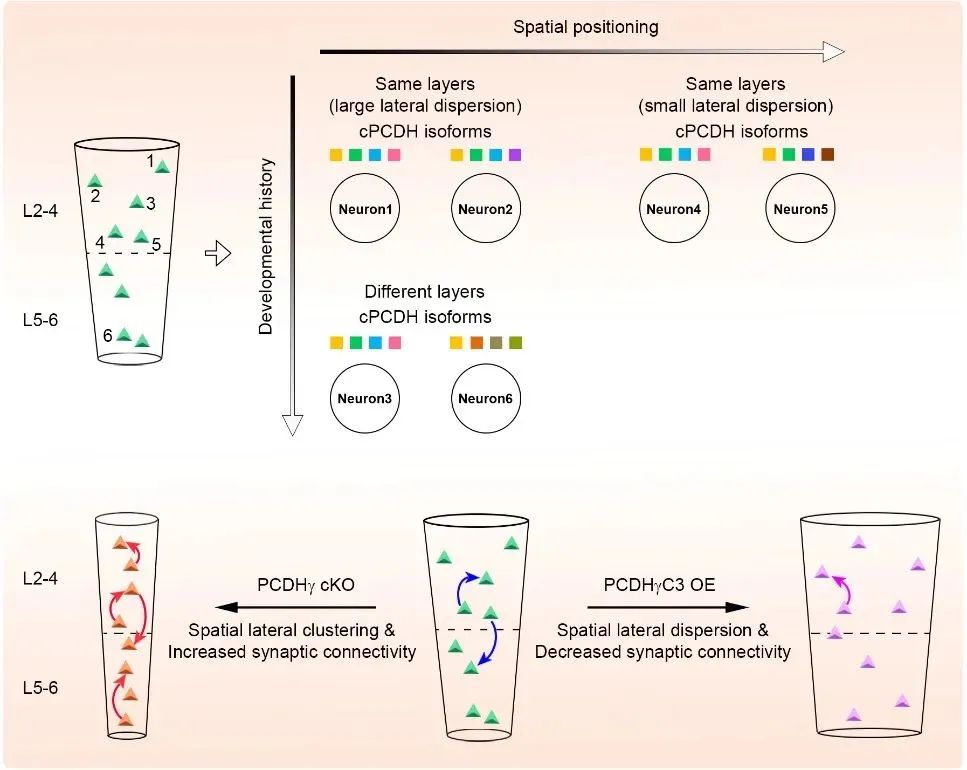
2022年12月7日,清华大学时松海团队在Nature 在线发表题为“Patterned cPCDH expression regulates the fine organization of the neocortex”的研究论文,该研究表明模式化的cPCDH表达能够调节新皮层的精细组织。该研究通过整合深入的单细胞RNA测序分析、祖细胞谱系标记和马赛克功能分析,作者报告了集簇性原钙粘蛋白(cPCDHs)的多样化但有模式的表达-细胞粘附分子钙粘蛋白超家族的最大亚群-调节小鼠新皮层兴奋性神经元的精确空间排列和突触连通性。
cPcdh基因在个体新皮层兴奋性神经元中的表达是多样化的,但表现出与其发育起源和空间定位相关的独特组成模式。功能性cPCDH表达的降低导致来自同一神经祖细胞的克隆相关兴奋性神经元的横向聚类和突触连通性的显著增加。相比之下,单一cPCDH亚型的过表达导致克隆相关兴奋性神经元的横向分散和突触连通性的显著降低。这些结果表明cPCDH表达模式偏向于哺乳动物大脑中单个新皮层兴奋性神经元的空间和功能组织。
另外,2022年12月8日,上海交通大学郭益平,澳大利亚卧龙岗大学张树君及上海硅酸盐研究所傅正钱共同通讯在Science 杂志在线发表题为“Giant electric field–induced strain in lead-free piezoceramics”的研究文章,该研究用常规的固相反应方法合成了不经过任何后处理的锶(Sr)掺杂(K,Na)NbO3无铅压电陶瓷,获得了巨大的应变(1.05%)和大信号的压电应变系数(2100 picometer/volt)。产生超高电应变的基本机制是缺陷偶极子和畴开关之间的相互作用。在20千伏/厘米下的抗疲劳性能、热稳定性和应变值(0.25%)与商用Pb(Zr,Ti)O3基陶瓷相当或更好,显示出巨大的实际应用潜力。这种材料可能为压电驱动器提供一种简单的无铅替代品,并为高性能压电设计提供了一种范例。
2022年12月8日,中国科学院西北生态环境资源研究院苗运法研究组、中国科学院青藏高原研究所方小敏研究组与中山大学黄康有研究组合作,在Science 杂志在线发表题为“A new biologic paleoaltimetry indicating Late Miocene rapid uplift of northern Tibet Plateau”的研究文章,该研究利用山地针叶树(Tsuga、Podocarpus、Abies和Picea)的花粉记录作为新的古高程测量方法,在NTP中中新世[~ 1500万年前(Ma)]分别在1332±189 m和433±189 m处构建了两个平行的中程古高程序列。两个中程在晚中新世(~11 Ma)东部迅速上升至3685±87 m,在~7 Ma西部迅速上升至3589±62 m。研究估计在15 - 7ma期间NTP东部和西部的上升,以及TP其他地区的数据表明,晚中新世整个高原可能已经达到接近今天的高海拔,从而对大气降水和高山生物多样性产生了影响。
2022年12月8日,清华大学孟安明课题组在Cell 杂志在线发表题为“Comprehensive maturity of nuclear pore complexes regulates zygotic genome activation”的研究论文,该研究利用斑马鱼模型,研究了NPCs的组成、结构和功能的动态变化,母体TFs的核转运及其与早期胚胎发生ZGA的相关性。研究发现,核孔复合体综合成熟度(comprehensive NPC maturity,CNM)主要与NPCs平均大小、NPCs组成和NPCs渗透性有关,它控制着母体TF的核转运和ZGA分子时钟。
2022年12月7日,武汉大学严欢、中国科学院生物物理研究所王祥喜、美国华盛顿大学David Veesler共同通讯在Nature在线发表题为“Close relatives of MERS-CoV in bats use ACE2 as their functional receptors”的研究论文,该研究表明蝙蝠MERS相关冠状病毒使用ACE2为功能性受体。该研究发现NeoCoV及其近亲PDF-2180可以有效结合并使用特定的蝙蝠血管紧张素转换酶2 (ACE2)同源物,以及人类ACE2作为进入受体,通过刺突(S)蛋白上的受体结合域(RBDs)。冷冻电镜分析显示,RBD-ACE2结合界面涉及蛋白质-聚糖相互作用,与其他已知的使用ACE2的冠状病毒不同。作者鉴定了人类ACE2的337-342残基作为限制NeoCoV进入的分子决定因素,而含有T510F RBD突变的NeoCoV S伪型病毒有效地进入了表达人类ACE2的细胞。虽然SARS-CoV-2多克隆抗体或MERS-CoV RBDs特异性纳米体不能交叉中和NeoCoV或PDF-2180,但一种ACE2特异性抗体和两种广泛中和β冠状病毒抗体可有效抑制这两种伪型病毒。总之,该研究描述了使用ACE2作为进入受体的MERS- CoV相关病毒,强调了受体使用的混杂性和潜在的人畜共患威胁(点击阅读)。
2022年12月7日,南京大学张彬彬课题组与美国内华达大学拉斯维加斯分校张冰课题组合作在Nature 杂志在线发表题为“A long-duration gamma-ray burst with a peculiar origin”的研究论文,该研究报道了一个特殊的长时间爆发,GRB 211211A,它的快速发射特性在许多方面不同于所有已知的I型GRB,但它的多波段观测表明它来自非大质量恒星。特别是在光学和近红外波长中发现了大量的过量发射,这类似于在一些I型GRBs中观察到的千新星发射。这些观测结果指向了一种新的GRBs始祖类型。在白矮星(white dwarf, WD)与NS合并的场景中,合并后的磁星引擎为所有观测提供了自一致的解释,包括提示伽马射线,早期X射线余辉,以及引擎驱动的千新星发射。
2022年12月6日,福州大学叶克印与康奈尔大学Tristan H. Lambert合作在Nature 杂志在线发表题为“Electrophotocatalytic Oxygenation of Multiple Adjacent C–H Bonds”的研究论文,该研究报道了两个或三个相邻的C-H键通过脱氢和氧合的选择性氧合,使简单的烷基芳烃或三氟乙酰胺转化为相应的二或三乙酰氧基酸酯。该方法通过强氧化催化剂的重复操作来实现这种转化,但条件是有足够的选择性,以避免破坏性的过氧化。这些反应是通过电光催化来实现的,这是一种利用光和电的能量来促进化学反应的过程(点击阅读)。
2022年12月7日,浙江大学林贤丰、范顺武及唐睿康共同通讯在Nature 在线发表题为”A plant-derived natural photosynthetic system for improving cell anabolism“的研究论文,该研究开发了一个基于纳米类囊体单位(NTUs)的独立和可控的纳米植物源光合系统。为了实现跨物种应用,该研究使用特定的成熟细胞膜(软骨细胞膜(CM))进行伪装封装。作为概念的证明,该研究证明了这些CM-NTU通过膜融合进入软骨细胞,避免溶酶体降解并实现快速渗透。此外,CM-NTU在光照下增加细胞内ATP和NADPH的原位水平,并改善退化软骨细胞的合成代谢。它们还可以系统地纠正能量失衡,恢复细胞代谢,改善软骨内稳态,防止骨关节炎的病理进展。该研究治疗退行性疾病的策略是基于天然的光合系统,通过独立提供关键能量和代谢载体,可以控制地增强细胞合成代谢。本研究也加深了对生物有机体和复合生物材料在疾病治疗中的制备和应用的认识(点击阅读)。
2022年12月7日,北京生命科学研究所(NIBS)刘清华研究组在Nature杂志上在线发表了题为“A signalling pathway for transcriptional regulation of sleep amount in mice”的研究论文,该研究利用腺相关病毒介导的体细胞遗传学分析,发现AMPK相关蛋白LKB1-SIK3激酶以及组蛋白脱乙酰化酶HDAC4以及HDAC5对于睡眠持续时间的调节,描述了小鼠睡眠转录调节的主要信号通路,证明了体细胞遗传操纵对于小鼠睡眠研究的重要性(点击阅读)。

几乎所有的新皮层兴奋性神经元都是由径向胶质祖细胞(RGPs)产生的,主要的神经祖细胞暂时存在于发育中的新皮层的心室区。在早期的新皮层发育过程中,RGPs遵循一个增殖和分化的时间程序,产生不同的神经元和胶质细胞,构成新皮层。在发育中的小鼠新皮层中,RGPs在胚胎第12天(E12)之前进行了大量的对称增殖分裂以扩增祖细胞池。然后他们切换到不对称的神经源性分裂,以一种出生日期依赖的由内而外的方式产生占据新皮层的神经元波。
有趣的是,来自同一神经源性RGPs的克隆相关兴奋性神经元沿着其母径向胶质纤维迁移,形成横跨深层和浅层的个体发生径向簇。此外,与邻近的非克隆相关神经元相比,这些克隆相关的兴奋性神经元优先彼此发展突触,并具有相似的生理特性。因此,新皮层中与克隆相关的兴奋性神经元的空间和功能组织偏向于单细胞分辨率。然而,人们对这种组织的分子控制知之甚少。
机理模式图(图源自Nature )
cPCDHs是细胞粘附分子钙粘蛋白超家族的最大亚群,主要在神经系统中表达。cPCDHs因其一些显著特点而备受关注。首先,cPcdh基因能够通过随机而平衡的启动子选择和组合表达的机制产生高水平的细胞表面多样性,使单个神经元具有足够多样性的独特细胞表面身份。其次,PCDHα、PCDHβ和PCDHγ蛋白单体在单个细胞中的不同表达组合成顺式异质二聚体,在细胞表面进行严格的亲同相互作用。
这些特征使单个神经突能够识别自我或非自我,这导致自我回避,以确保神经元有效地覆盖其感受野或投射场,同时保持与相邻神经元重叠的能力。新皮层是最复杂的大脑结构之一,有大量的神经元在结构和功能层面上被特别组织起来。cPCDHs是否以及如何调节新皮层神经元的识别和精细组织是理解新皮层的基本问题。
总之,该研究在单细胞水平上提出了新皮层兴奋性神经元结构和功能组织的分子调节框架,为深入理解大脑结构和功能提供了全新的分子机制。
原文链接:
https://doi.org/10.1038/s41586-022-05495-
—END—
Cell子刊:发现脑损伤后的修复机制——神经元和神经胶质协同驱动神经再生!
![]() 0
2022-06-20
点击查看
0
2022-06-20
点击查看
陈功教授:剧情反转,再次证实星形胶质细胞可转分化为神经元
![]() 0
2022-07-05
点击查看
0
2022-07-05
点击查看

Neuron:何志刚院士合作报道促进轴突再生和神经元存活的新机制
![]() 0
2022-08-02
点击查看
0
2022-08-02
点击查看
Acta Neuropathologica:神经元网络过度兴奋驱动阿尔茨海默病的新机制
![]() 0
2022-08-06
点击查看
0
2022-08-06
点击查看

Neuron: 前额皮层抑制性神经元的双面人生—编码奖赏和恐惧相关价值信息
![]() 0
2022-08-19
点击查看
0
2022-08-19
点击查看

Cell子刊:鲍岚团队揭示m6A修饰lncRNA调控神经发育的分子机制
![]() 0
2022-11-24
点击查看
0
2022-11-24
点击查看