近日,复旦大学基础医学院生物化学与分子生物学系张思团队,继发现细菌成分胞壁酰二肽通过病原微生物识别受体NOD2激活血小板(Circulation, 2015),新冠病毒通过病原微生物识别受体ACE2受体激活血小板(J of Hematology & Oncology,2020),VEPH1调控病原微生物代谢产物介导的肝癌mTOR信号(J of Hepatology, 2020)后, 再次在病原微生物识别受体领域取得重要成果,以原创论著形式于2021年1月7日,在J of Hematology & Oncology正式发表,题目为“Hepatic NOD2 promotes hepatocarcinogenesis via a RIP2-mediated proinfammatory response and a novel nuclear autophagy-mediated DNA damage mechanism”。该项研究利用多种转基因小鼠动物模型,阐明了病原微生物识别受体NOD2引起肝脏炎症和基因不稳定性的机制。

肝脏发生损伤时可引起肠道菌群失调和肠道渗透性增加,肠源性细菌成分通过门静脉系统到达肝脏增多而清除减少,逐渐累积的细菌成分可持续促进肝脏疾病发展,形成“二次打击”,但介导病原微生物二次打击的识别受体尚不明确。团队研究发现:细菌成分胞壁酰二肽可通过激活病原微生物识别受体NOD2,活化NF-κB、MAPK和STAT3信号通路,促进炎症因子的释放而加重肝脏炎症反应。更重要的是,团队在国际上首次发现:NOD2激活后,能够进入细胞核,引起核自噬。而核自噬降解维持基因组稳定的关键蛋白lamin A/C,从而增加基因组的不稳定性,导致正常细胞死亡转变为肿瘤细胞机率增加,增加致癌性(图一)。
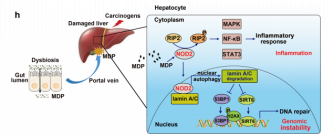
图一:病原微生物识别受体NOD2激活后,促进炎症因子的释放和基因不稳定性的机制
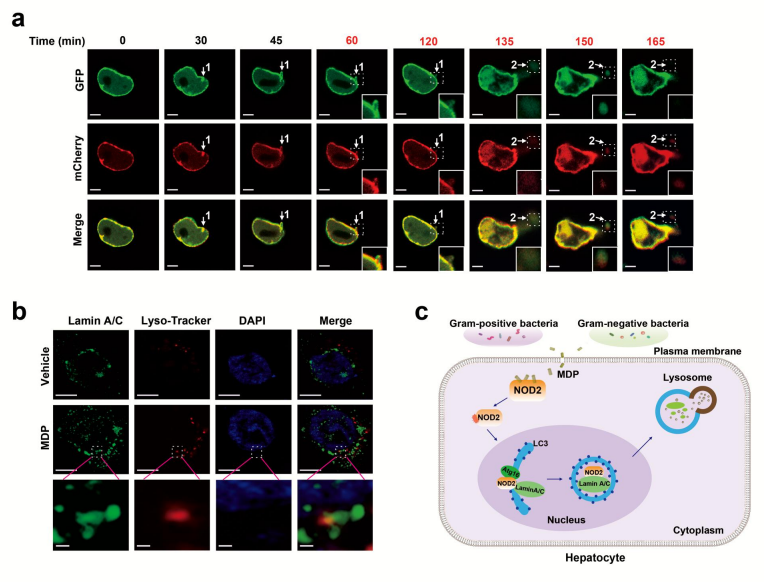
mCherry-GFP-lamin A/C的肝细胞的时间推移图像显示,NOD2活化后,在0-120分钟的运输过程中,伴随着45分钟时膜出泡,Lamin A/C逐渐从细胞核转移到细胞质。在135-165分钟时进入溶酶体。超分辨率显微镜证实了NOD2活化后,lamin A/C被溶酶体降解(图二)。
NOD2在肝癌样本中的表达模式:在80对肝癌样本中,与匹配的相邻的非肿瘤肝组织相比,NOD2的表达在67.5%(54/80)的HCC样本中增加。分析TCGA数据库的队列中,以及两个GSE数据库队列(GSE124535,GSE121248),得到同样的结果。30个随机选择的肝癌样本的蛋白免疫印迹显示NOD2在肝癌样本中增加(图三)。
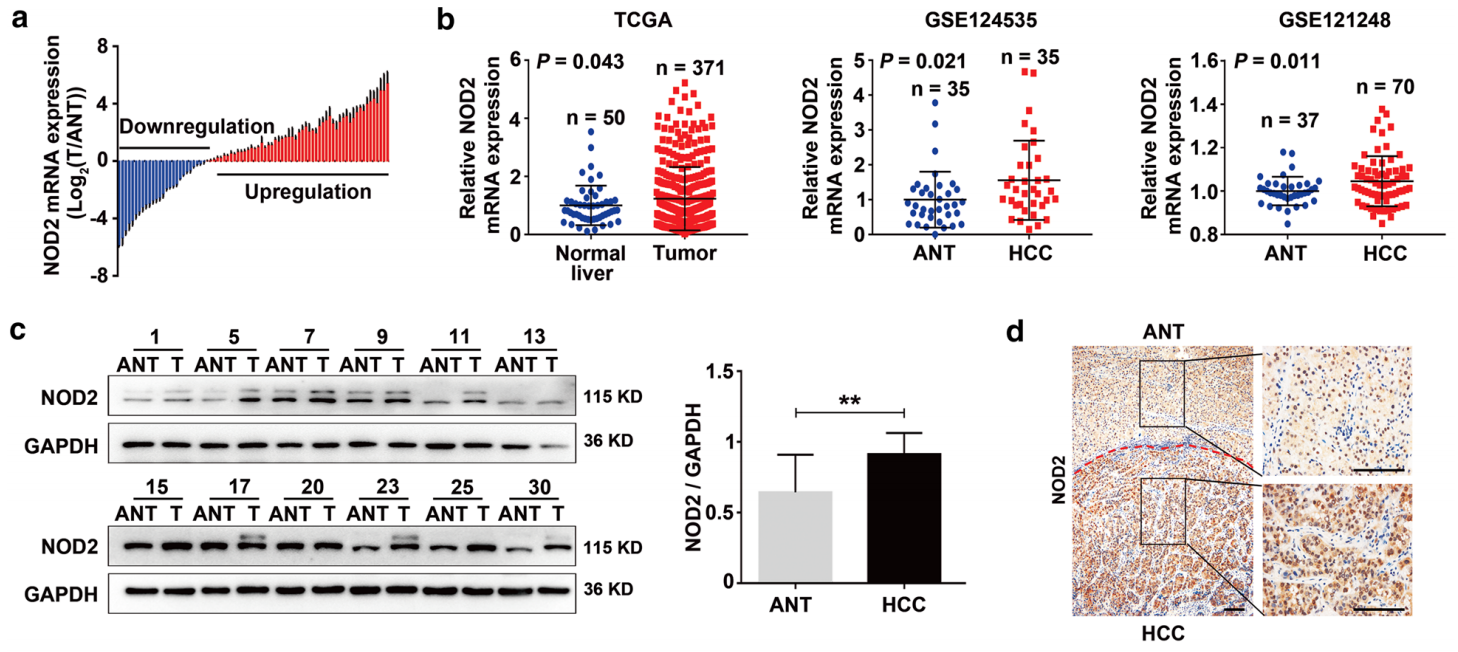 图三:NOD2受体在肝癌样本中的表达模式
图三:NOD2受体在肝癌样本中的表达模式
复旦大学附属中山医院周怡博士为第一作者,中山医院消化科唐文清(博士,医师),郑州大学第一附属医院胡亮副教授为并列第一作者。张思老师为通讯作者,基础医学院陈舌教授,中山医院消化科薛如意副主任医师,为论文的联合通讯作者。参与指导的重要作者包括中山医院消化科沈锡中主任,董玲主任,张顺财主任,刘红春副主任,李东平博士,普外科马丽杰医师。该项研究受到国家自然科学基金项目的资助。
原文出处:
Zhou, Y., Hu, L., Tang, W. et al. Hepatic NOD2 promotes hepatocarcinogenesis via a RIP2-mediated proinflammatory response and a novel nuclear autophagy-mediated DNA damage mechanism. J Hematol Oncol 14, 9 (2021). https://doi.org/10.1186/s13045-020-01028-4