PD-1/PD-L1肿瘤免疫治疗分子标志物大全
![]() 0
2018-12-17
点击查看
0
2018-12-17
点击查看
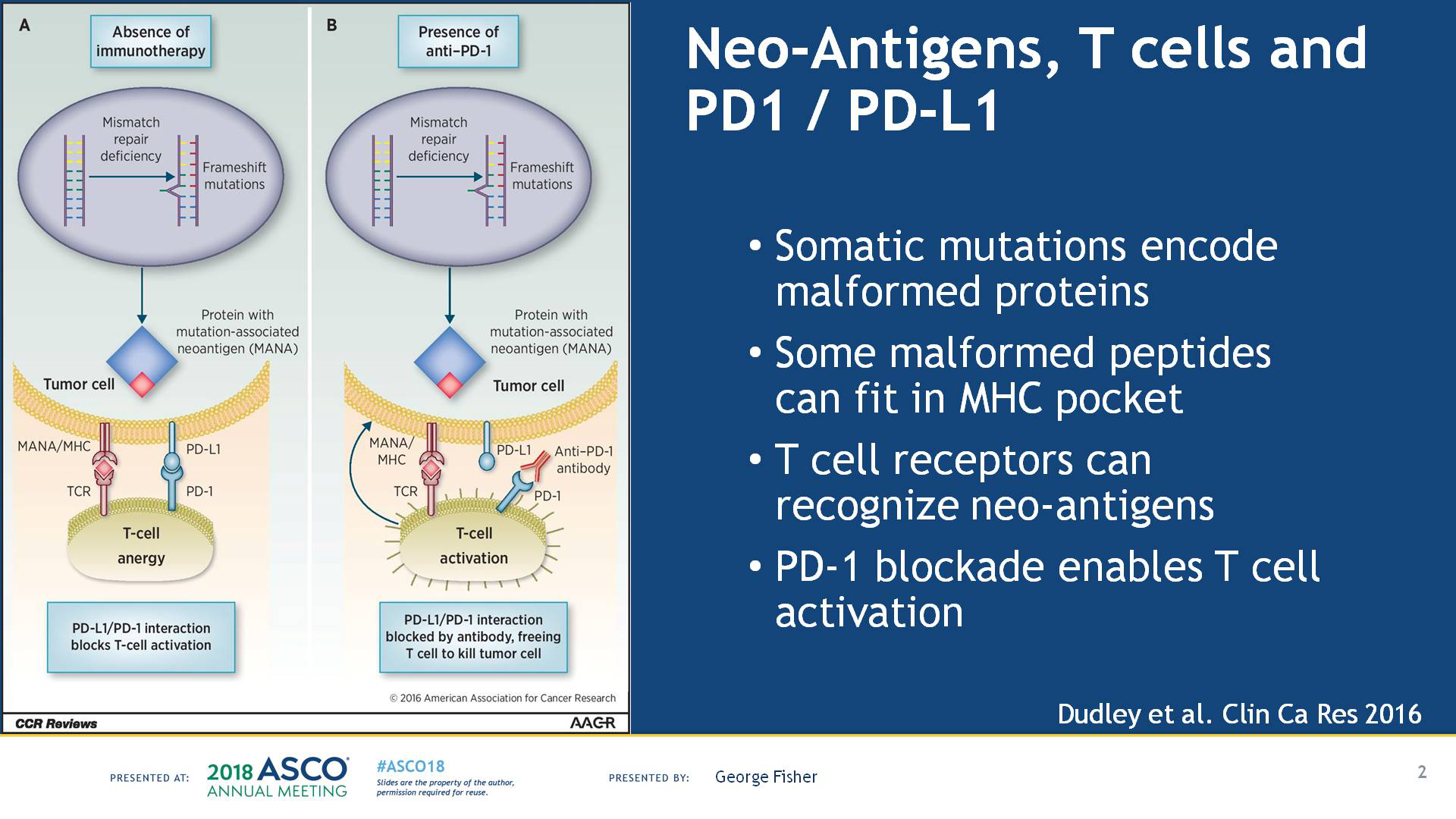
国产PD-1抗体获批上市,预期价格更“亲民”
![]() 0
2018-12-18
点击查看
0
2018-12-18
点击查看

CLIN CANCER RES:Treg磷酸化STAT3增加以及抑制功能降低与转移性黑色素瘤患者PD-1阻断治疗获益有关
![]() 0
2018-12-21
点击查看
0
2018-12-21
点击查看

秦叔逵教授:肝癌大国的PD-1之路,看免疫疗法如何破冰晚期肝癌治疗!
![]() 0
2018-12-26
点击查看
0
2018-12-26
点击查看
抗癌免疫药PD-1大战,拼的不仅仅是速度和价格
![]() 0
2019-01-11
点击查看
0
2019-01-11
点击查看

百时美施贵宝的PD-1单抗Opdivo未来增长前景堪忧
![]() 0
2019-01-25
点击查看
0
2019-01-25
点击查看
