1病史:
女性,25岁,急性髓系白血病2年,本次因“发现右乳肿块1月”入院。
2辅查:
乳腺MRI平扫+增强:双侧乳腺呈c型,低背景强化,左侧乳腺见两枚长T1、短T2信号肿块,形态不规则,最大约27mmx26mmx28mm,边缘不规则,增强后明显强化,周围可见增多、增粗血管影,时间-信号曲线呈Ⅱ型,弥散受限。右乳外下象限可见呈象限分布强化灶,最大截面约61mmx30mm,周围可见增多、增粗血管影。
3组织病理活检
3.1大体肉眼观:左乳肿块:灰白穿刺组织三条,长10-15mm,直径1mm.右乳肿块:灰白穿刺组织两条,长15-17mm,直径1mm。
3.2镜下观(图1-图7):低倍镜下乳腺穿刺组织中可见弥漫增生的淋巴样细胞,排列呈条索状或巢状,向乳腺间质及周围脂肪浸润性生长;中倍镜下,成片的单个核细胞,细胞排列松散,弥散一致,部分排列成线样、列兵样,可见纤细纤维间隔。细胞中等偏大,核仁不清楚,核呈原形至折叠核,染色质细腻,可见散在少量嗜酸性粒细胞及核分裂象。部分细胞呈髓母细胞,胞质稀少,核圆形,可见小核仁,部分细胞呈髓单核或单核母细胞样,局部纤维组织增生。
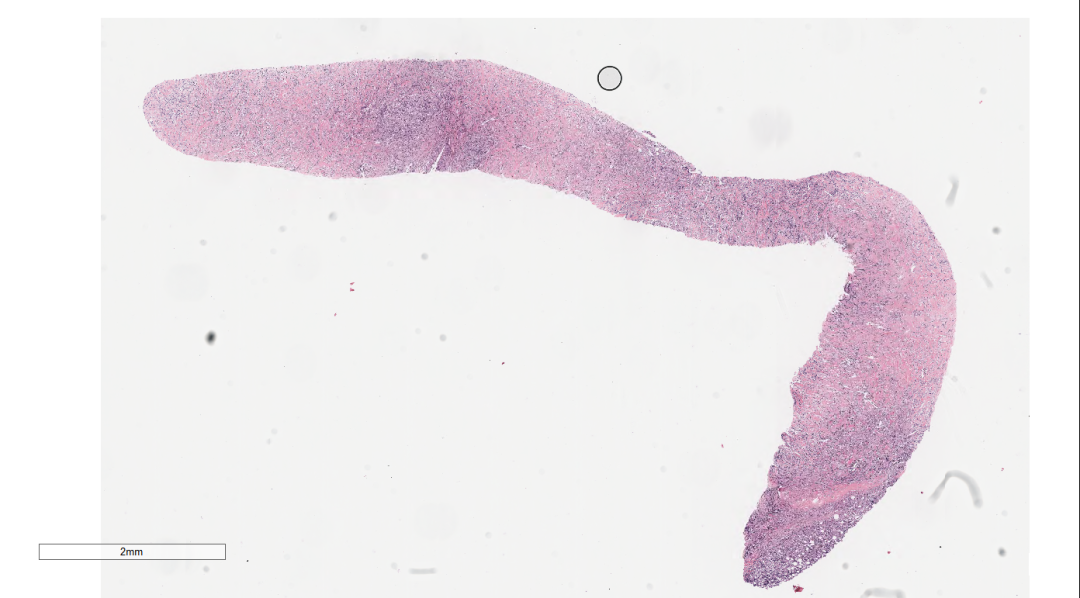
图1 低倍镜下乳腺穿刺组织,未见明显乳腺小叶结构.
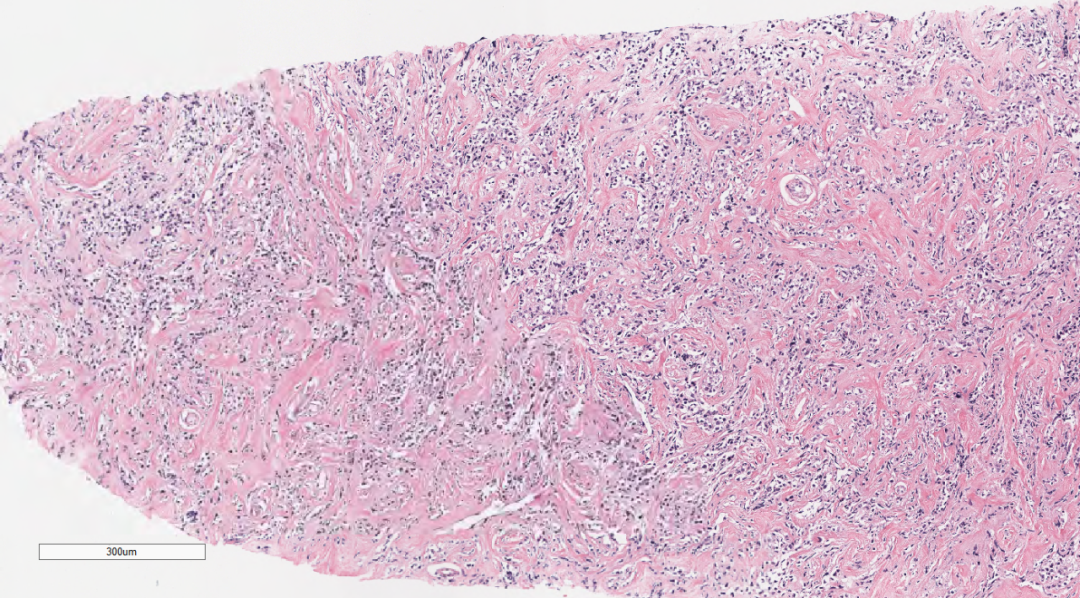
图2低倍镜下,肿瘤呈条索状分布.
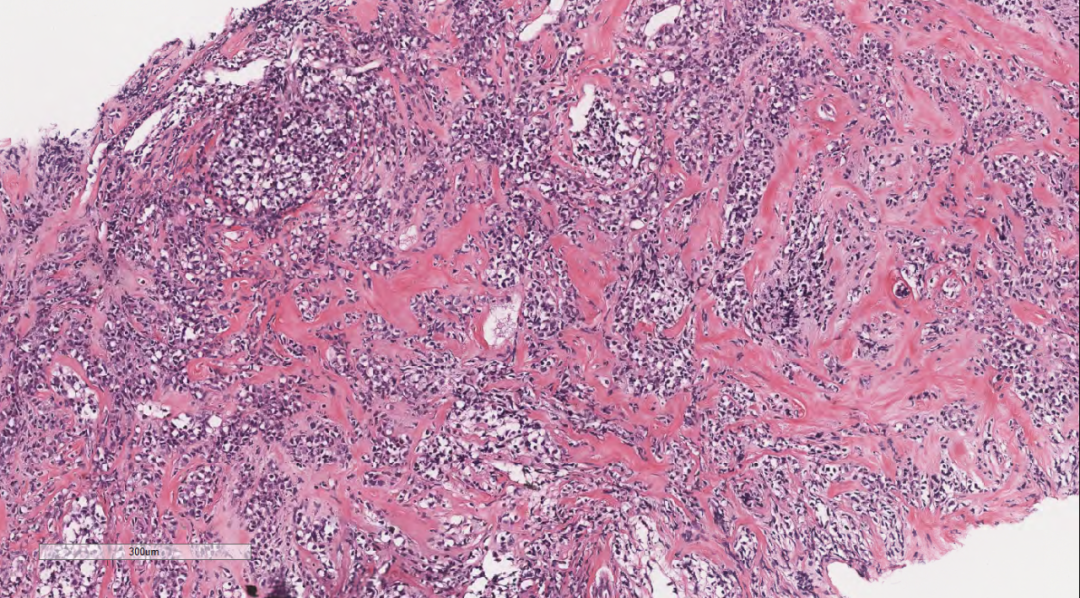
图3中倍镜下肿瘤细胞排列呈条索状或巢状,向乳腺间质浸润性生长。
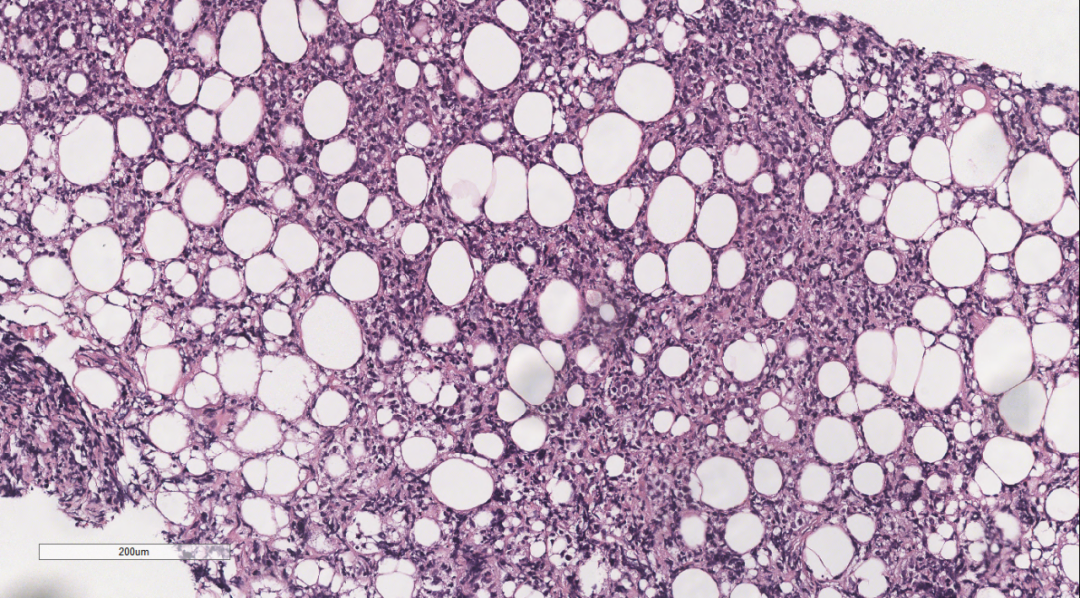
图4肿瘤细胞向脂肪浸润性生长。
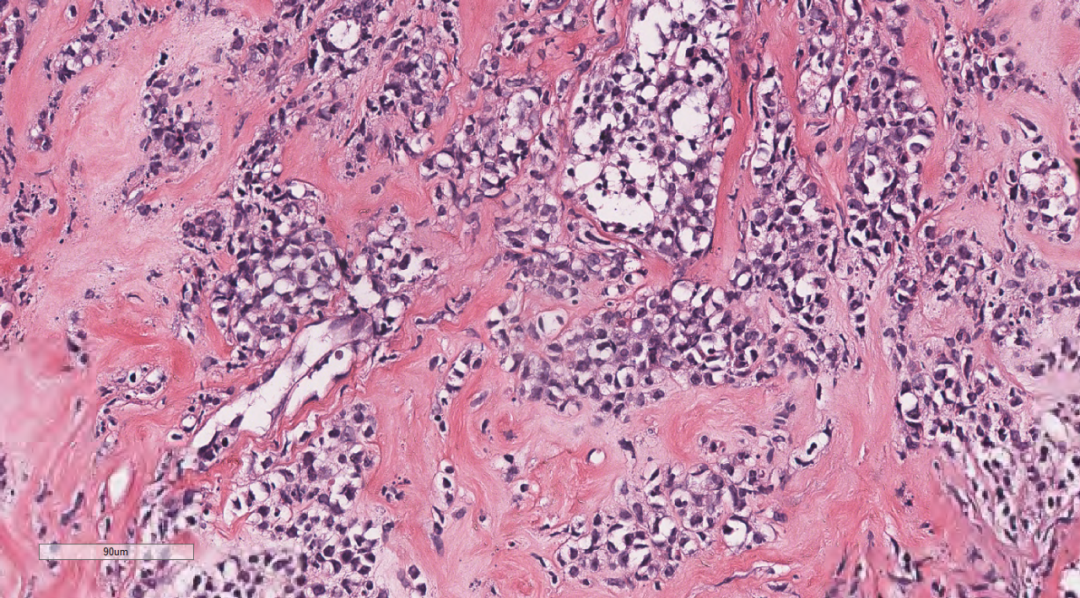
图5弥漫增生的淋巴样细胞,部分排列成线样、列兵样,可见纤细纤维间隔。
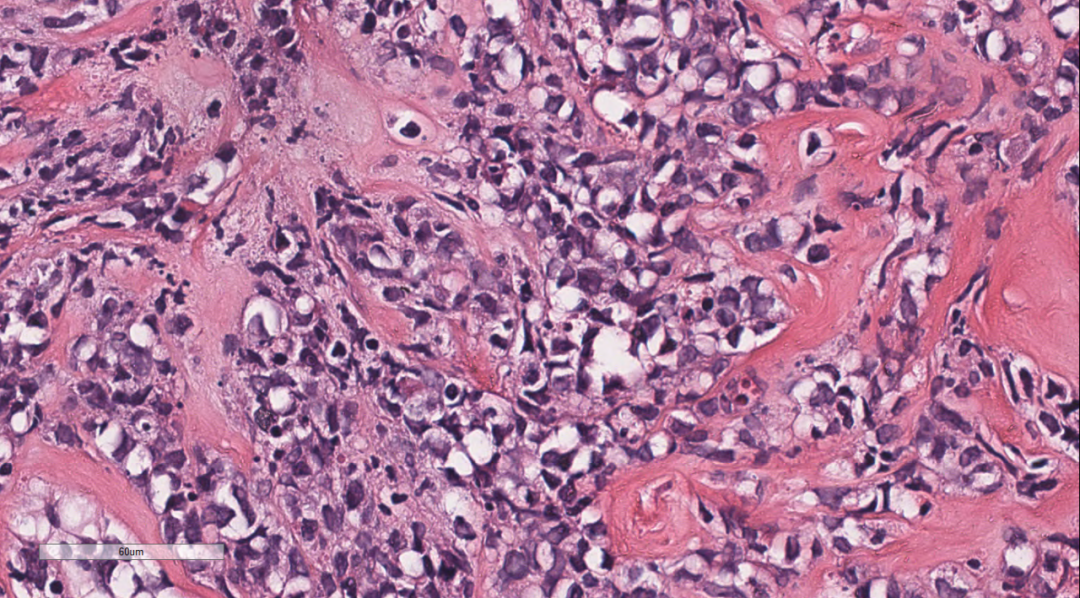
图6 细胞中等偏大,核仁不清楚,核呈原形至折叠核,染色质部分空亮,局部纤维组织增生。
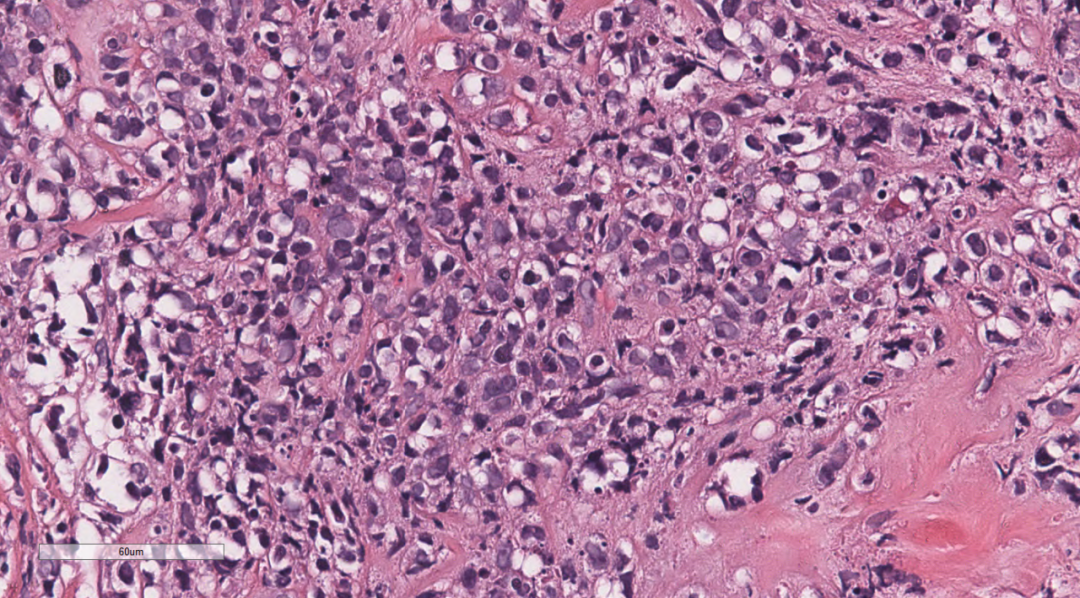
图7 部分细胞呈髓母细胞样,胞质稀少,核圆形,可见小核仁
3.3免疫组化:免疫组化示肿瘤细胞Vimentin(+),LCA(+)(图8),MPO(+)(图9),CD68(+)(图10),CD117(+)(图11),CD15(+),CD123(散在+),CD34(散在+),CK(-),CD20(-),CD3(-),GATA3(-),TRPS1(-),Ki-67(70%+)。
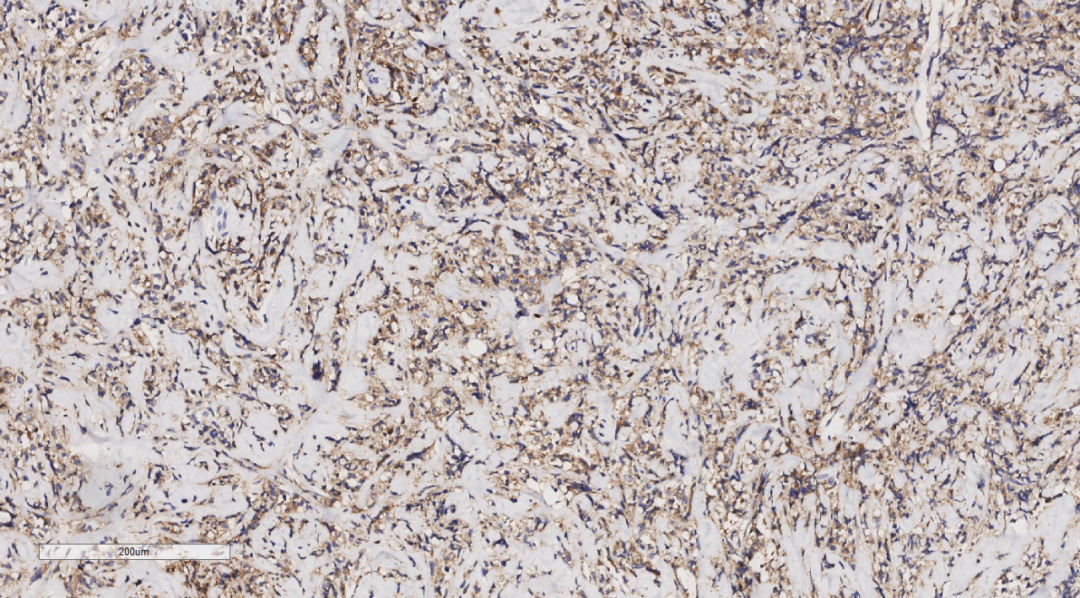
图8 免疫组化示肿瘤细胞LCA(+)。
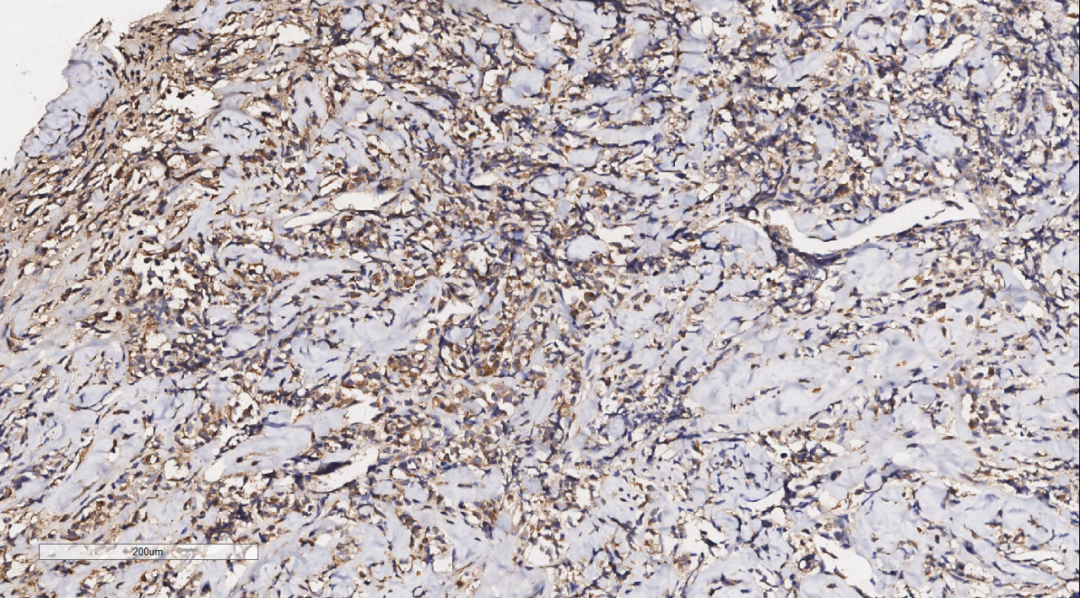
图9 免疫组化示肿瘤细胞MPO(+)。

图10免疫组化示肿瘤细胞CD68(+)。
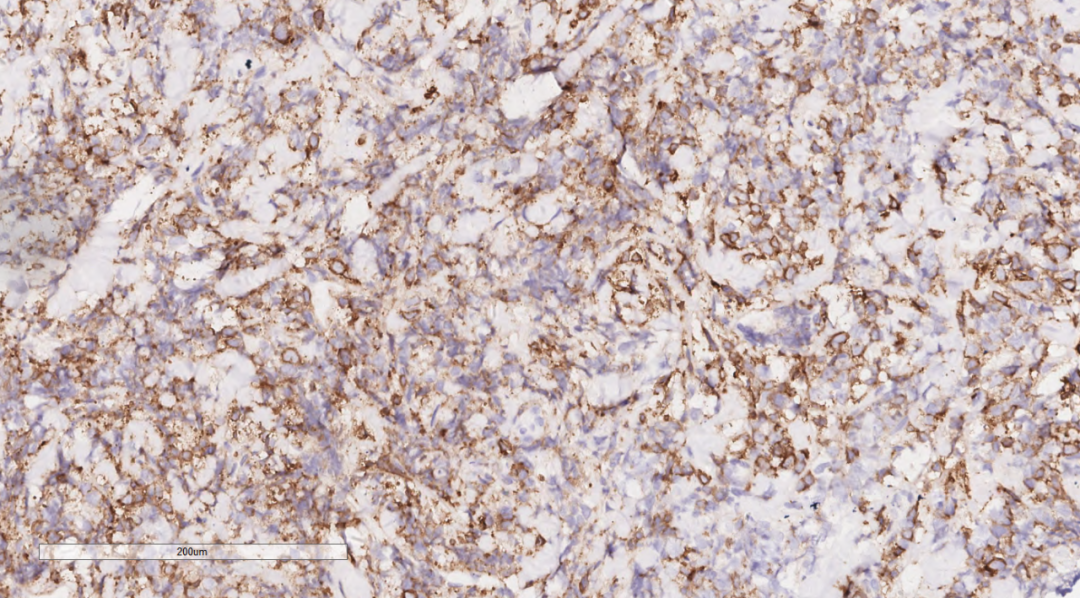
图11 免疫组化示肿瘤细胞CD117(+).
病理诊断:
(双侧乳腺)符合髓系肉瘤累及乳腺。
讨 论
1背景:
原发性乳腺淋巴瘤少见,占乳腺恶性肿瘤的0.5%,约占所有非霍奇金淋巴瘤的1%,占结外淋巴瘤<3%。最常见的原发性乳腺淋巴瘤是弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)。髓系肉瘤(MS)是一种发生于骨髓以外部位由髓系母细胞形成的瘤块,可伴有或不伴有成熟成分。也称为粒细胞肉瘤、绿色瘤、髓外髓系肿瘤。髓系肉瘤最早于1811年由Burns报道,多与慢性骨髓增生性肿瘤有关。髓系肉瘤可发生于淋巴结、软组织、胃肠道、乳腺等部位。至今,文献报道的乳腺髓系肉瘤病例约70例。
2. 乳腺髓系肉瘤的临床病理特征
2.1临床特点
乳腺髓系肉瘤较少见,患者可有AML、髓细胞增生性肿瘤或骨髓异常增生综合征病史,也可以没有AML病史,表现为孤立性髓系肉瘤。不到10%的髓系肉瘤可侵犯多个部位。年龄23~47岁,平均33.8岁。髓系肉瘤多发生于年轻人。诊断AML至发生乳腺髓系肉瘤的时间为8个月至5年半(平均30.6个月),可出现LDH升高。患者常表现为乳腺肿物。病变可侵犯一侧或双侧乳腺。也可还侵犯眼眶、中枢神经系统等其他部位。乳腺髓系肉瘤多数病例为Ⅰ期。临床表现及影像学检查没有特异性,与乳腺癌类似。所以只依靠临床症状、体征和常规辅助检查难以做出髓系肉瘤的诊断,临床病史和LDH升高有助于诊断。
2.2影像学
MS 中最为常见的GS可发生于全身各部位,影像学检查为重要的辅助检查之一,其表现虽缺乏高度特异性,但具有共同特征:①肿块多呈弥漫性生长,边界不清;②肿块多呈等密度信号;③病灶明显弥散受限,ADC图上呈现显著低信号;④周边较中心强化程度高;⑤自血病性的 CS多有邻近部位的骨髓或全身的骨髓代谢异常,FDGPET上可见骨髓腔呈弥漫性的代谢活跃,MRI上可见到骨髓信号异常。
2.3病理学特征
镜下观:髓系肉瘤可见弥漫增生的淋巴样细胞,细胞中等大小或中等偏大,染色质细腻,呈原始细胞表现,可见小核仁。成片的单个核细胞,细胞排列松散,弥散一致,部分排列成线样、列兵样,可见纤细纤维间隔。细胞中等偏大,核仁不清楚,核呈原形至折叠核,染色质细腻,可见散在少量嗜酸性粒细胞及核分裂象。部分细胞呈髓母细胞,胞质稀少,核圆形,可见小核仁,部分细胞呈髓单核或单核母细胞样,局部纤维组织增生。部分病例可见坏死。
免疫表型:疫表型表达白细胞共同抗原(LCA)、MPO、CD117、CD34、CD43、CD10、溶菌酶、CD68、CD99。有报道,髓系肉瘤可表达B细胞标志物、TdT、CD123、CD4、CD30,可能给诊断带来困难。约20%的病例可表达CD56,少数病例可表达CD123、CD303,16%的病例可表达NPM1。
分子遗传学:约55%的髓系肉瘤病例可检测到染色体缺失。包括第7、16号染色体单体,第4、8、11号染色体三体、KMT2A重排、inv(16)、第16号染色体单体、16q、5q或20q丢失。二代测序研究显示,皮肤AML中NPM1的突变发生率较高(>50%),其中75%的病例呈单核细胞特征。
3. 鉴别诊断
乳腺髓系肉瘤主要应与以下肿瘤相鉴别:
(1)乳腺浸润性癌:髓系肉瘤可见纤维组织增生,排列呈巢片状或单排(印第安列兵样结构),后者可类似于浸润性小叶癌。髓系肉瘤中乳腺导管和小叶结构保留,而浸润性小叶癌是有失粘附的细胞组成的浸润性乳腺癌,通常以散在的或单排、线性方式浸润间质,导管周围同心圆排列,通常伴有小叶原位癌。免疫组织化学CK、LCA、ER、PR可进行。
(2)淋巴瘤:DLBCL及Burkitt淋巴瘤等应与髓系肉瘤鉴别。髓系肉瘤可见不成熟嗜酸性粒细胞,但并非所有病例均可见到,尤其是在分化不成熟的肿瘤及单核细胞肿瘤。此外,DLBCL的细胞核染色质呈泡状,核仁清楚,核膜较厚,不同于髓系肉瘤,后者的染色质不成熟,核呈肾形。Burkitt淋巴瘤可见"星天"现象,细胞中等大小,排列呈"铺路石"样结构,可见多个核仁,胞质稀少嗜碱性,不同于髓系肉瘤,表达B细胞标志物,不表达MPO。
(3)淋巴母细胞淋巴瘤/白血病:细胞分化较原始,染色质细腻,形态学不易与髓系肉瘤区分。但免疫组织化学表达B或T细胞标志物及TdT,不表达MPO,有助于鉴别。
(4)移植后淋巴组织增生性病变(post-transplant lymphoproliferative disorders,PTLD):骨髓与器官移植后,因移植前需要做预处理,移植后需应用免疫抑制剂,可发生PTLD,包括非破坏性(浆细胞增生、旺炽性滤泡增生及传染性单核细胞增生症样),多形性、单形性和经典型霍奇金型PTLD。其中单形性PTLD包括B、T/NK细胞淋巴瘤,形态学及免疫组织化学与普通型非霍奇金淋巴瘤类似,但EB病毒编码的小RNA(EBER)常常呈阳性。本组9例均为骨髓移植后患者,肿瘤细胞形态较单一,需要与单形性PTLD鉴别。但B细胞、T细胞标志物阴性,EBER阴性,MPO、CD117等髓系标志物阳性有助于鉴别。
(5)小圆细胞恶性肿瘤:尤其是儿童需考虑鉴别,如神经母细胞瘤、横纹肌肉瘤、Ewing肉瘤/PNET、髓母细胞瘤等。结合形态学及免疫组织化学有助于鉴别。
(6)低分化癌:免疫组化角蛋白阳性;LCA、ER、PR阴性。
(7)硬化性淋巴细胞性小叶炎:多见于年轻和中年女性,常累及双侧乳腺·小叶内大量淋巴、浆细胞浸润;腺泡和导管上皮层内可有淋巴细胞浸润;腺泡可萎缩或消失;间质明显纤维化、透明变性。
4.治疗及预后
髓系肉瘤的临床行为和对治疗的反应与年龄、性别、病变部位、发病时有无AML、组织学类型等无关。确诊后进行化疗,或手术切除后辅以化疗、放疗及行供者淋巴细胞输注(donor lymphocyte infusion,DLI)。部分学者建议,对于异基因造血干细胞移植(allogeneic haematopoietic stem cell transplant,allo-HSCT)后复发的髓系肉瘤,除以上治疗方法以外,还应进行DLI、二次骨髓移植等治疗。并加强移植后患者的髓外病灶检测,早发现、诊断、治疗以改善预后。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1]陈定宝,张焕,孔方舟,等. 乳腺髓系肉瘤与弥漫性大B细胞淋巴瘤临床病理特征的比较[J]. 中华病理学杂志,2020,49(3):250-255. DOI:10.3760/cma.j.issn.0529-5807.2020.03.008
[2]吴文静,廖辉,黄璜,等. 双侧乳腺髓细胞肉瘤1例[J]. 临床军医杂志,2019,47(1):108-109. DOI:10.16680/j.1671-3826.2019.01.41.
[3]牛永华,李凤华,杜晶. 乳腺髓细胞肉瘤超声表现1例[J]. 中华超声影像学杂志,2009,18(2):127. DOI:10.3760/cma.j.issn.1004-4477.2009.02.011.
[4]陈亚辉,刘伶俏,蒙天云,等. 乳腺髓系肉瘤临床病理观察附一例病例报告[J]. 健康之友,2019(5):3-4.
[5]符鹏,刘凤恩,余冬敏,等. 乳腺癌术后胸壁伴发髓系肉瘤1例[J]. 赣南医学院学报,2023,43(8):843-845. DOI:10.3969/j.issn.1001-5779.2023.08.017.